Экскреция мочевины в норме 25 гсут
 Скачать 4.94 Mb. Скачать 4.94 Mb.
|
|
Утилизация аммиака в орнитиновом цикле мочевинообразования (химизм процесса, локализация различных этапов, регуляция, количество выводимой мочевины в сутки, энергетические затраты). Наследственные нарушения орнитинового цикла – гипераммониемии, их основные причины и проявления. Наиболее значительные количества аммиака обезвреживается в печени путем синтеза мочевины – орнитиновый цикл мочевинообразования. • Мочевина – основной конечный продукт азотистого обмена, в составе которого из организма выделяется до 90% всего выводимого азота. • Экскреция мочевины в норме – 25 г/сут. • Мочевина синтезируется только в печени. • Первые две реакции синтеза мочевины протекают в митохондриях, остальные три – в цитоплазме Полный набор ферментов орнитинового цикла есть только в гепатоцитах. •Регуляция цикла осуществляется активированием карбамоилфосфатсинтетазы 1 N – ацетилглутаматом.  •Источники азота для синтеза мочевины - Один атом азота из глутамина, второй – из аспартата. Энергетический баланс процесса: • Энергетические затраты синтеза одной молекулы мочевины – за 1 оборот цикла расходуется 4 макроэргические связи, которые компенсируются при дезаминировании глутамата и регенерации аспартата с образованием НАДН2 • Кроме того, энергетические затраты происходят и при трансмембранном переносе цитруллина и орнитина и при переносе мочевины из крови в почки за счет градиентаNa+, создаваемого К+, Na+ - АТФазы Суммарное уравнение синтеза мочевины. СО2 + NH3 + Аспартат + 3АТФ + 2Н2О Мочевина + Фумарат + 2 (АДФ + Н3РО4) + + АМФ + 2Н3РО4 Биологическая роль цикла • Превращение азота аминокислот в мочевину и предотвращение накопления токсических продуктов, в том числе NH3. • Синтез оргинина и пополнение его фонда в организме. .Гипераммониемии • Гипераммониемии – повышение содержания аммиака в крови. Нарушение орнитинового цикла наблюдается и при гепатитах различной этиологии и некоторых других вирусных заболеваниях. • Известны пять наследственных заболеваний, обусловленных дефектом пяти ферментов орнитинового цикла: 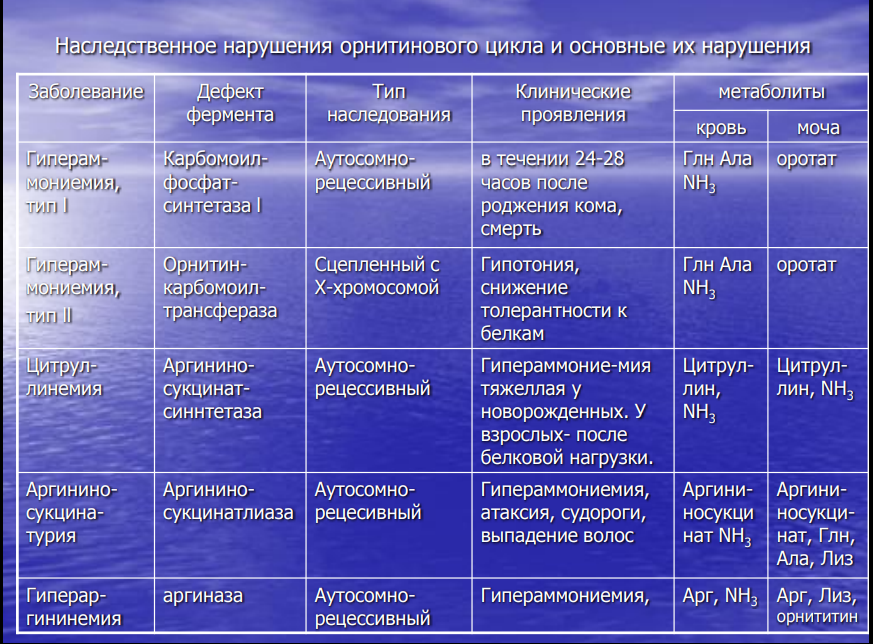 Судьба безазотистого остатка аминокислот. 1) Кетогенные (тре, илей, лей, трипт, лиз, фен, тир) аминокислоты. 2) Глюкогенные (ала, гли, сер, цис, тре, асп, тир, фен, вал, мет, гис, про, арг) аминокислоты. 3) Синтез заменимых аминокислот (ала, асп, асн, сер, гли, глу, глн, про). 4) Анаплеротические реакции пополнения общего пути катаболизма. Судьба углеродного скелета аминокислот. • Основной путь использования остатков аминокислот – глюконеогенез.  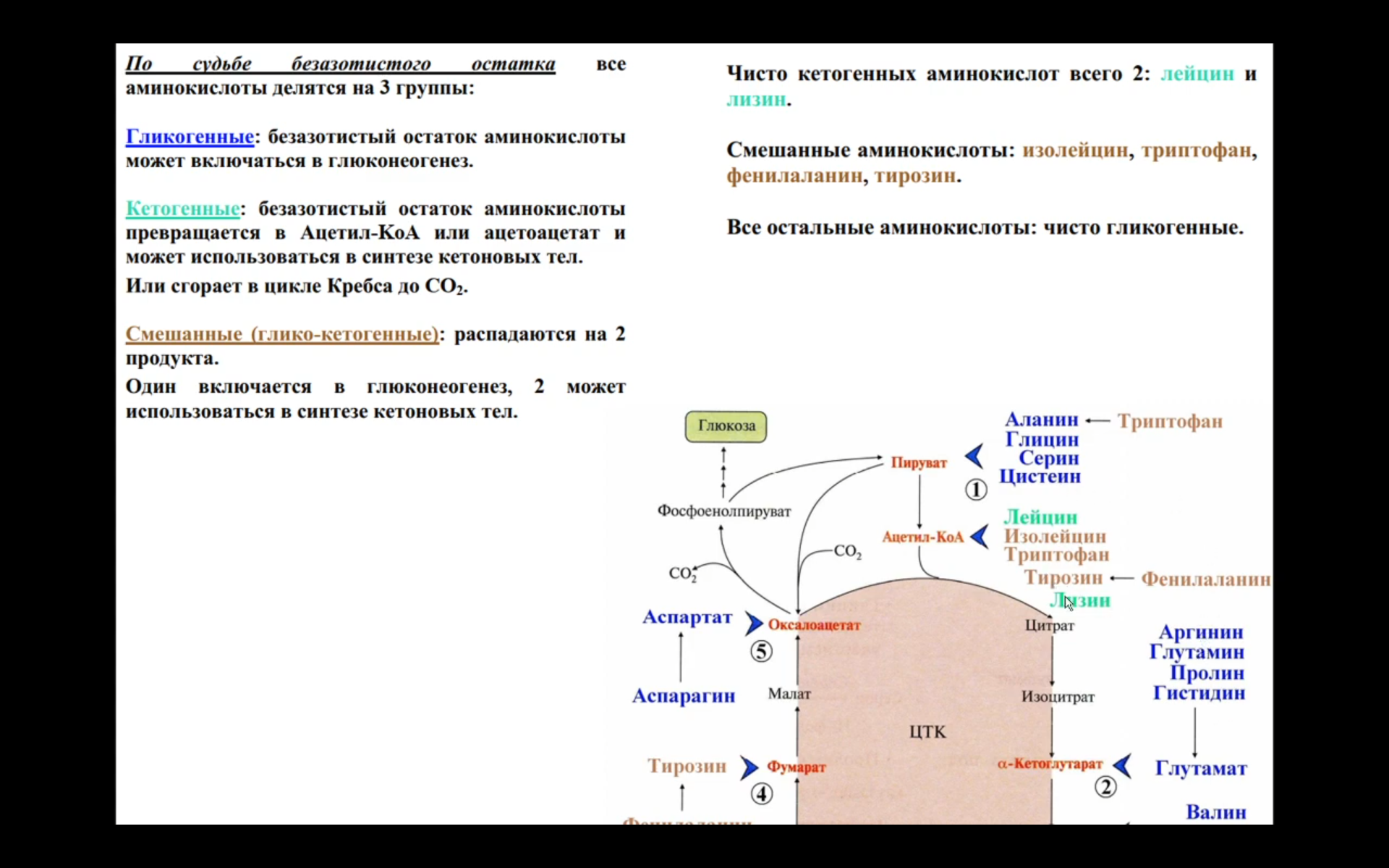 2  3 • Углеродный скелет этих аминокислот образуется из глюкозы, источником α аминогруппы служит глутамат.   3. Декарбоксилирование аминокислот, общий вид реакции, фермент, кофермент, продукты. 1) продукты реакции декарбоксилирования, получение следующих биогенных аминов и их биороль: · путресцин и его производные – спермин, спермидин. Роль S-аденозил-метионина в их синтезе.  · гистамин 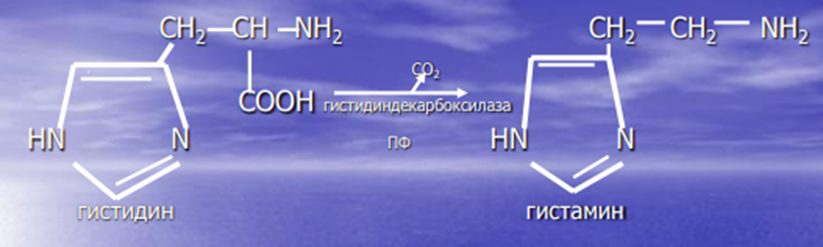 регуляторных факторов местного действия (гистамин, карнозин, спермин). Гистамин стимулирует секрецию желудочного сока, слюны. • Повышает проницаемость капилляров, вызывает отеки, снижает АД • Сокращает гладкую мускулатуру легких, вызывает удушье • Участвует в формировании воспалительной и аллергической реакциях • Является нейромедиатором и медиатором боли. · серотонин Серотонин– является нейромедиатором. • Стимулирует сокращение гладкой мускулатуры, сужает сосуды гладкой мускулатуры, регулирует АД. Образует гормон – мелатонин, который регулирует суточные и сезонные изменения метаболизма и репродуктивные функции Биогенные амины выполняют функции нейромедиаторов (серотонин, дофамин, ГАМК), 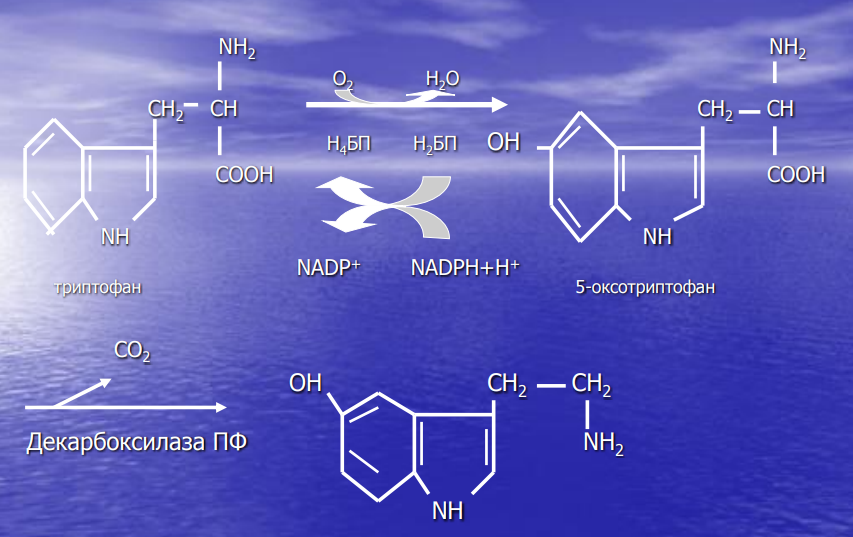 · ГАМК  Образование и биороль ГАМК • ГАМК образуется в нервных клетках, она служит основным тормозным медиатором высших отделов мозга • Цикл превращений ГАМК в мозге включает три сопряженных реакции – глутаматдекарбоксилазную, аминотрансферазную и дегидрогеназную. • ГАМК увеличивает проницаемость постсинаптических мембран для ионов К+, что вызывает торможение нервного импульса, улучшает кровоснабжение головного мозга и дыхательную активность нервной ткани • Лекарства гаммалон или аминалон, применяемые при атеросклерозе, гипертонии, эпилепсии, нарушениях мозгового кровоснабжения. 2) инактивация биогенных аминов Инактивация биогенных аминов • Избыточное накопление биогенных аминов может вызвать различные патологические отклонения. Механизм инактивации аминов: • Метилирование с участием SAM под действием метилтрансфераз (так инактивируется гистамин, адреналин)  · метилирование с участием SAM гистамина, адреналина · окислительное дезаминирование монооксидазами (МАО) дофамина, норадреналина, серотонина, ГАМК. Схема процесса, кофактор МАО. Окисление моноаминооксидазами (МАО) с коферментом ФАД (дофамин, норадреналин, серотонин, ГАМК)  Обмен фенилаланина и тирозина в печени и других тканях и возможные его нарушения. Обмен фенилаланина и тирозина в печени и других тканях и возможные его нарушения • Фенилаланин – незаменимая аминокислота. В процессе метаболизма в разных тканях превращается в тирозин. Эта реакция катализируется специфической монооксидазой – фенилаланингидроксилазой, кофактором которой служит тетрагидробиотерин (Н4БП). Далее начинается метаболизм тирозина в разных тканях • Особенности обмена тирозина в печени. Здесь катаболизм тирозина происходит до конечных продуктов – СО2 , Н2О через фумарат и ацетоацетат. • На первой стадии происходит трансаминирование тирозина с αкетоглутаратом с образованием nгидроксифенилпирувата. • П-гидроксифенилпируват окисляется в гомогентизиновую кислоту через декарбоксилирование и перенос боковой цепи. Данная реакция катализируется ферментом nгидроксифенилпируватдиоксигеназой с коферментом Fe2+. • Разрыв бензольного ядра идет под действием диоксигеназы гомогентизиновой кислоты с участием витамина С, Fe2+ и приводит к образованию фумарилацетата. • Гидролиз фумарилацетата под действием фумарилацетоацетатгидролазы приводит к образованию фумарата и ацетоацетата. Фумарат может окисляться до СО2 и Н2О , а может идти на глюконеогенез. Ацетоацетат окисляется как кетоновое тело до СО2 , Н2О, АТФ. • В печени здоровых людей небольшая часть фенилаланина превращается в фениллактат и фенилацетилглутамин.  • При нарушении основного пути – фенилаланина в тирозин – этот путь становится главным. Это происходит из-за дефекта фенилаланингидроксилазы, что приводит к заболеванию – фенилкетонурии. Выделяют 2 формы ФКУ: • Классическая ФКУ – связана с мутациями в гене фенилаланингидроксилазы, что приводит к снижению активности фермента или полной его инактивации. Концентрация фенилаланина в крови повышается в 20-30, раз в моче резко возрастает концентрация фенилпирувата и фениллактата при полном отсутствии их в норме. Проявления ФКУ – умственная и физическая недостаточность. Частота заболевания: 1:10000 новорожденных. |
