бх лекции. Общие пути обмена аминокислот
 Скачать 1.21 Mb. Скачать 1.21 Mb.
|
|
Общие пути обмена аминокислот. Пути распада аминокислот до конечных продуктов можно разделить на 3 группы: Пути распада, связанные с превращением NH2-групп. Декарбоксилирование Превращения углеродного скелета аминокислот. Превращение В тканях организма происходит отщепление аминогрупп с образованием аммиака. Этот процесс называется дезаминированием. Возможны 4 типа дезаминирования: Восстановительное R-CH-COOH | NH2 Гидролитическое R-CH-COOH | | NH2 OH Внутримолекулярное R-CH2-CH-COOH | NH2 Окислительное R-CH-COOH | || NH2 O Окислительное дезаминирование бывает 2 видов: прямое и непрямое (трансдезаминирование). Прямое окислительное дезаминирование осуществляется оксидазами. В качестве кофермента содержат ФМН или ФАД. Продуктами реакции являются кетокислоты и аммиак. Трансдезаминирование (непрямое) – основной путь дезаминирования аминокислот. Трансдезаминирование проходит в 2 этапа. Первый – трансаминирование – перенос аминогруппы с любой аминокислоты на Второй – собственно окислительное дезаминирование. В результате первого этапа аминогруппы «собираются» в составе глутаминовой кислоты. Второй этап связан с окислительным дезаминированием глутаминовой кислоты. Трансаминирование аминокислот было открыто советскими учеными Браунштейном и Крицман (1937г). R R1 R R1 | | | | HC-NH2 + C=O | | | | COOH COOH COOH COOH Реакция трансаминирования обратима, она катализируется ферментами – аминотрансферазами. Акцептором аминогрупп в реакциях трансаминирования являются три СН3 COOH CH3 COOH | | АЛТ | | НСNH2 + CH2 | | | | COOH CH2 COOH CHNH2 | | C=O COOH | глутамат COOH Аминотрансферазы содержат в качестве кофермента производные пиридоксина (витамин В6) – пиридоксаль-фосфат и пиридоксамин-фосфат. (Механизм реакции трансаминирования с участием пиридоксальфосфата – учебник.) Окислительное дезаминирование глутаминовой кислоты. Биологический смысл реакций трансаминирования состоит в том, чтобы собрать аминогрупы всех распадающихся аминокислот в составе одной аминокислоты – глутаминовой. Глутаминовая кислота поступает в митохондрии клеток, где происходит второй этап трансдезаминирования – собственно дезаминирование глутаминовой кислоты. Реакция катализируется глутаматдегидрогеназой, которая в качестве кофермента содержит НАД+ или НАДФ+. COOH СООН | | (  CH2)2 CH2)2 | | CHNH2 НАД НАДН+Н+ C=O | | COOH COOH Клиническое значение определения активности трансаминаз. Для клинических целей определяют активность АлТ и АсТ, которые катализируют следующие реакции: Аспартат + Аланин + В сыворотке крови здоровых людей активность этих трансаминаз ниже, чем в органах. При поражении органов наблюдается выход трансаминаз из очага поражения в кровь. Так, при инфаркте миокарда уровень АсТ сыворотки крови уже через 3-5 ч после наступления инфаркта повышается в 20-30 раз. При гепатитах повышается более умеренное и затяжное. Декарбоксилирование аминокислот. Процесс отщепление карбоксильной группы в виде СО2 называется декарбоксилированием и приводит к образованию биогенных аминов, которые оказывают фармакологическое действие на физиологические функции человека. 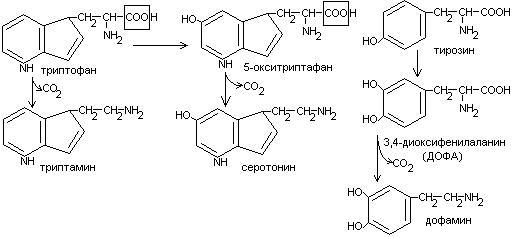 Серотонин обладает сосудосуживающим действием, участвует в регуляции артериального давления, t тела, дыхания, медиатор нервных процессов. Дофамин- предшественник катехоламинов. 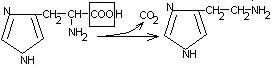 гистидин гистамин Гистамин обладает сосудорасширяющим действием. Он образуется в области воспаления, участвует в развитии аллергических реакций. НООС-(СН2)2-СН-СООН | | глутамат NH2 NH2 ГАМК является тормозным медиатором. В лечебной практике используется при лечении эпилепсии (резкое сокращение частоты припадков). Орнитин декарбоксилируясь дает диамин – путресцин, а лизин – кадаверин. СН2-СН2-СН2-СН-СООН | | | NH2 NH2 NH2 CH2-CH2-CH2-CH2-CH-COOH | | | NH2 NH2 NH2 В организме биогенные амины подвергаются реакции окислительного дезаминирования с образованием альдегидов и аммиака. Процесс осуществляется при участии моноаминооксидаз. Схематически механизм трансдезаминирования можно представит так:  Пути превращения аминокислот в печени. 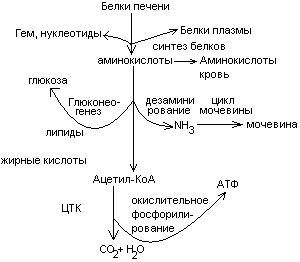 Включение углеродных скелетов аминокислот в цикл лимонной кислоты.   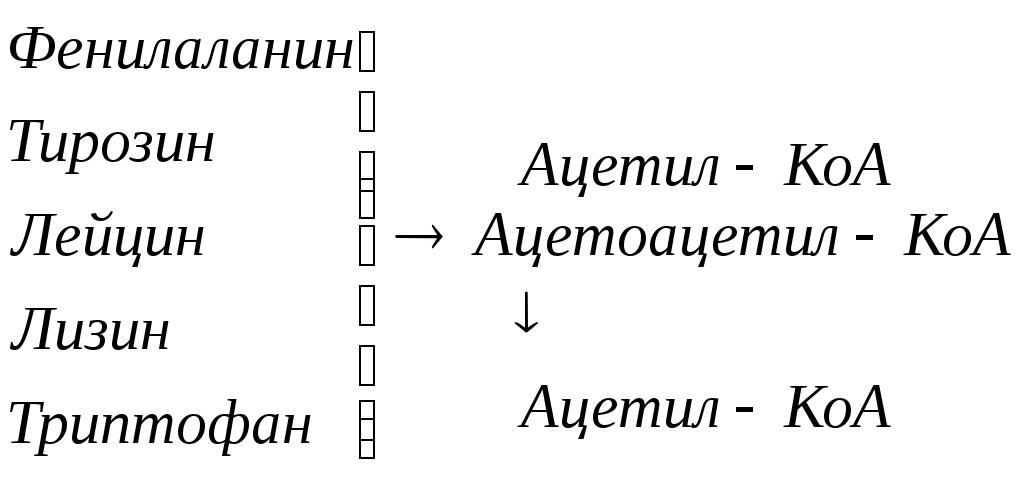 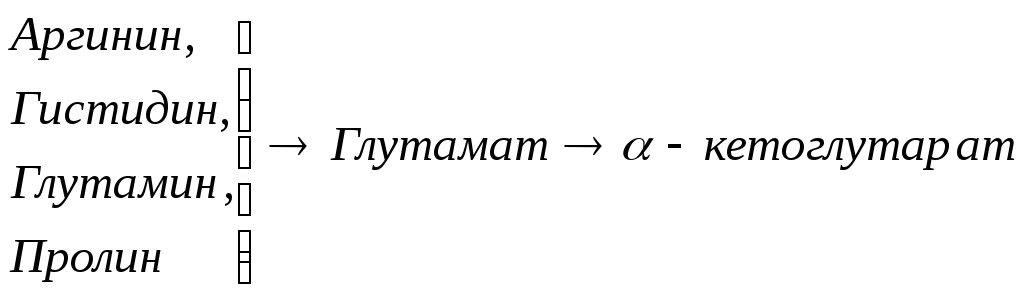 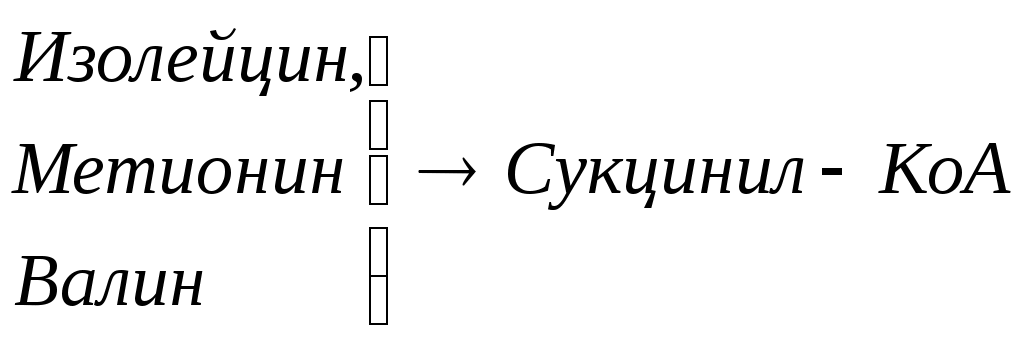 Синтез аминокислот Заменимые аминокислоты образуются в печени из глутаминовой кислоты. Источником всех атомов углерода (а также азота аминогрупп) пролина, орнитина и аргинина является глутамат. Источником углерода аланина, серина и глицина служат трехуглеродные промежуточные продукты гликолиза, а источником азота их аминогрупп – глутамат; аспартат получает углерод от оксалоацетата, а азот от глутамата. Глутамат + Восстаниовительное аминирование в печени и других тканях обеспечивает сохраниение и повторное использование аммиака. Большая часть аминокислот синтезируется в результате переноса аминогрупп от других аминокислот без превращения в NH3. Трансаминирование = переаминирование = аминирование Мак-Мюррей, стр.276 Трансаминированию в печени не подвергаются аминокислоты с разветвленной цепью – лейцин, изолейцин, валин. Эти аминокислоты вступают в реакции трансаминироания в почечной и мышечной тканях. Лизин и треонин не вступают в реакцию трансаминирования. Азотистый обмен В организме человека ежесуточно распадается на аминокислоты около 400 г беков и столько их синтезируется. Основная функция белков пластическая. Белки могут выполнять энергетическую функцию при избыточном их поступлении с пищей или в экстремальных ситуациях, когда белки тела подвергаются усиленному распаду. Этот процесс наблюдается при голодании или патологии (при сахарном диабете). При сгорании 1 г белков высвобождается 16,8 кДж. Под термином «резервные» белки понимают не особые отложения белков, а легкомобилизуемые при необходимости тканевые белки, которые после гидролиза под действием тканевых протеиназ дают аминокислоты. Факторы определяющие состояние белкового обмена. Возраст (в детском возрасте, при активной мышечной работе, беременности), состояние организма – резко повышается потребность в белках. Характер питания (количественный и качественный состав пищи). При недостаточном поступлении белков с пищей происходит распад белков ряда тканей (печени, плазмы, крови). Введение с пищей повышенных количеств белка не оказывает заметного влияния на состояние белкового обмена, если избыточное поступление белка не превышает 2-3 раза. Качественный состав белков важен, т.к. отсутствие или недостаток хотя бы одной какой-либо незаменимой аминокислоты нарушает процесс биосинтеза белков в организме. Синтез белка подчиняется закону «все или ничего» и осуществляется при условии наличия в клетке полного набора 20 аминокислот. Обмен белков связан с обеспеченностью организма витаминами В1, В2, В6, РР и др. Секреция гормонов (СТГ, гормоны щитовидной железы, андрогены, эстрогены). Для оценки состояния обмена белков используется понятие азотистый баланс. Азотистый баланс – разница между введением с пищей азота и выведением его в виде конечных продуктов азотистого обмена. Различают 3 вида азотистого баланса: Положительный – количество выводимого из организма азота меньше количества азота, вводимого с пищей. Азот остается в организме и расходуется на синтез белков. Характерен для растушего организма и во время беременности. Отрицательный – количество выделяемого азота превышает количество азота, поступающего в течение суток. Встречается при голодании, белковой недостаточности, тяжелых заболеваниях, когда происходит интенсивный распад белков тела. Отрицательный азотистый баланс наблюдается у пожилых людей. Азотистое равновесие – количество азота выводимого из организма, равно количеству получаемого с пищей азота. Характерно для здорового взрослого человека. Биологическая ценность белков. Определяется следующими критериями: Чем ближе аминокислотный состав пищевого белка к аминокислотному составу беков тела, тем выше его биологическая ценность. В составе белка должны быть все незамеимые аминокислоты: вал, илей, лей, лиз, мет, тре, три, фен. Исключение какой-либо незаменимой аминокислоты из пищи сопровождается развитием отрицательного азотистого баланса. В составе белка установлены пропорциональные величины незаменимых аминокислот, относительно триптофана, принятого за единицу, лиз-5, лей-4, вал-3,5. Недостаток в пище одной незаменимой аминокислоты ведет к неполному усвоению других аминокислот. Для человека наиболее ценны белки молока, яиц, мяса, т.к. их аминокислотный состав ближе к аминокислотному составу органов и тканей человека. В результате недостаточного поступления белков в организм возникает синдром Квашиоркор. Чаше всего наблюдается в странах Африки при постоянном употребление растительной пиши, бананов. Поражает детей в период отнятия от груди. Нарушение нормального синтеза белка в печени вызывает снижение содержания сыворотного альбумина, что приводит к отеку, снижение содержания ЛОНП приводит к развитию жирового поражения печени. Снижен синтез гемоглобина, в результате развивается анемия. Резко нарушается функция кишечника, т.к. из недостатка аминокислот страдает синтез ферментов поджелудочной железы. Смерть наступает от диареи, острых инфекций и хронических заболеваний печени. 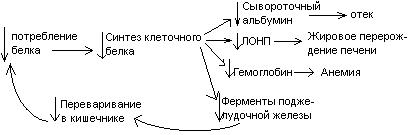 Переваривание и всасивание Переваривание белков происходит в 3 этапа: в желудке; в тонком кишечнике; в клетках слизистой оболочки тонкого кишечника. Расщепление белков происходит при участии нескольких групп ферментов: Экзопептидазы – катализирует разрыв концевой пептидной связи с образованием одной какой-либо аминокислоты. Эндопептидазы – гидролизуют пептидные связи внутри полипептидной цепи. К эндопептидазам относятся следующие ферменты: пепсин, гастрин, трипсин, химотрипсин, эластаза. К экзопептидазам относятся: карбоксипептидазы, аминопептидазы, дипептидазы. Экзопептизазы участвуют в переваривании белков в тонком кишечнике. В результате расщепления образуются свободные аминокислоты, которые затем подвергаются всасыванию. Аминокислоты всасываются свободно с ионами натрия. Некоторые аминокислоты обладают способностью конкурентно тормозить всасывание других аминокислот: Лизин тормозит всасывание аргинина. Это позволяет считать, что существует общая переносящая система. Часть аминокислот в кишечнике под действием микрофлоры подвергается гниению. В результате гниения аминокислот в кишечнике образуются ядовитые продукты распада – фенол, индол, крезол, скатол, сероводород. Распад цистеина, цистина, метионина приводит к образованию сероводорода, метилмеркаптана. Диаминокислоты – арнитин и лизин подвергаются декарбоксилированию с образованием путресцина и кадаверина. Микробные ферменты кишечника превращают тирозин триптофан После всасывания эти продукты через воротную вену попадают в печень, где обезвреживаются путем связывания с серной или глюкуроновой кислотами с образованием парных кислот, которые выделяются с мочей. 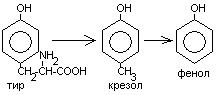 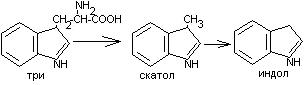 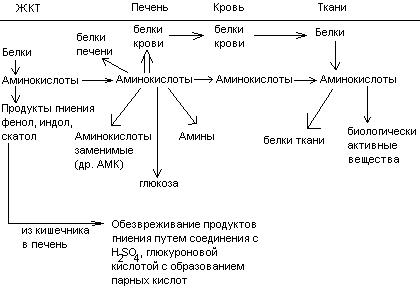 Аминокислоты как лекараственные препараты. Препараты гидролизатов белков – используются для перентерального питания. К ним относятся гидролизин, гидролизат казеина, аминопептид, церебролизин, аминокровин, фиброносол. Применяют после операций на ЖКТ, у больных с нарушениями переваривания белков и аминокислот, при тяжелых ожегах. Препараты отдельных аминокислот. Метион – липотропный фактор, а также для лечения белковой недостаточности при хронических заболеваниях. Цистеин – при нарушениях обмена серосодержащих белков (хрусталик, роговица глаза, коллаген), при отравлениях солями тяжелых Ме, которые связываются аминокислотами. Глутаминовая кислота и аспарагиновая кислота (калиевые и магниевые соли – препарат панангин, аспаркам) используются для обезвреживания аммиака. Пути обезвреживания аммиака. Уровень аммиака в норме в крови не превышает 60 мкМоль/литр. Для кроликов концентрация аммиака 3 мМоль/литр является летальной. В организме существует 4 пути обезвреживания аммиака. О НООС-СНСН2СH2СООН НООС-СН-(СН2)2-СONH2 | | NH2 NH2 Глутамин выделяется с мочой. Восстановительное аминирование Эта реакция обратная окислительному дезаминированию глутяминовой кислоты. Дальше глутамат связывает еще одну молекулу NH3 и дают глутамин. Глу+NH3 Глутамин используется почками как резервный источник аммиака, необходимый для нейтрализации кислых продуктов обмена при ацидозе. Образование аммонийных солей. Аммиак в почках акцептирует протон кислоты, образуя аммонийную соль. Одновременно этот процесс обеспечивает сбережение организмом ионов Na+, которые в отсутствие ионов аммония выводились бы с анионами кислот. NH3+Н+Cl- Биосинтез мочевины. Мочевина – главный конечный продукт обмена азота в организме. С мочой за сутки выводится 25-30 г мочевины. Синтез мочевины идет в печени. Превращение аммиака в мочевину осуществляется в форме цикла. Цикл мочевины открыли Ганс Кребс и Курт Хенселайт (1932г). Первая аминогруппа, поступающая в цикл мочевины, получается в виде свободного аммиака при окислительном дезаминировании глутамата в митохондриях клеток печени. Эта реакция катализируется глутаматдегидрогеназой, для действия которой требуется НАД+ Глутамат+НАД++Н2О Аммиак соединяется с двуокисью углерода с образованием карбомоилфосфата. Реакция требует затраты АТФ. Катализирует эту реакцию карбомоилфосфатсинтетаза. На следующей стадии карбомоилфосфат взаимодействует с орнитином с образованием цитрулина. Образовавшийся цитрулин переходит из митохондрий в цитозоль клеток печени. Цитрулин взаимодействует с аспартатом в присутствии АТФ с образованием аргининсукцината. Эта реакция катализируется аргининсукцинатсинтетазой. На следующей стадии аргининсукцинат расщепляется с образованием аргинина и фумарата. Фумарат возвращается в пул промежуточных продуктов цикла лимонной кислоты. На последней стадии аргинин под действием аргиназы расщепляется на мочевину и орнитин. Регенерированный орнитин вновь поступает в митохондрии. Мочевина из клеток печени поступает в кровь и через почки выводится с мочой. 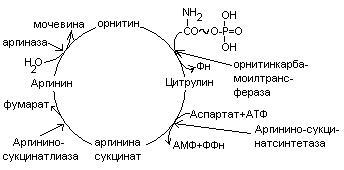 Повышение концентрации аммиака в крови может вызвать повторяющуюся рвоту, возбуждение, припадки с потерей сознания (печеночная кома) и судорогами. При хронической врожденной гипераммониемии наблюдается отставание умственного развития. Наиболее частая причина гипераммониемии – нарушение орнитинового цикла. В орнитиновом цикле участвует 5 ферментов и имеет место 5 типов наследственных болезней. Люди с такими дефектами не переносят пищи, богатой белком. Детей с таким нарушением лечат введением Почему высокое содержание NH4+ токсично? Ион аммония сдвигает равновесие реакции, катализируемой глутаматдегидрогеназой, в сторону образования глутамата, а это приводит к истощению глутаматдегидрогеназа глутаминсинтетаза Энергетическая цена синтеза мочевины На синтез одной молекулы мочевины расходуется 4 высокоэнергетические фосфатные группы. Две молекулы АТФ требуются для образования аргининосукцината. Но в последней реакции АТФ подвергается пирофосфат, который гидролизуется с образованием 2 молекул ортофосфата. Поэтому на синтез мочевины расходуется 4 молекулы АТФ. Синтез заменимых аминокислот Аминирование СООН COOH | НАДФН2+NH4+ НАДФ | (   CH2)2 (CH2)2 CH2)2 (CH2)2 | | C=O CHNH2 | | COOH COOH Переаминирование Глу + пир Глу + ЩУК асн Глю 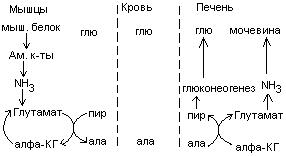 Токсическое действие аммиака. ЦТК Способ лечения: Перевод на малобелковую пищу Замена заменимых аминокислот на кетокислоты (незам) Гепатоцит 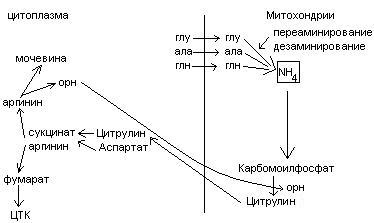 Индивидуальные пути обмена аминокислот. |
