бх лекции. Общие пути обмена аминокислот
 Скачать 1.21 Mb. Скачать 1.21 Mb.
|
PO3H2 |
| Г  лутатион лутатион | Сер | Т  каневые белки каневые белки |
| | | Г  люкоза люкоза |
| М    уравьиная кислота уравьиная кислота | Гли | Л     ипиды ипиды |
| Гиппуровая кислота | | Гем |
| Креатин | Тре | Пурины (ДНК, РНК) |
| | | Желчные кислоты |
| | |
C

 =NH CH3 C=NH АТФ C=NH
=NH CH3 C=NH АТФ C=NH
 | | |
| | |NH N-CH3 N-CH3
| | |
CH2 CH2 CH2
| | |
COOH COOH COOH
Креатин Креатинфосфат
Источником метильного радикала является метионин.
Серин – заменимая аминокислота, углеродная часть которой образуется из глюкозы:
Г


 лю
лю 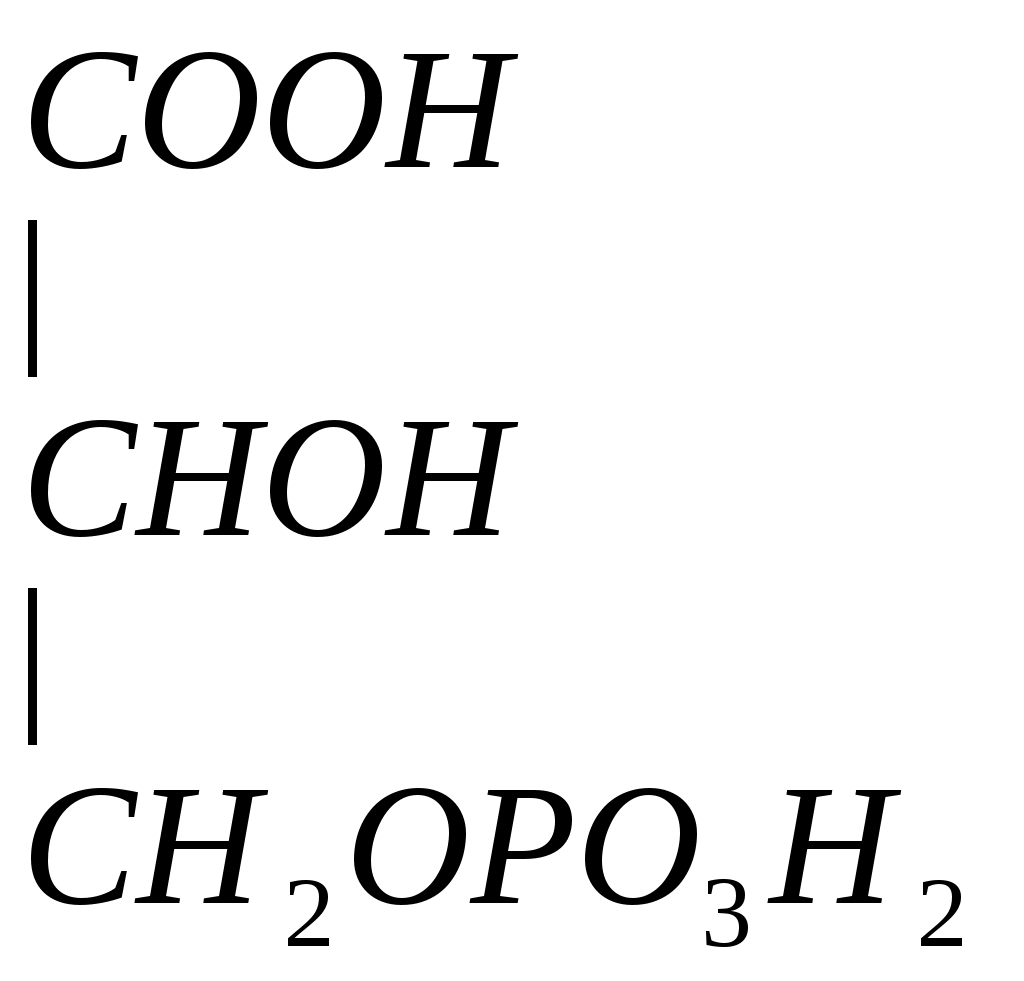 НАД НАДН
НАД НАДН 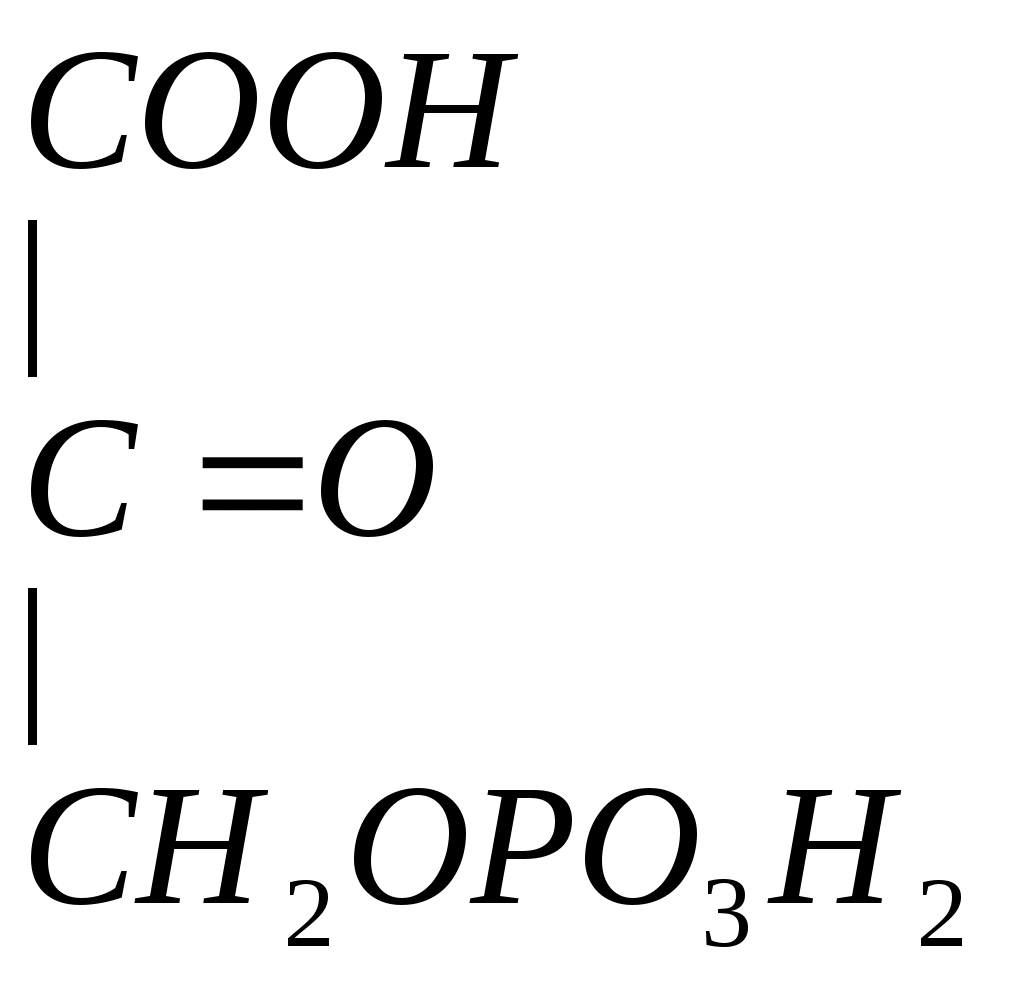
г


 лутамат
лутамат 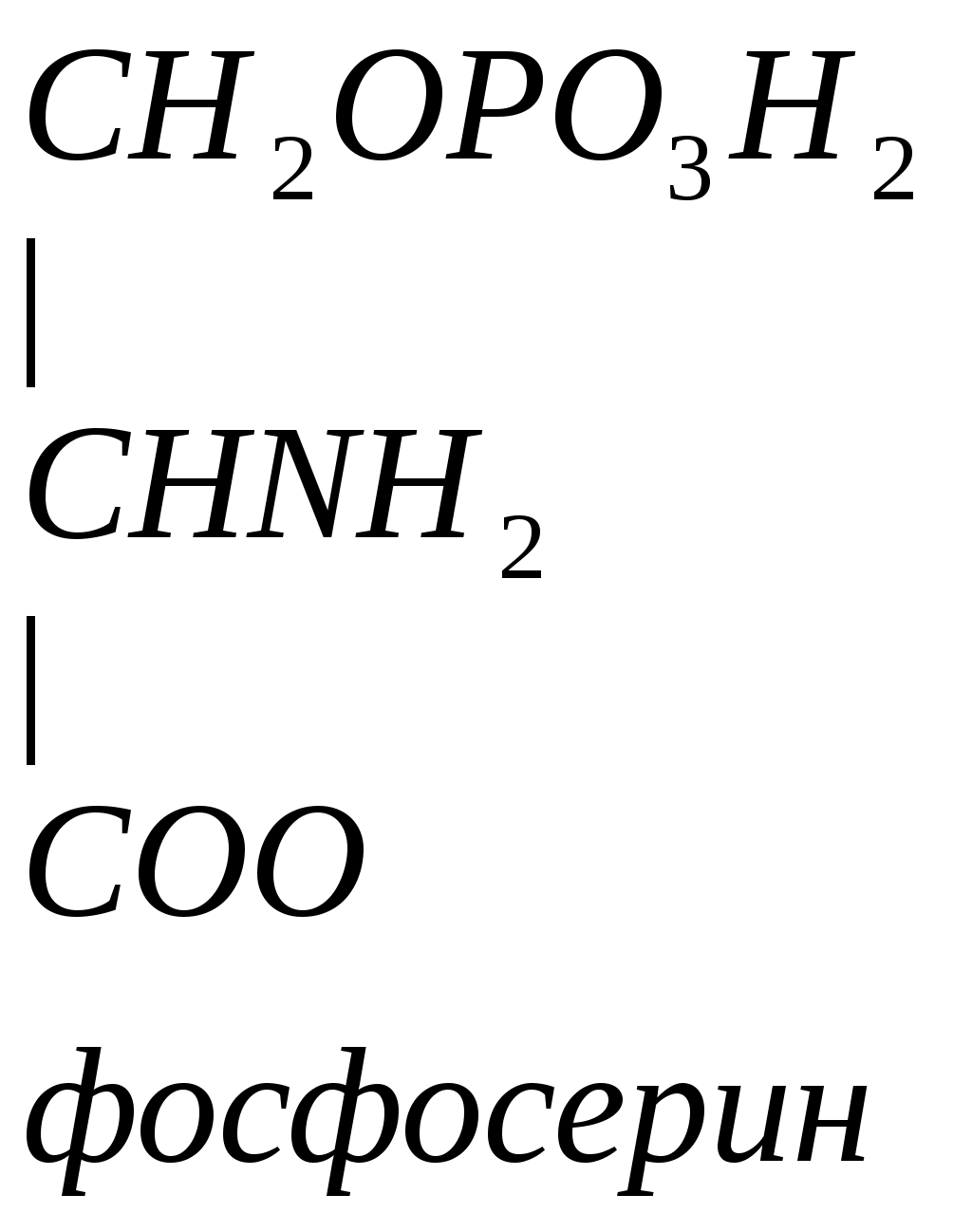
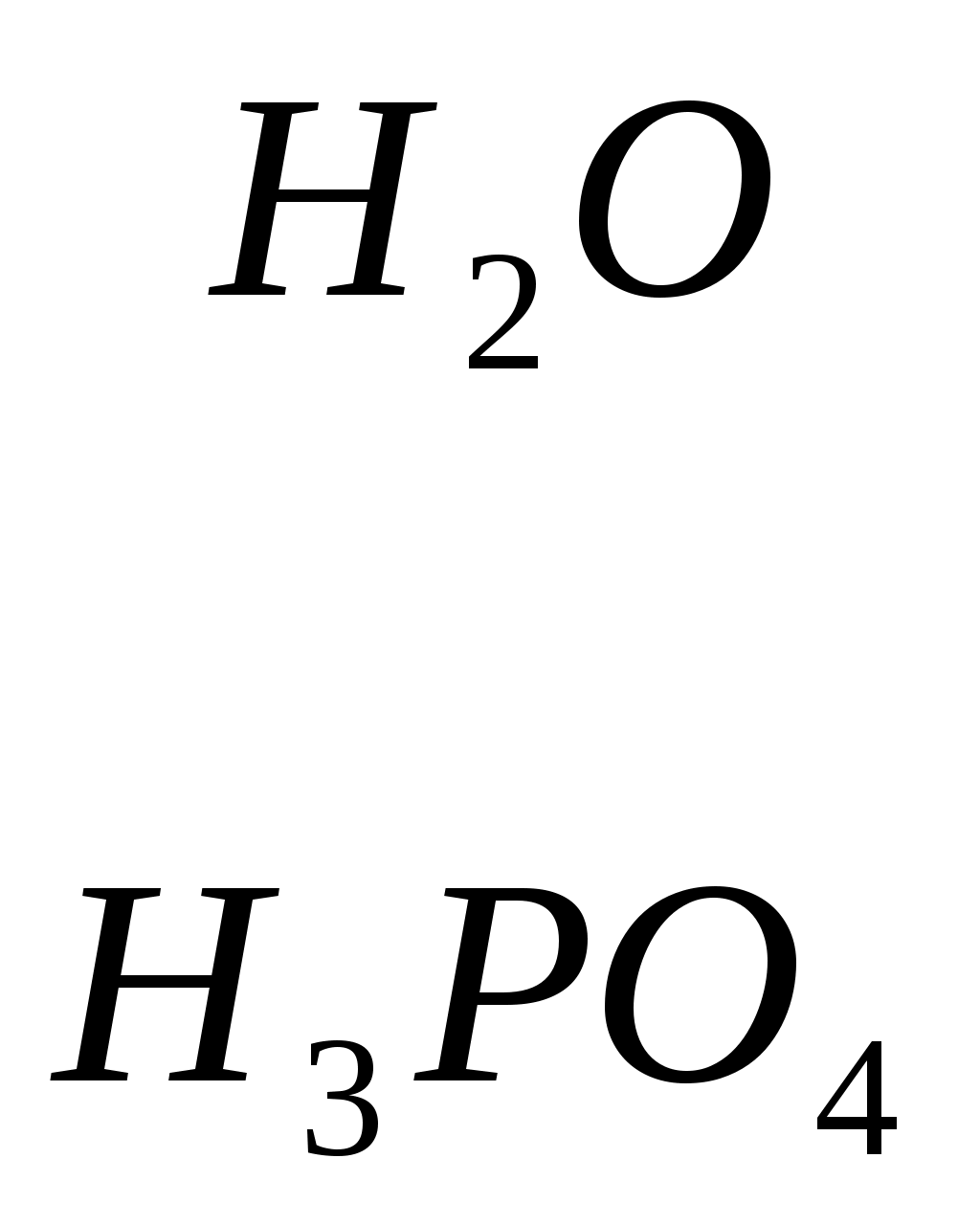
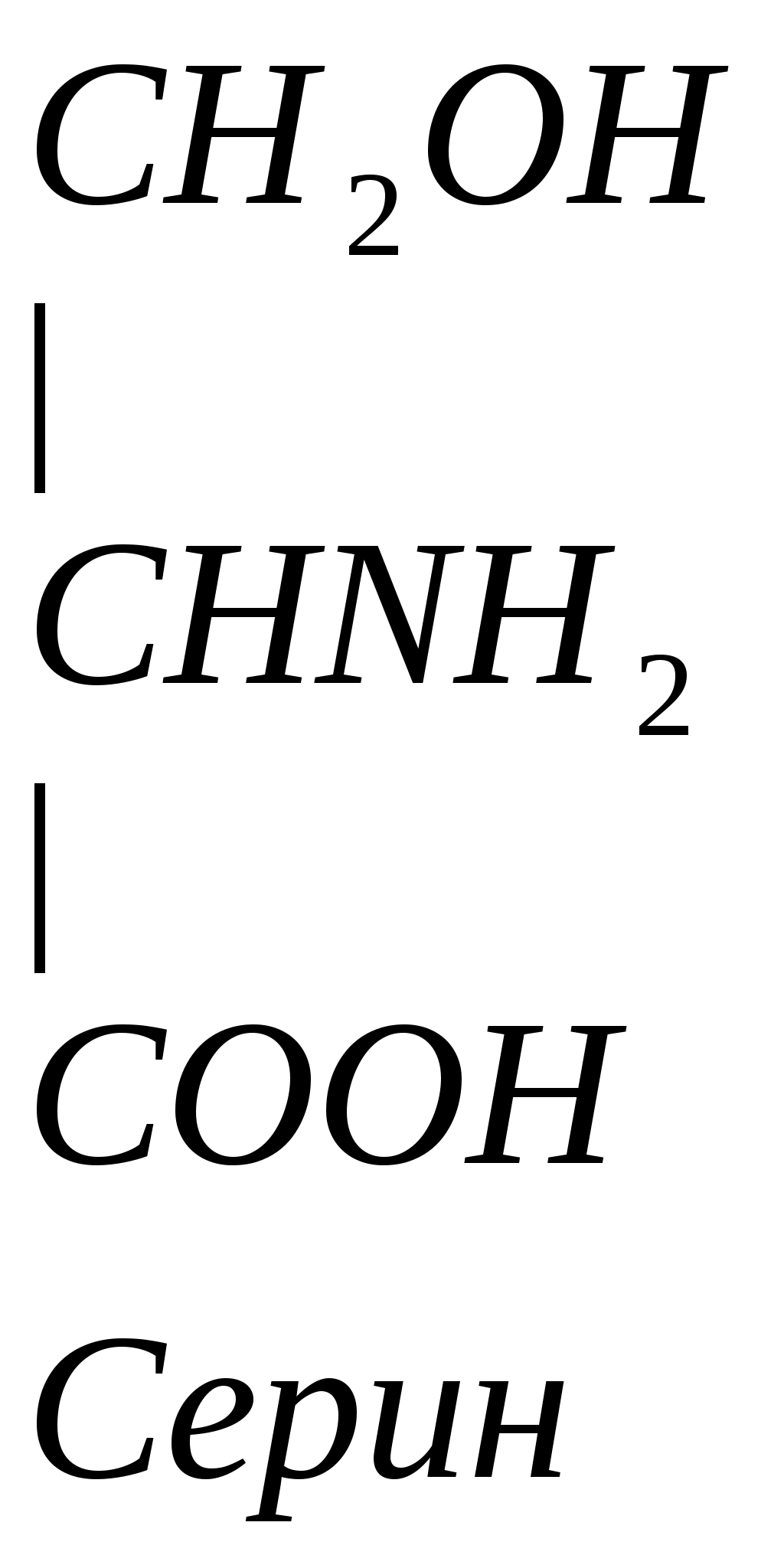
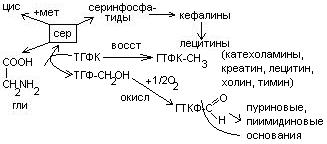
Серин – содержит ОН–группу, заменимая, глюкогенная. Является источником одноуглеродных фрагментов, которые идут на синтез БАВ (гормоны, медиаторы).
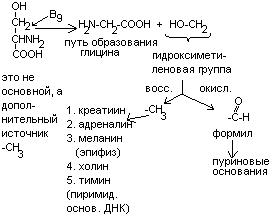
Серин является донатором одноуглеродных радикалов: метила, гидроксиметилена, формила.
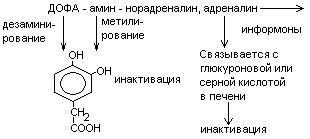
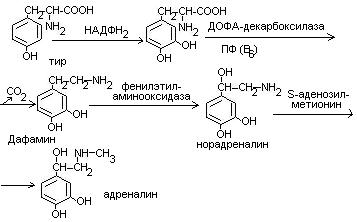
Нарушения обмена ДОФА-амина
Паркинсонизм – мышечная дрожь, ригидность мышц (дегенерация ДОФА-амин синтезирующих нейронов). Можно моделировать паркинсонизм с помощью амфитамина
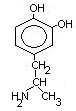
Лечат с помощью ДОФА (предшественник), легко проникает через мембраны.
Шизофрения – избыток накопления ДОФА-амина.
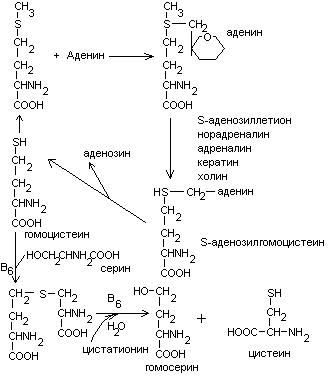
Обмен цистеина и метионина.
В молекулах белка обнаружены 3 серосодержащие аминокислоты: метионин, цистеин, цистин.
Цистеин в организме синтезируется из метионина.
Функции цистеина:
Цистеин участвует в образовании цистина:
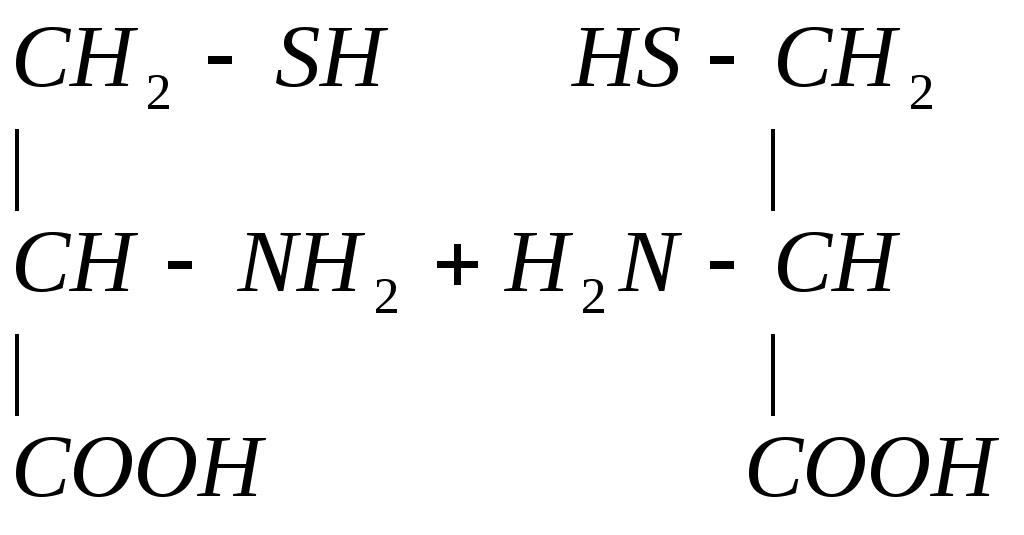
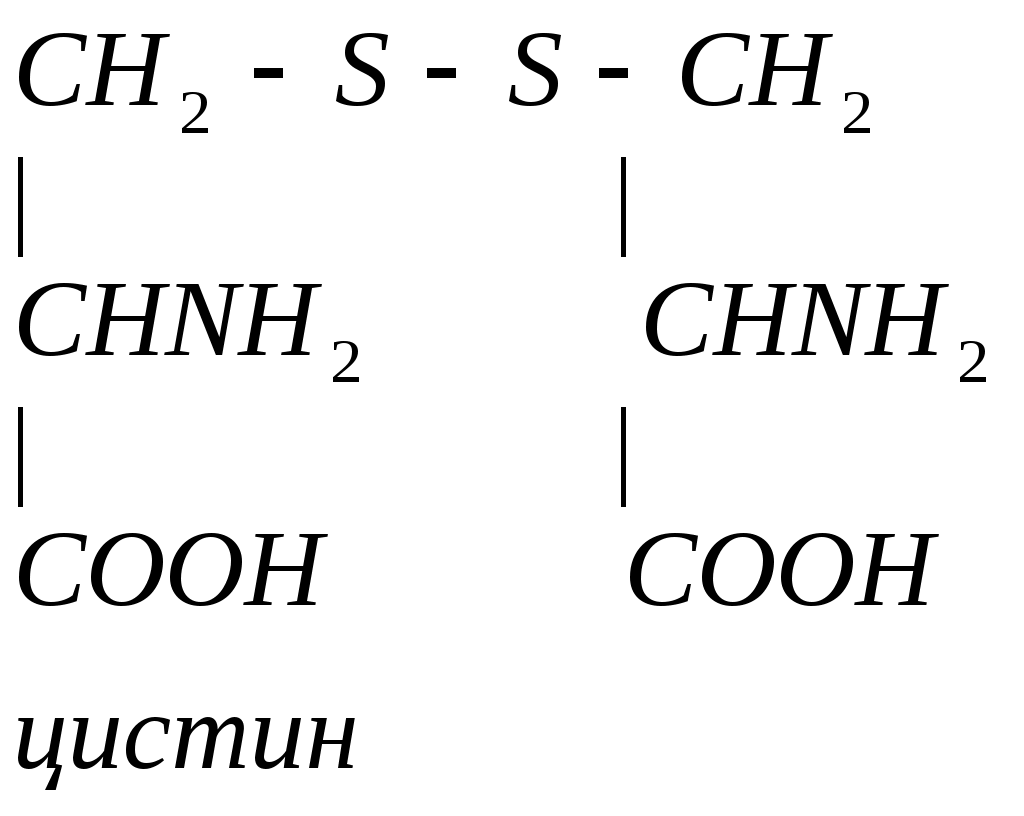
При образовании цистина возникает дисульфидная связь S-S между двумя полипептидными цепями, что способствует стабилизации третичной структуры белка.
Цистеин входит в состав трипептида глутатиона–Г–SH. Глутатион обеспечивает сохранение ферментов в активной форме. Глутатион участвует в ингибировании белков. Например, инсулина.
Цистеин превращается в таурин:
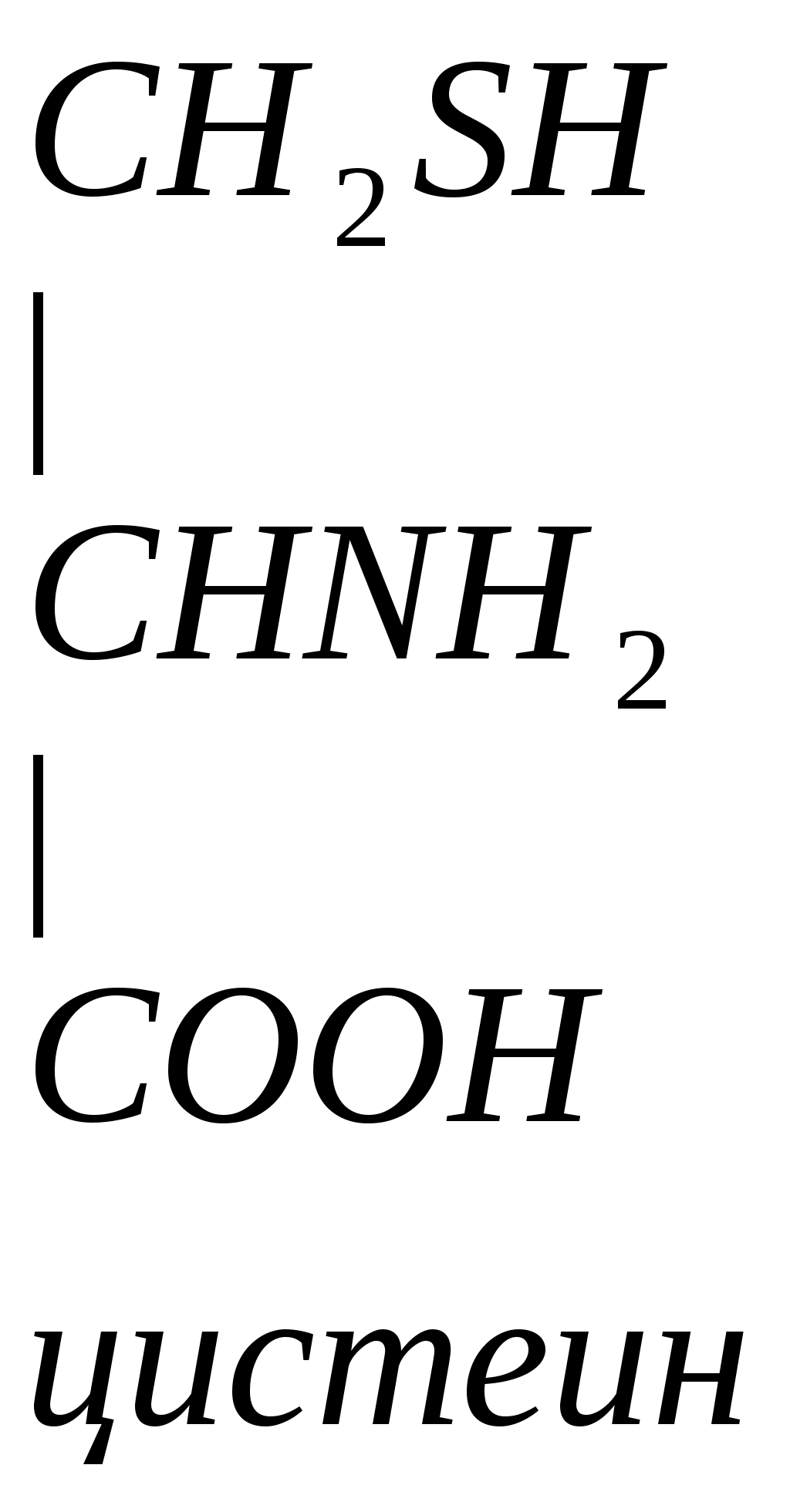

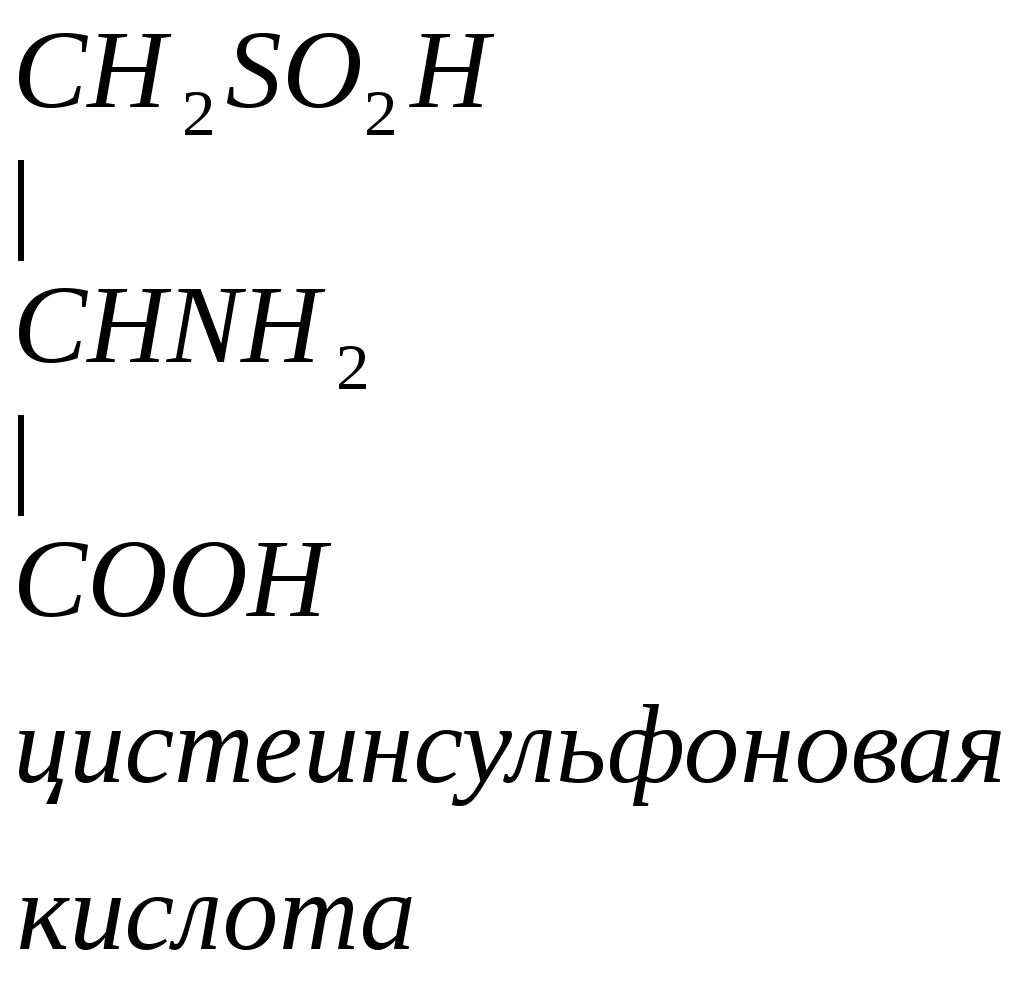
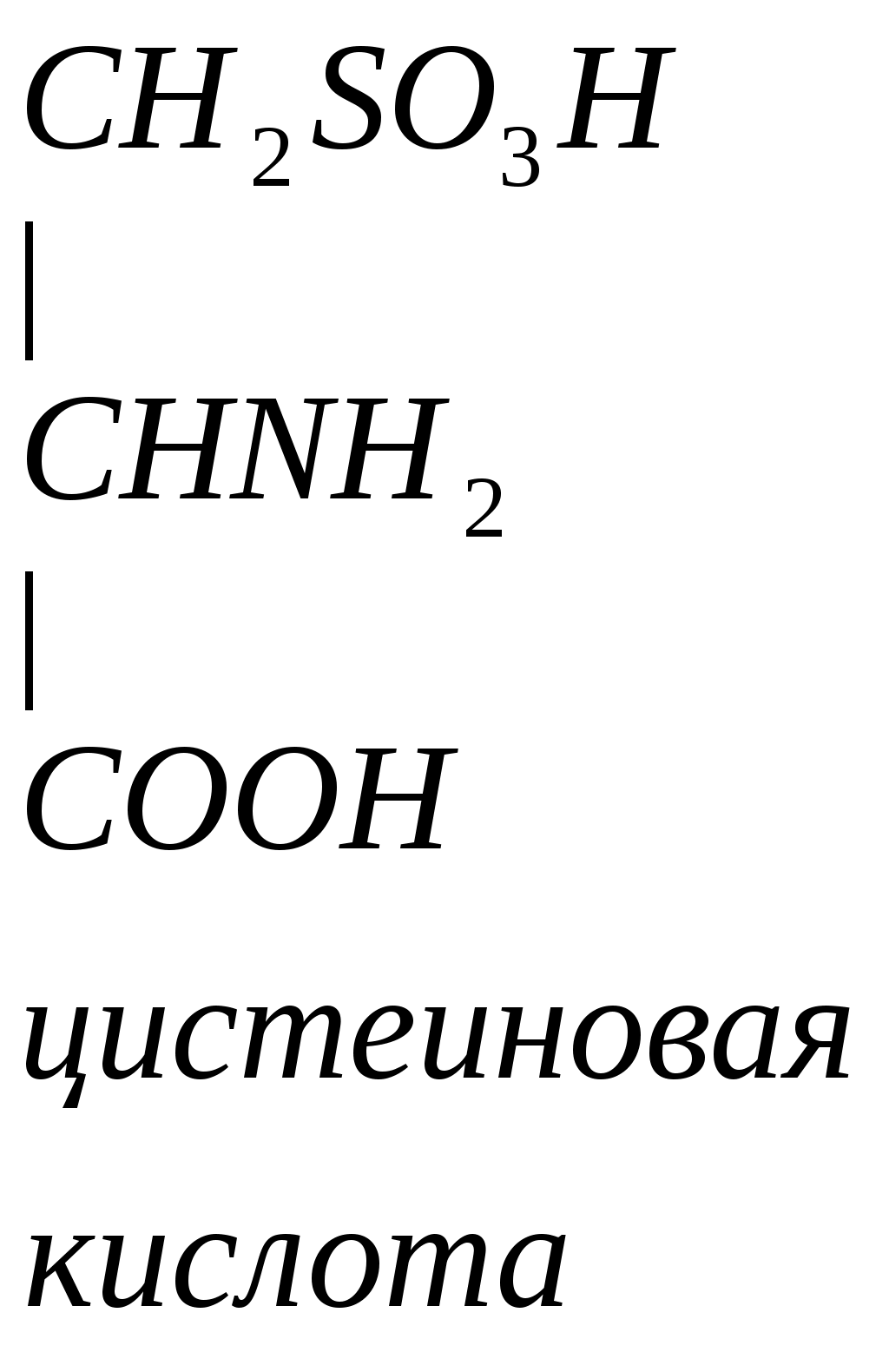
 СО2 СО2
СО2 СО2 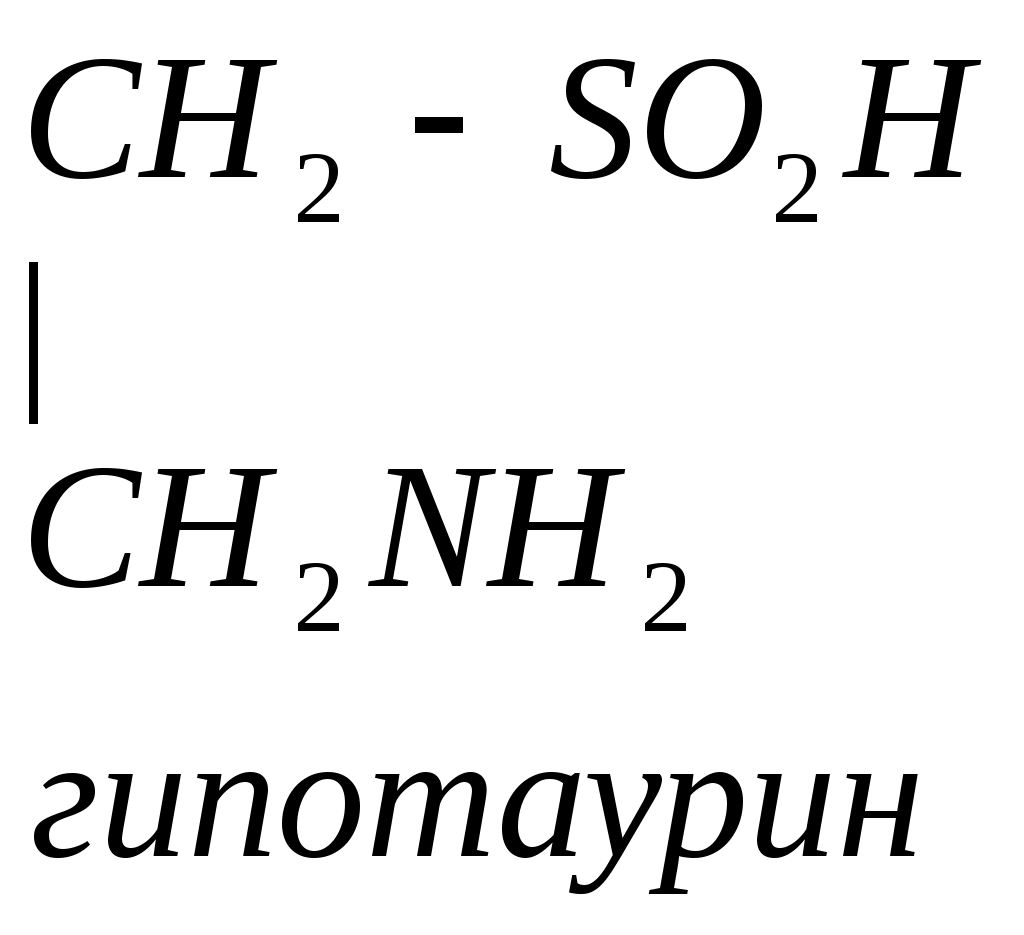
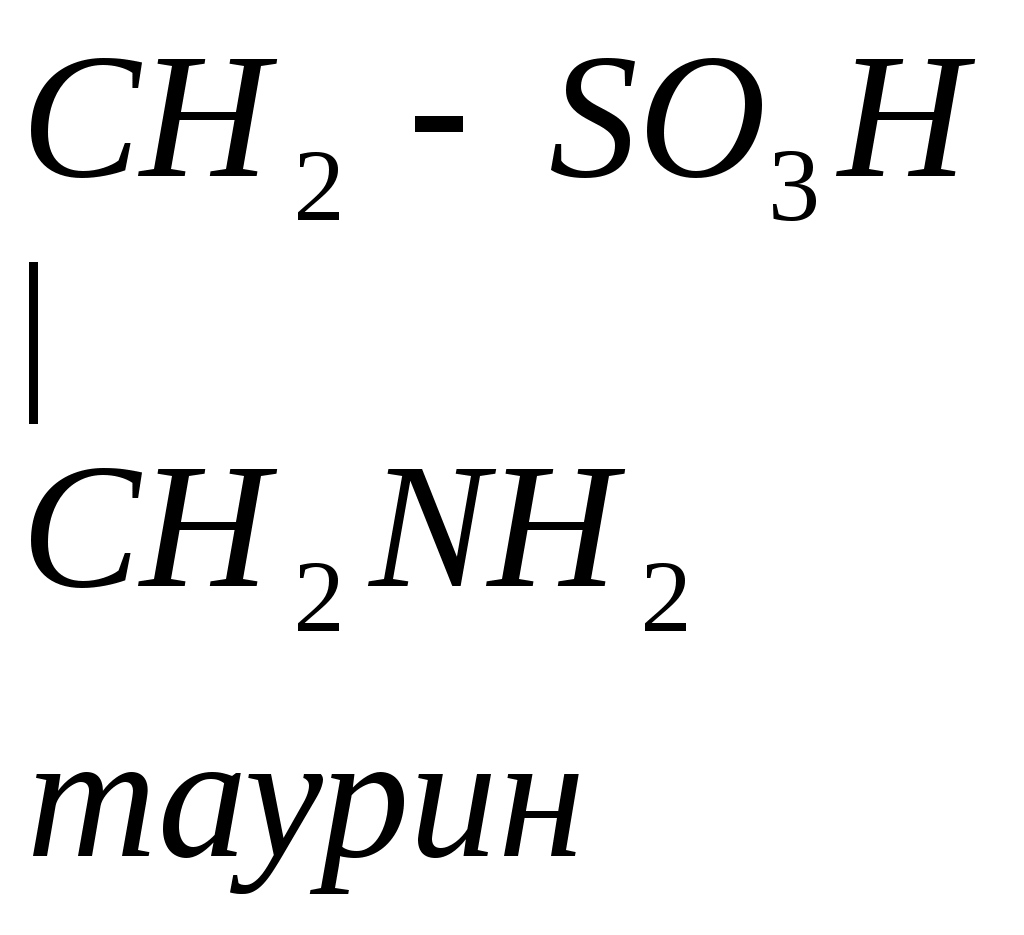
Таурин используется для синтеза парных желчных кислот.
Цистеин входит в состав активных центров ферментов.
Метионин – незаменимая аминокислота.
Функции метионина:
Метионин является источником одноуглеродного радикала – метила, который используется в реакциях трансметилирования. Непосредственным источником метильных групп является производное метионина – S-аденозилметионин.
Метионин участвует в синтезе креатина. Синтез креатина происходит в печени и почках. В почках образуется гуанидинацетат из аргинина и глицина:
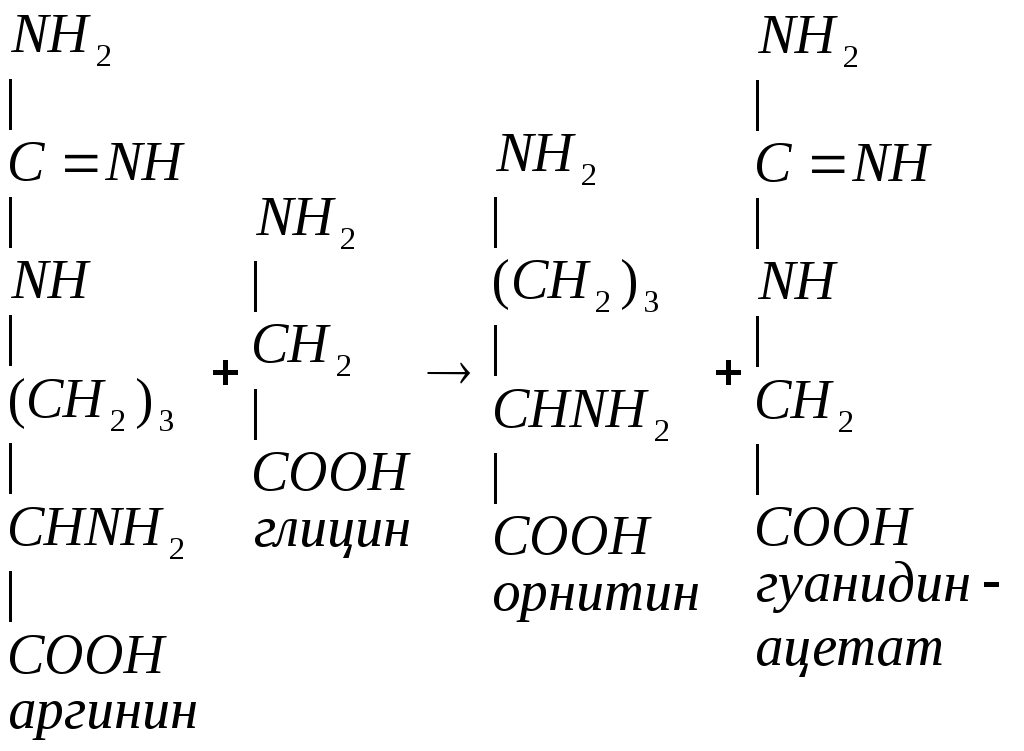
В печени гуанидинацетат взаимодействует с S-аденозилметионином и образуется креатин:
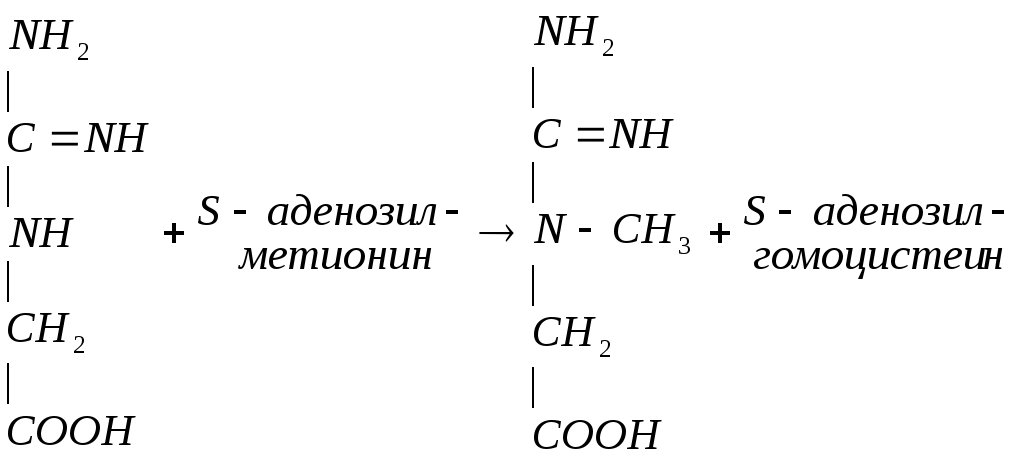
Метионин участвует в реакциях трансметилирования в синтезе: адреналина, мелатонина, азотистых оснований.
В результате реакции трансметилирования образуется гомоцистеин.
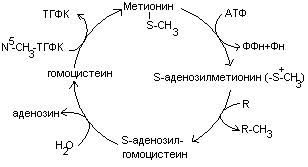
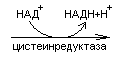
4. Гомоцистеин превращается в цистеин:
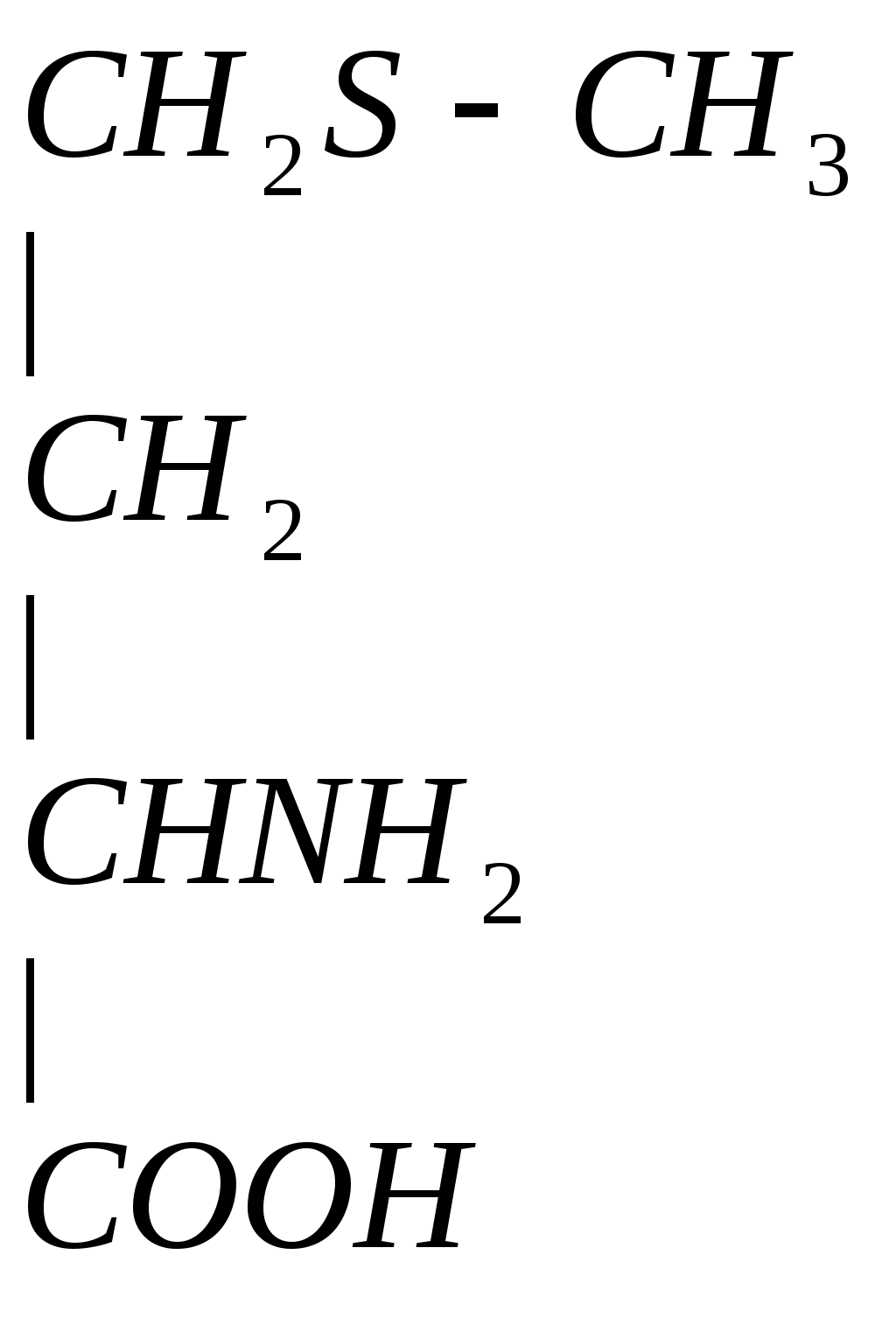

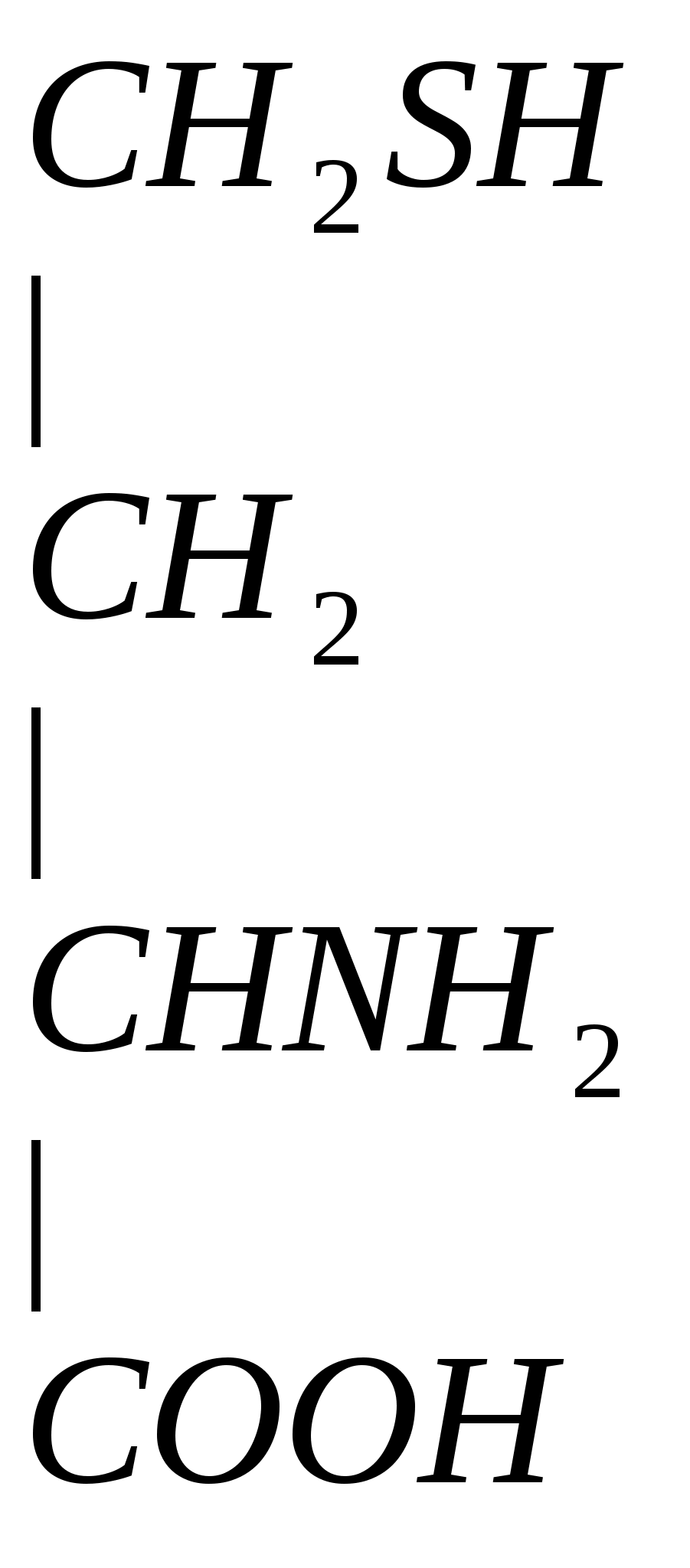 +
+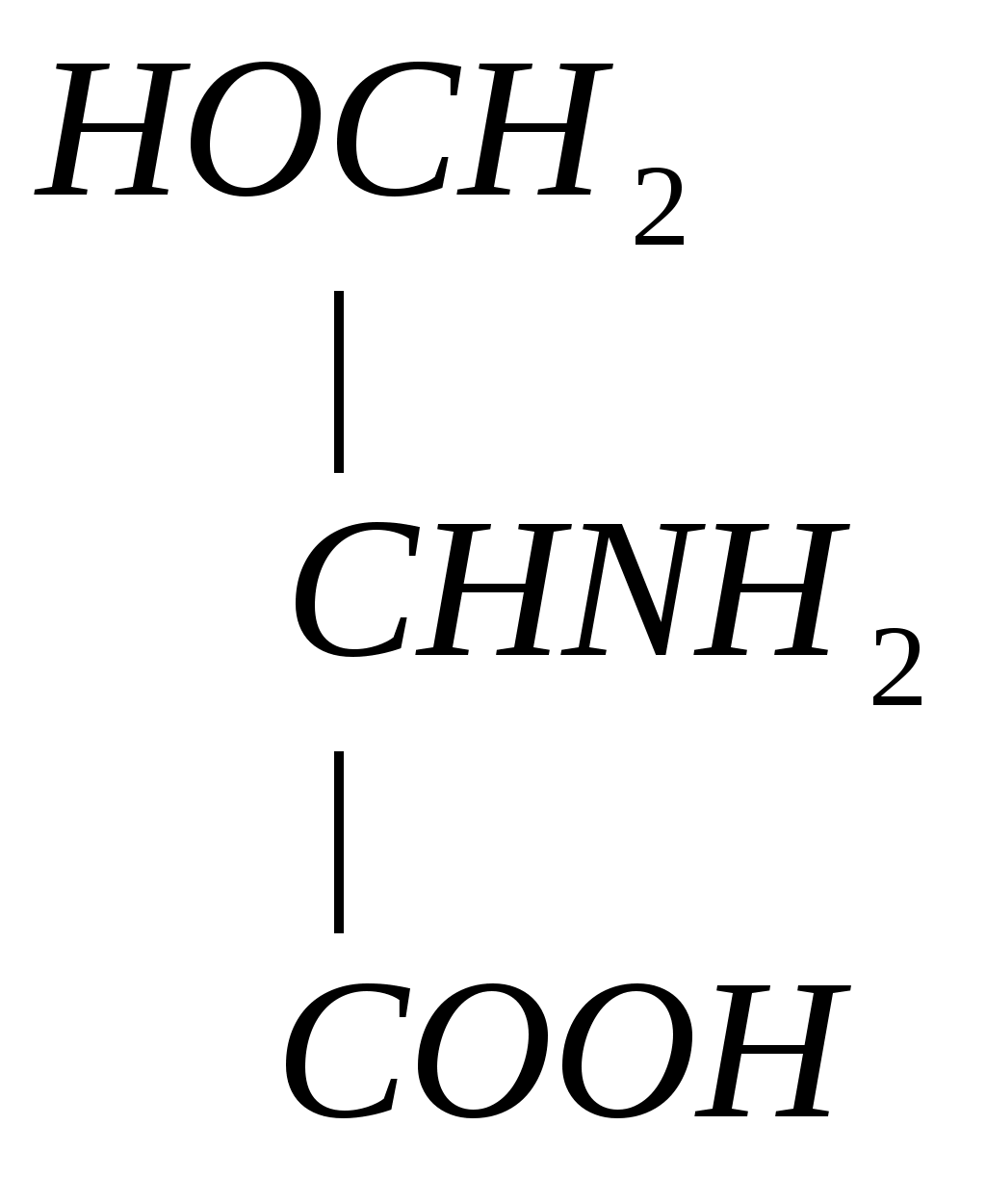
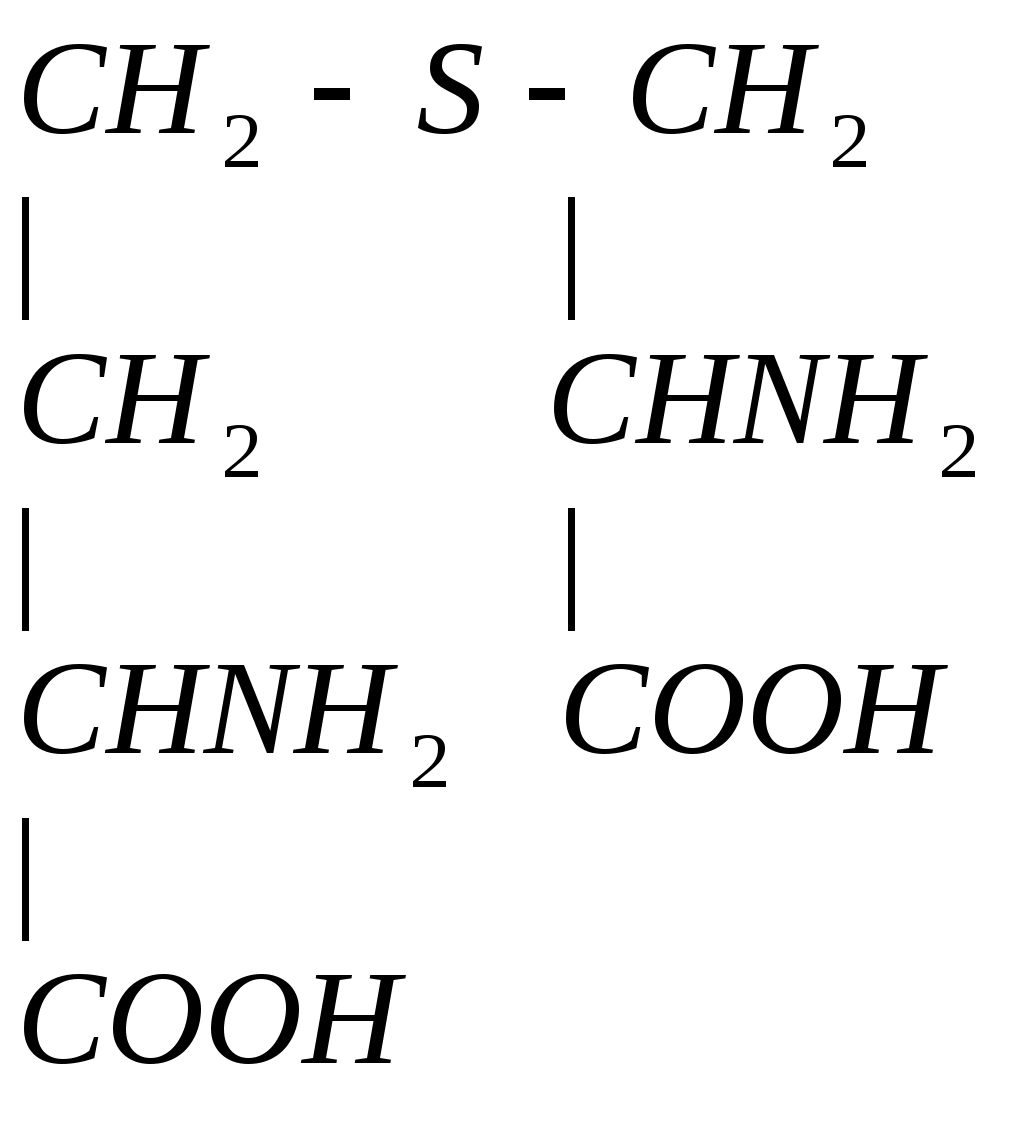
мет гомоцистеин серин цистатионин
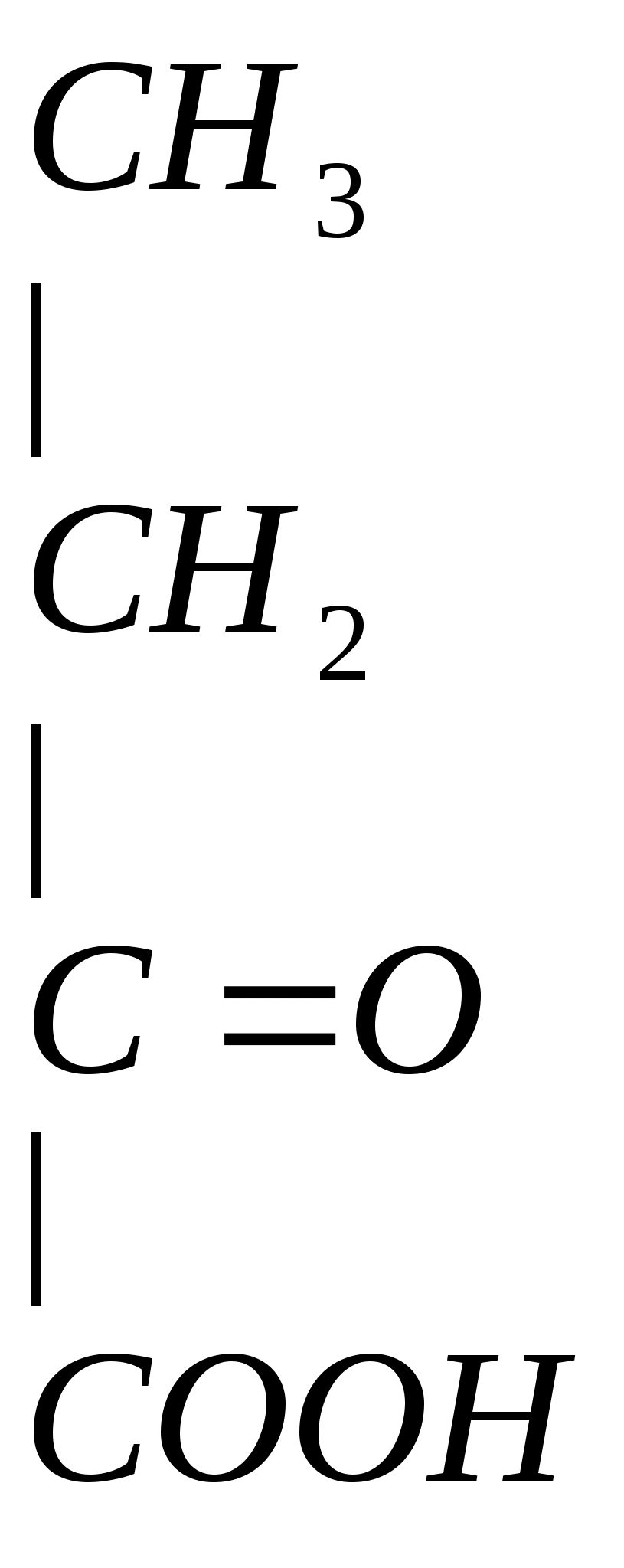 + NH3 +
+ NH3 + 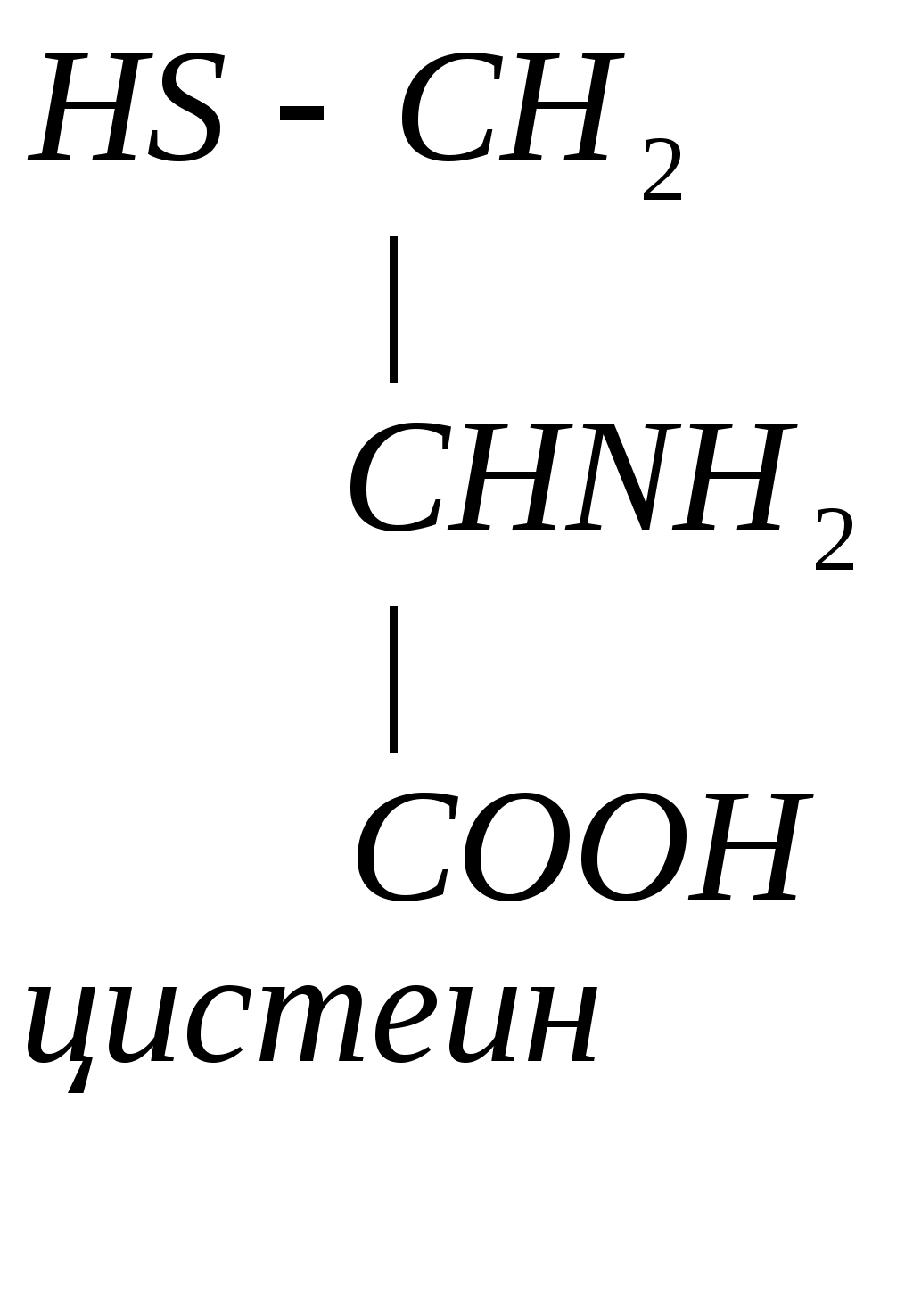
В качестве кофермента цистатионин-
Гомоцистеин может превращаться в метионин путем метилирования.
Гомоцистеин может превращаться в гомоцистин. Накопление гомоцистина в тканях и крови – характерный симптом наследственной недостаточности ферментов, а также признак недостаточности витаминов В6 и В12. Гомоцистин накапливается, если нарушается превращение гомоцистеина в метионин и цистеин.
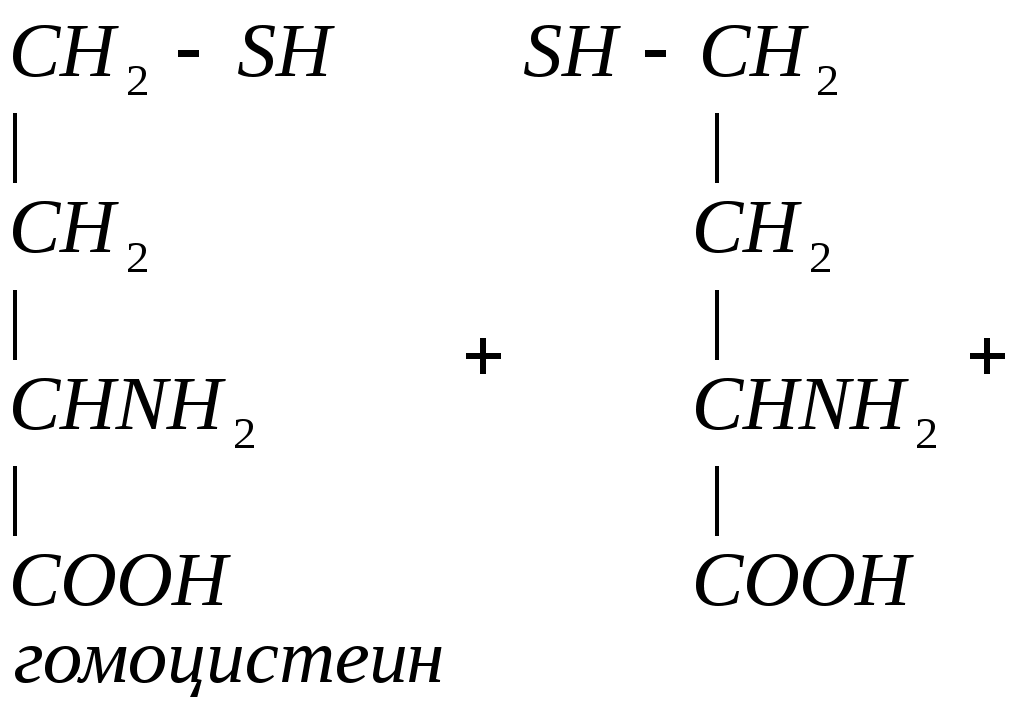
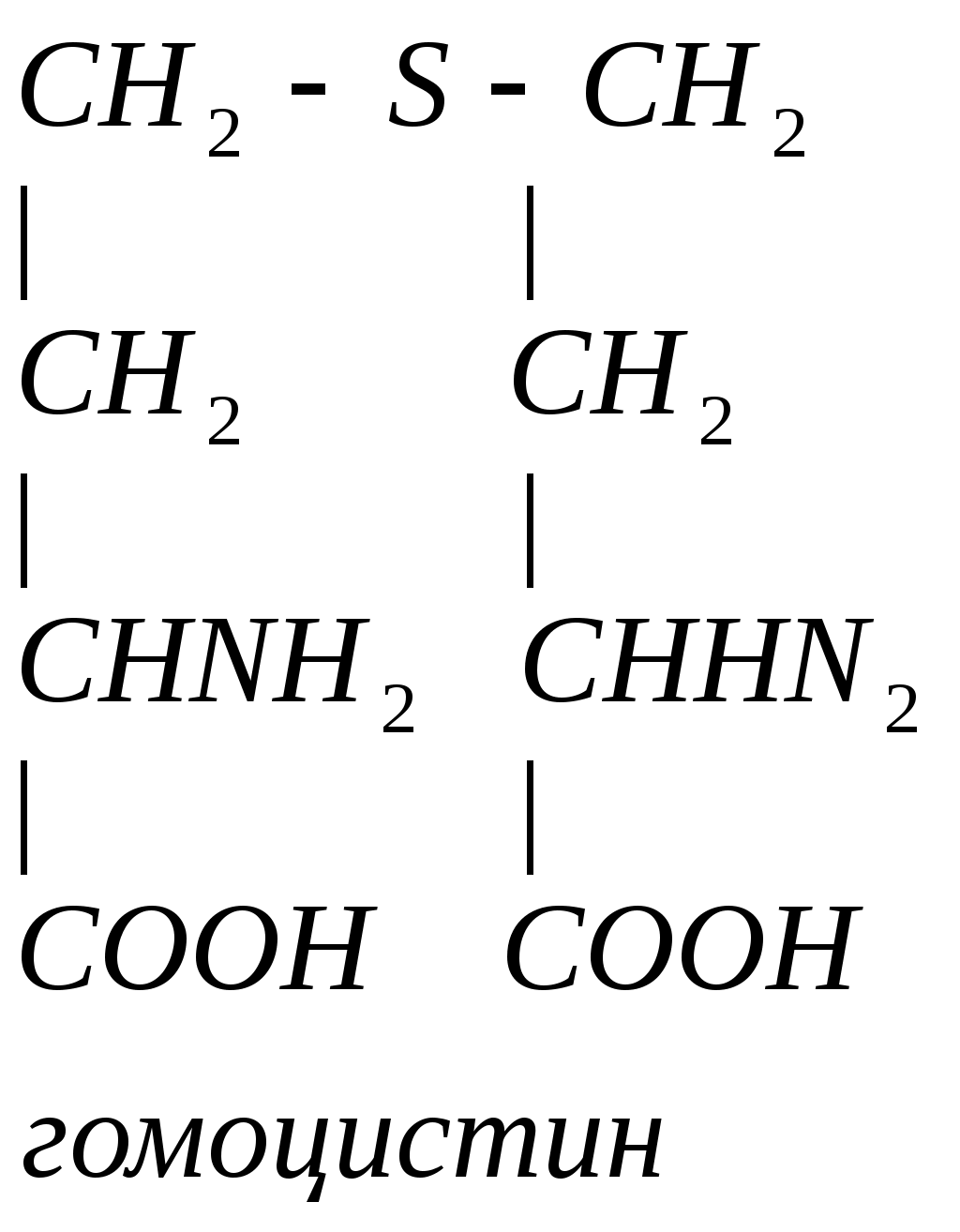
Гомоцистинурия – высокая концентрация гомоцистина и метионина. Нарушение умственного развития и скелета.
Цистинурия- выделение цистина с мочой: цистиновые камни в мочевых путях.
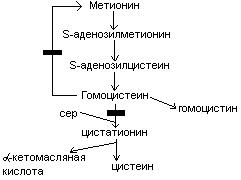
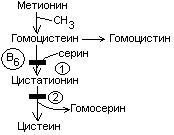
выделяют 2 причины образования блоков:
Наследственная недостаточность ферментов, участвующих в обмене.
Недостаточность (гиповитаминоз) В6, В12, фолиевой кислоты.
При блоке 1 развивается гомоцистинурия.
Биохимически накапливается мет и гомоцистин, т.к. гомоцистеин не превращается в цистатионин. Гомоцистин выделяется с мочой.
Клинически: нарушения со стороны соединительной ткани, сердечнососудистой системы, свертывающей системы, образование тромбов. Уродства черепа – башневидный череп, вывернутые глазные яблоки (подвывих хрусталика), умственная отсталость.
При блоке 2 развивается цистатионинурия.
Биохимически повышается концентрация цистатионина, уменьшается цистеина.
Цистинурия – в моче выделяется в 50 раз больше нормы цистина, лизина, аргинина, орнитина.
Причиной заболевания является нарушение реабсорбции цистина и нарушением всасывания остальных аминокислот.
Для людей с этой патологией характерно образование камней.
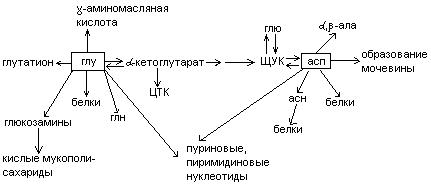
Обмен дикарбоновых аминокислот.
Глутаминовая кислота – моноаминодикарбоновая, заменимая, глюкогенная.
Необходима для трансдезаминирования аминокислот:
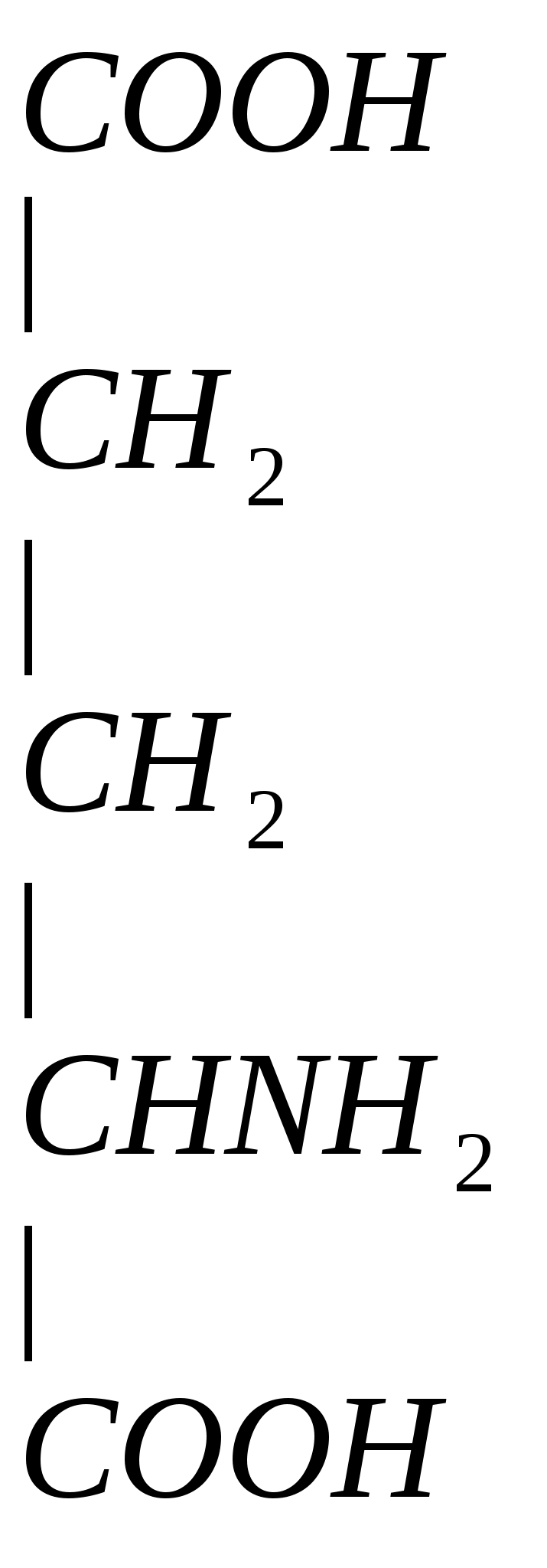
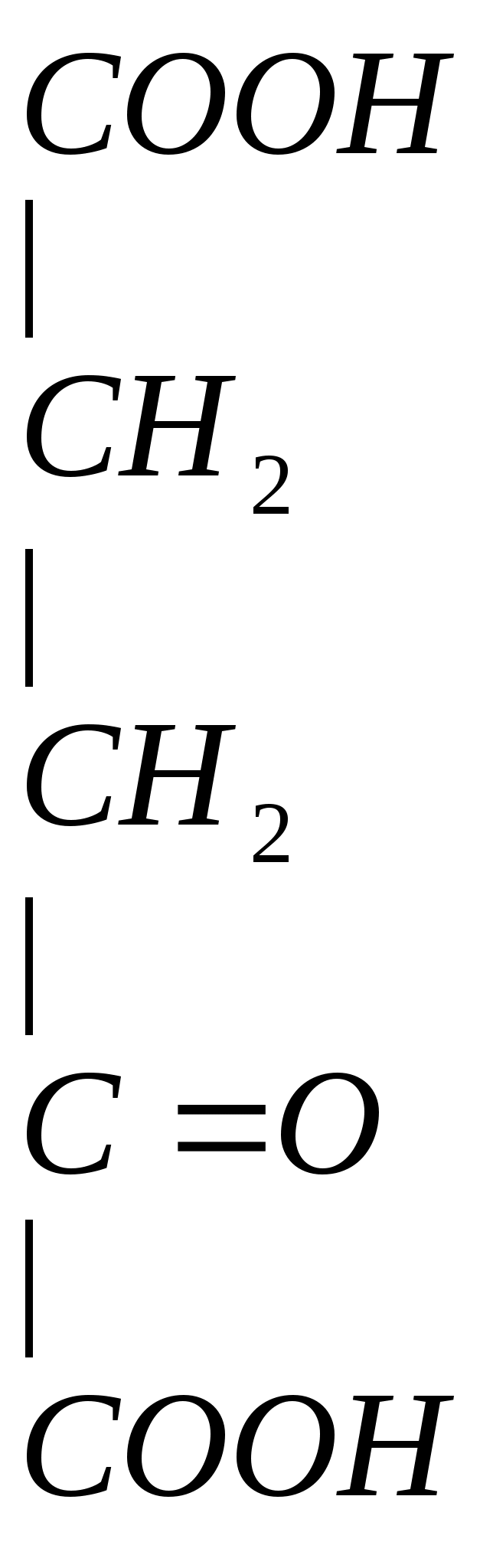
Связывает NH3 в нервных клетках, прямо на месте, по мере образования:
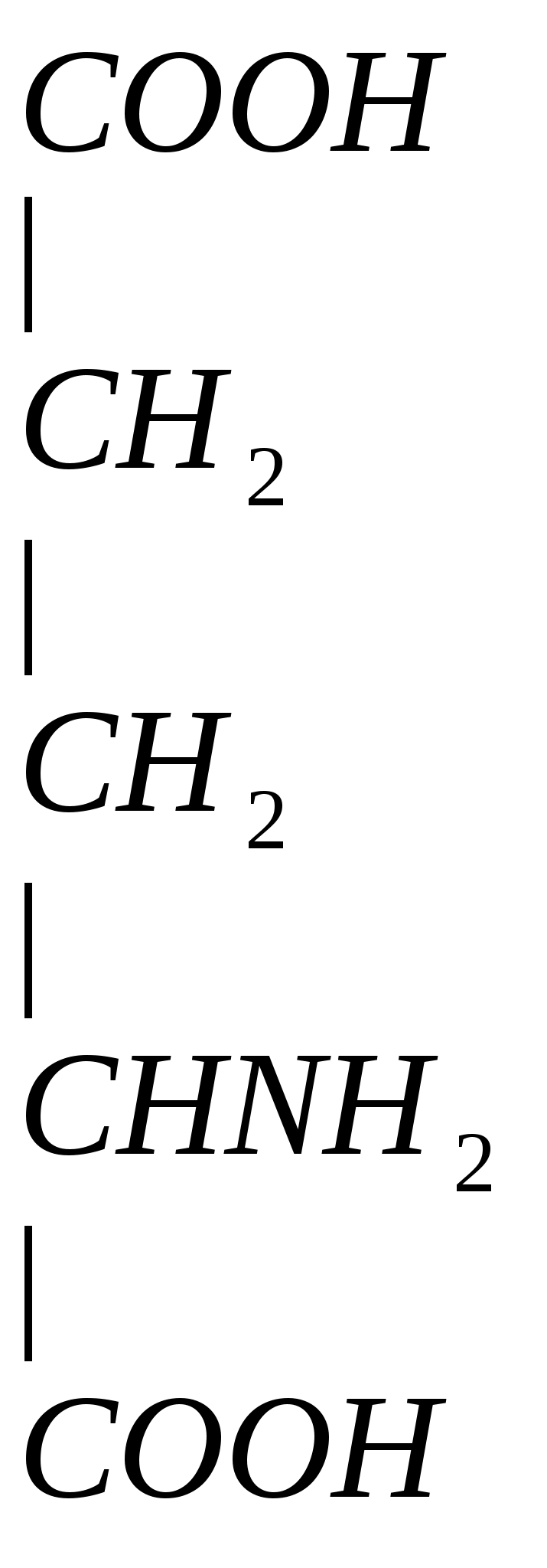 + NH3 + АТФ
+ NH3 + АТФ 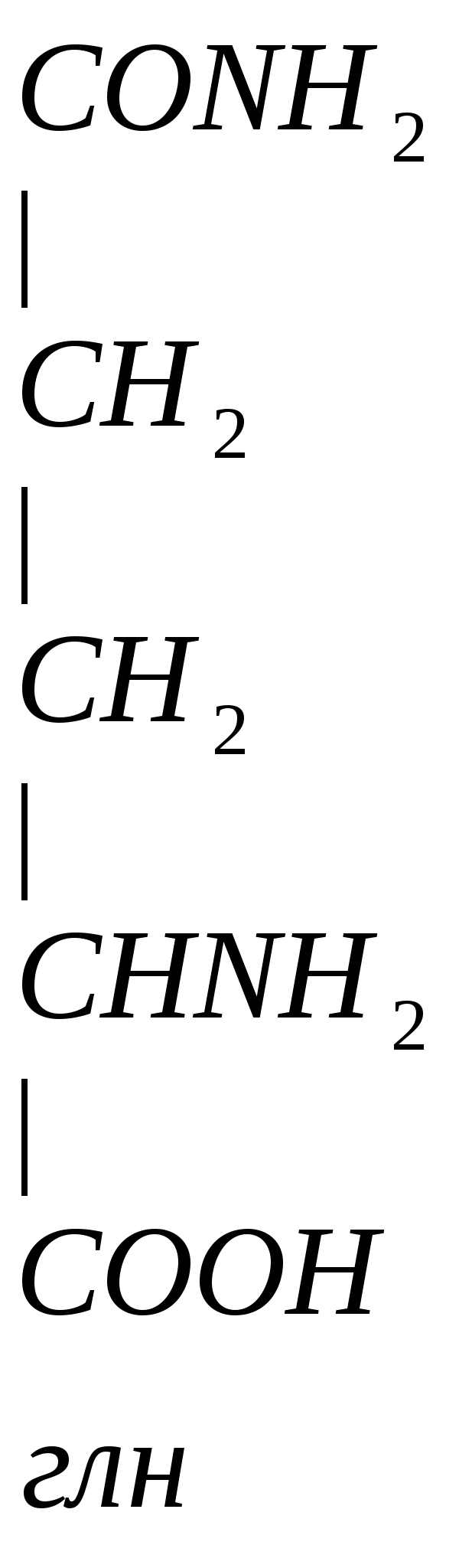
Глн входин в полипептидную цепь белка, это продукт обезвреживания NH3.
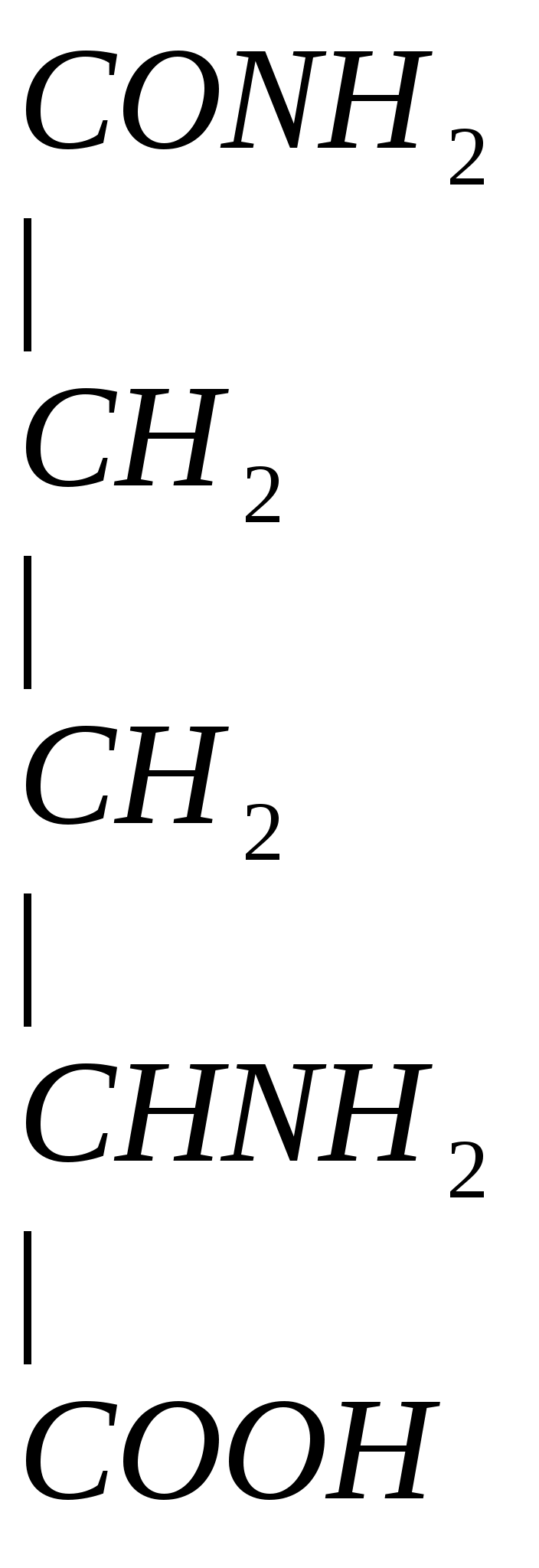
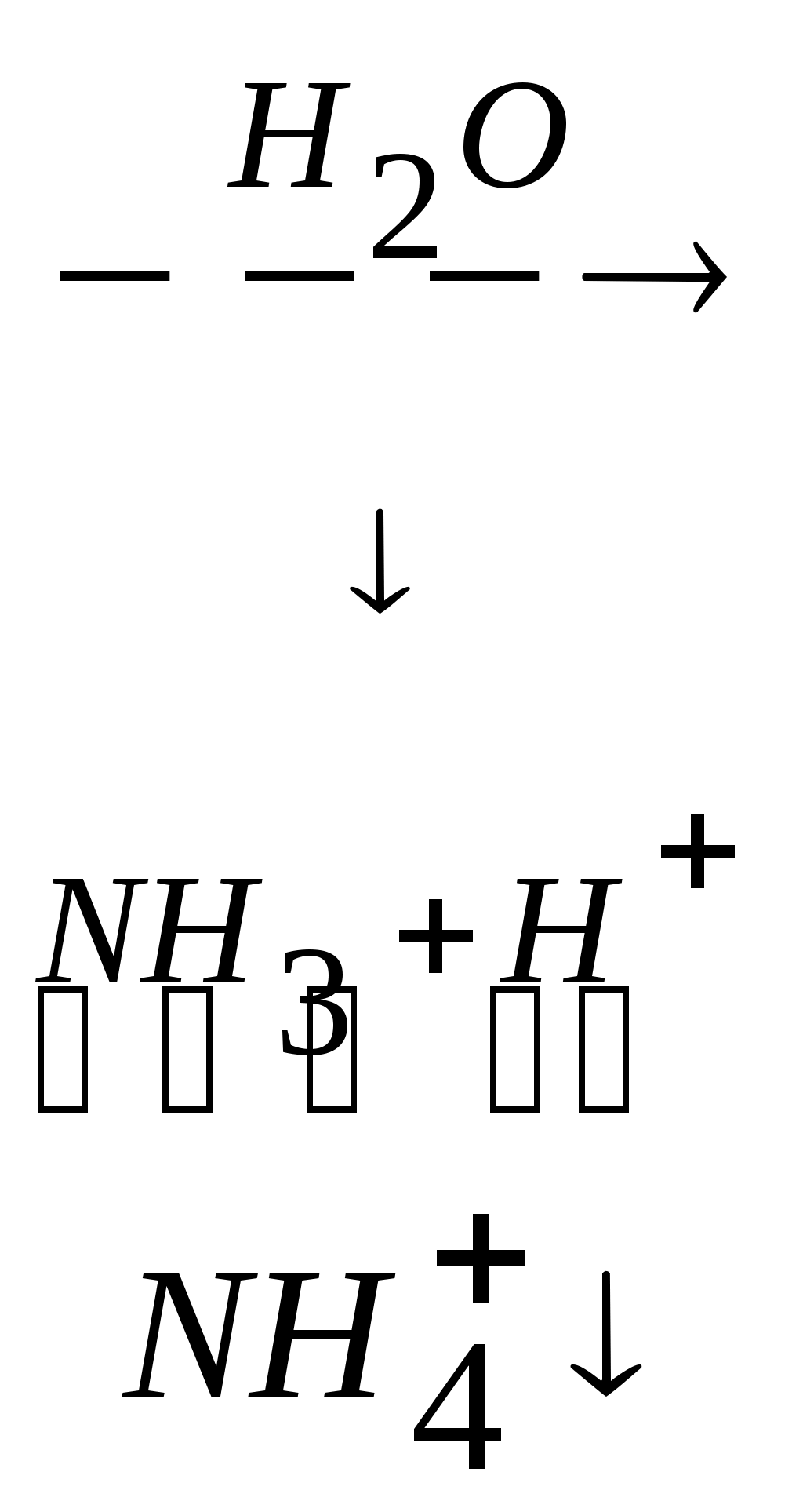
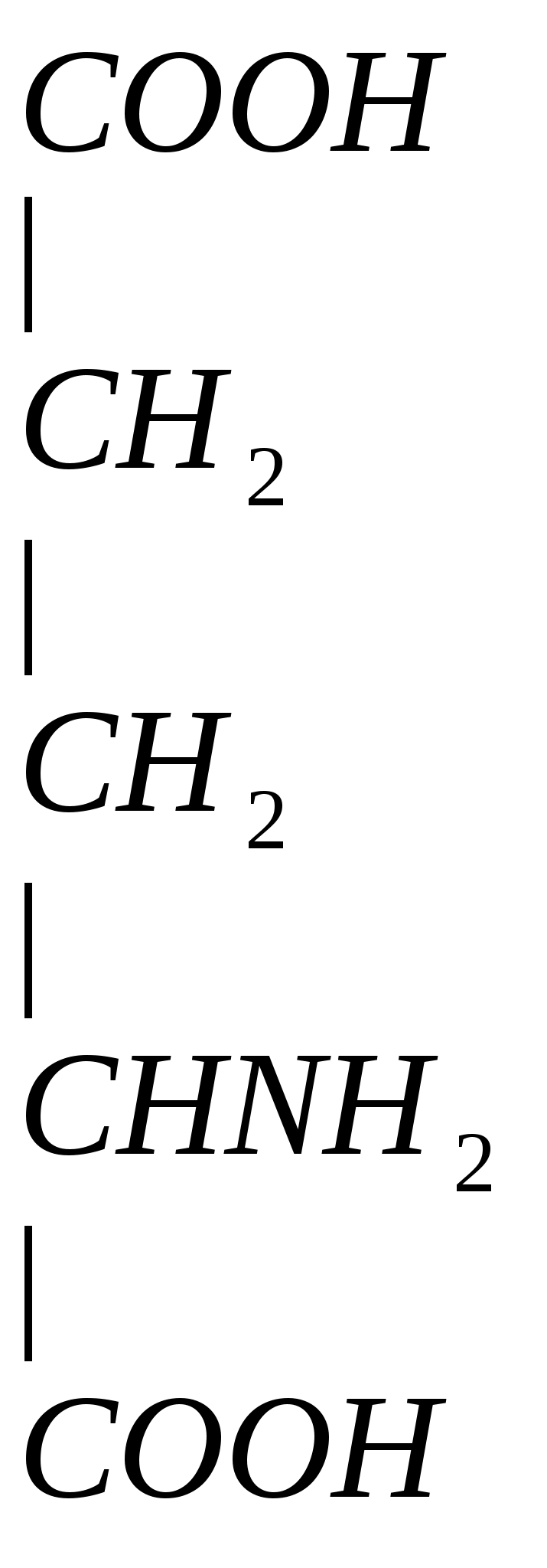
Это процесс сохранения кислотно-щелочного равновесия.
Основной щелочной эквивалент Na+, его нельзя терять с мочой. Na+ реабсорбируется, процесс регулируется гормонально. Вместо Na+ выводится
Глутамин является возбудительным медиатором, в процессе метаболизма превращается в тормозной медиатор.
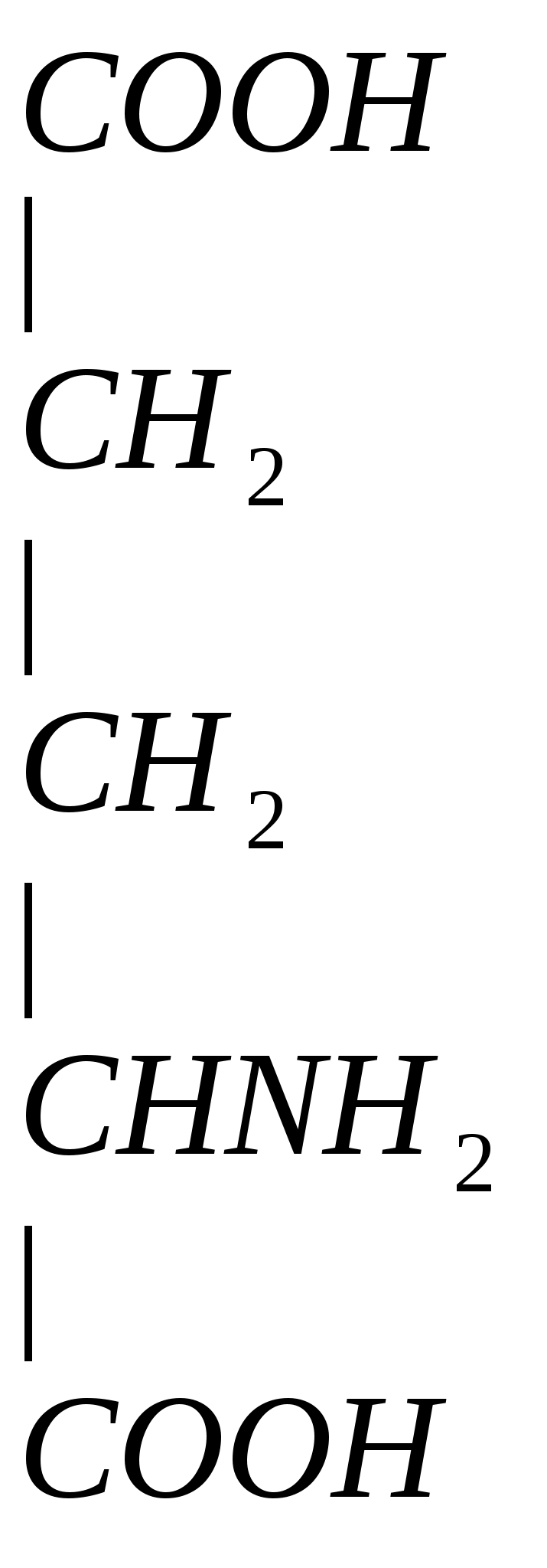
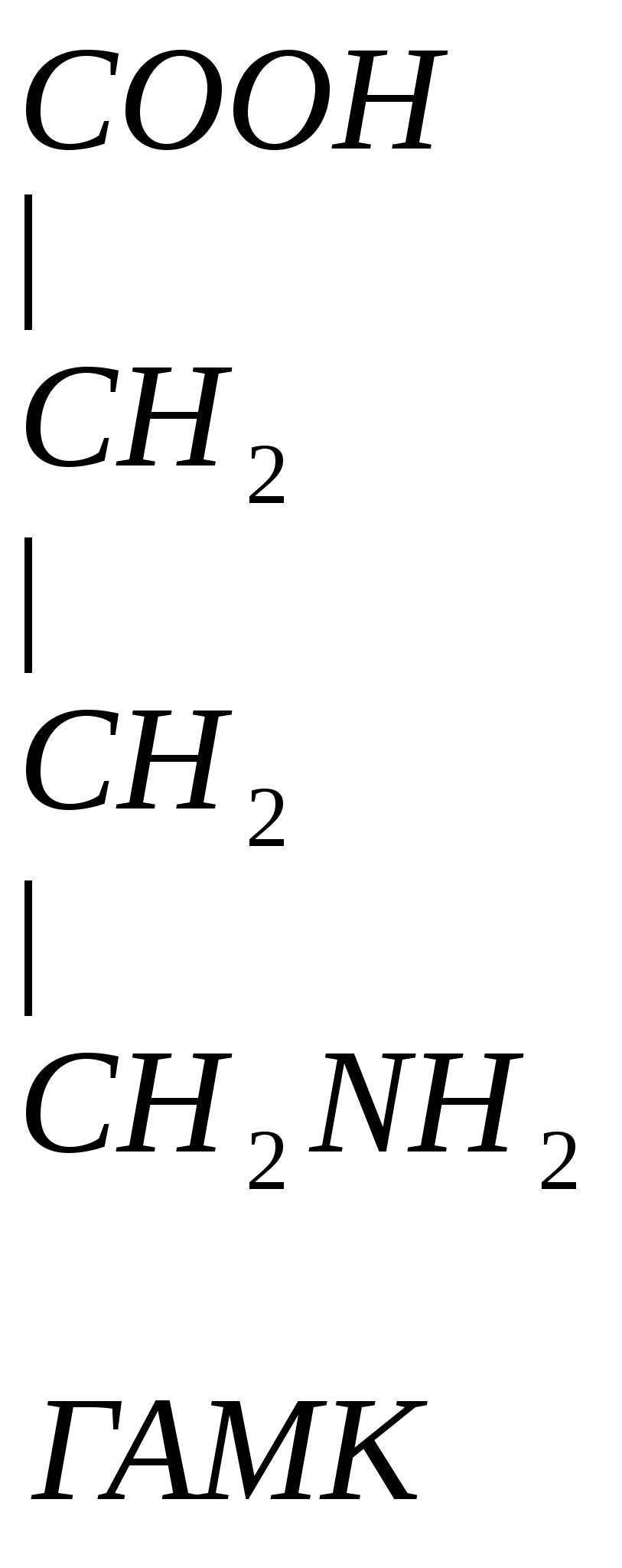
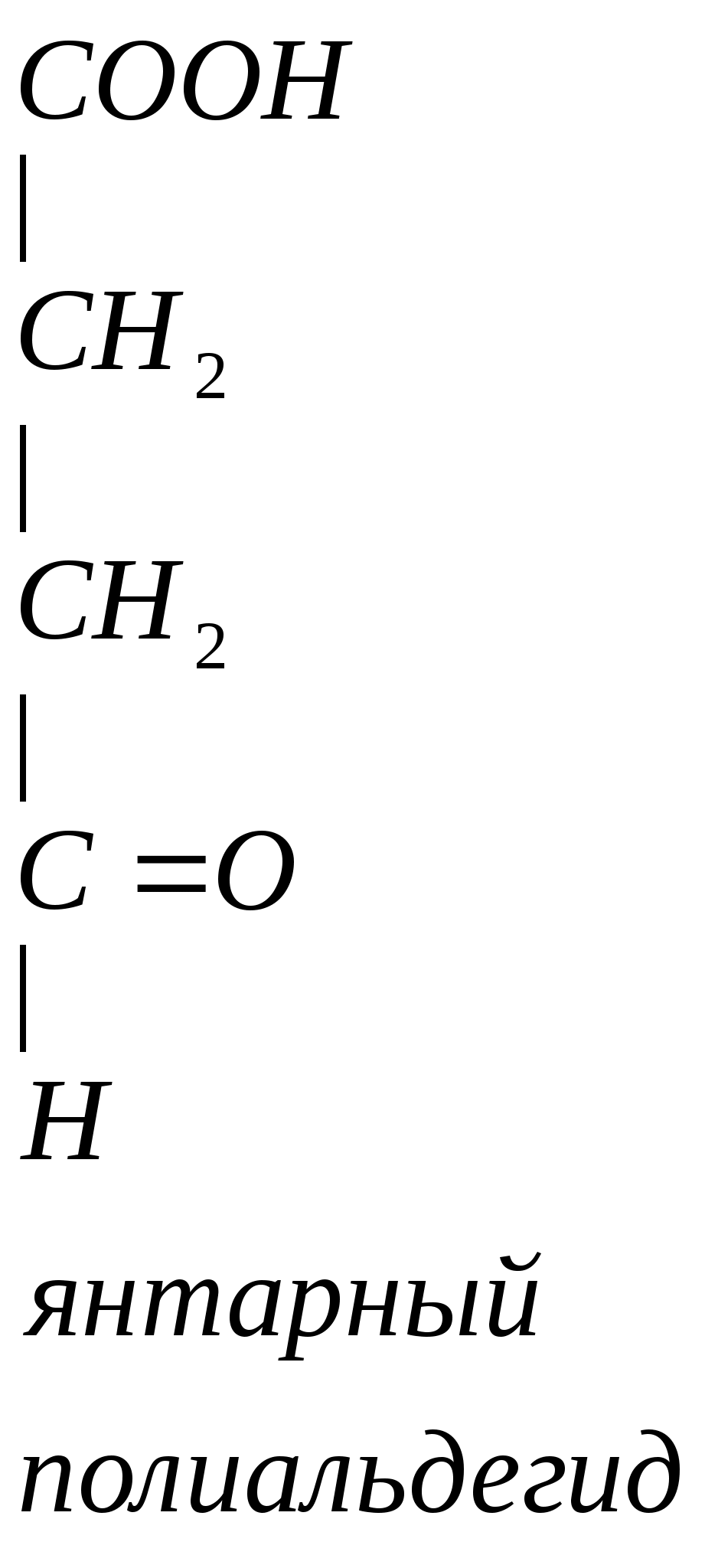
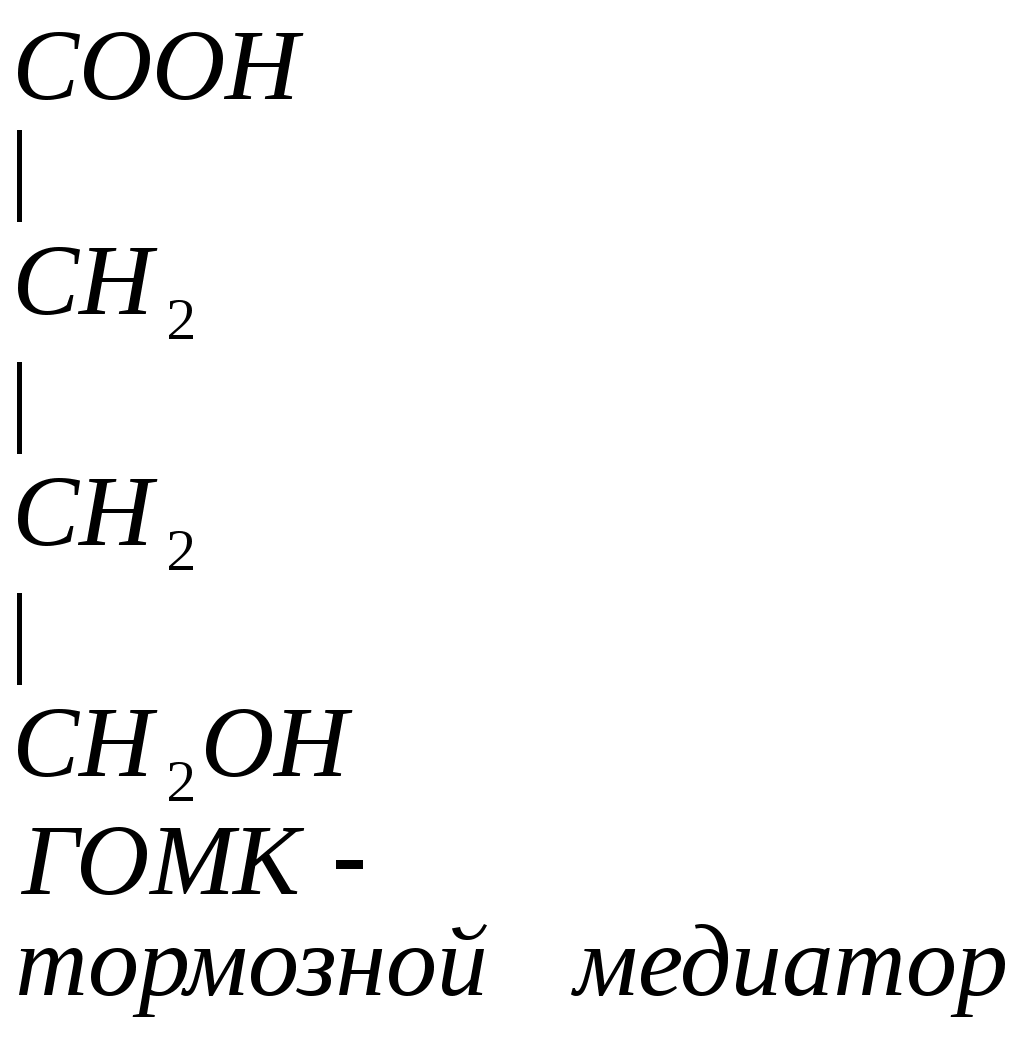
Здесь существует 2 цикла глю – лак и глю – ала.
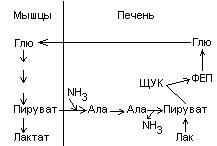
Пируват аминируется или трансаминируется и образуется ала. Благодаря этому:
меньше образуется лактата
связывается определенное количество NH3 (его много в рабодающей мыщце за счет дезаминирования).
В виде аланина NH3 идет в печень, где обезвреживается путем синтеза мочевины.
Аргинин – диаминомонокарбоновая кислота, заменимая, гликогенная.
О
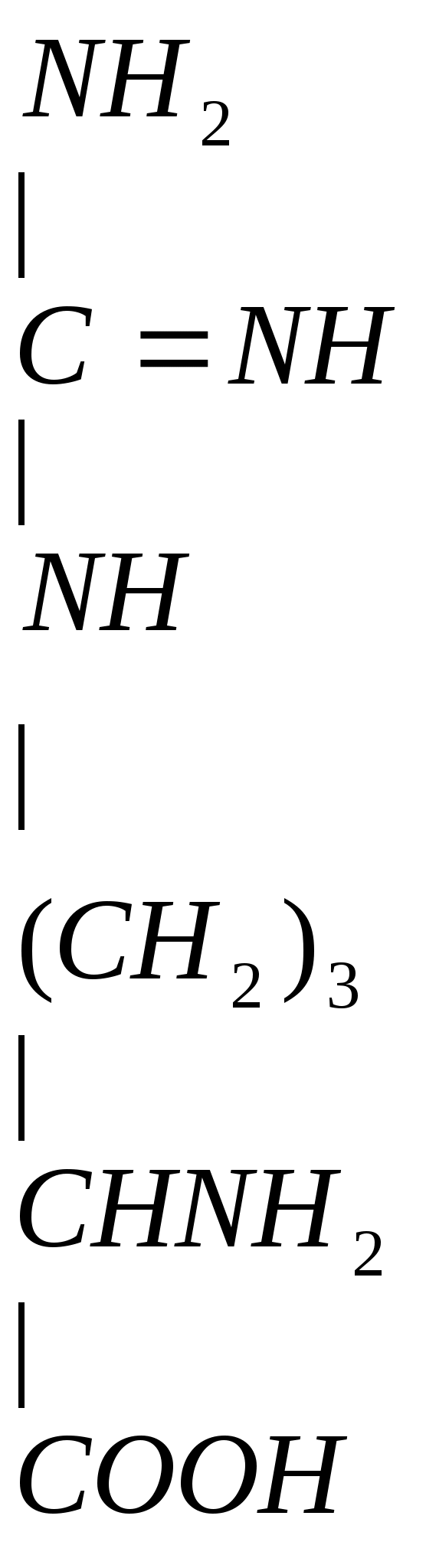 тдача гуанидиновой группы в виде NH2-CО-NH2 (мочевины)
тдача гуанидиновой группы в виде NH2-CО-NH2 (мочевины)Отдача на гли гуанидиновой группы и образование креатина. При этом образуется орнитин NH2-(CH2)3-CH(NH2)-COOH. Его мало в пищевых продуктах, он не входит в белки, но он необходим для синтеза мочевины.
Основа для синтеза орнитина – аргинин.
Аспарагиновая кислота – моноаминодикарбоновая кислота, заменимая, гликогенная.
У
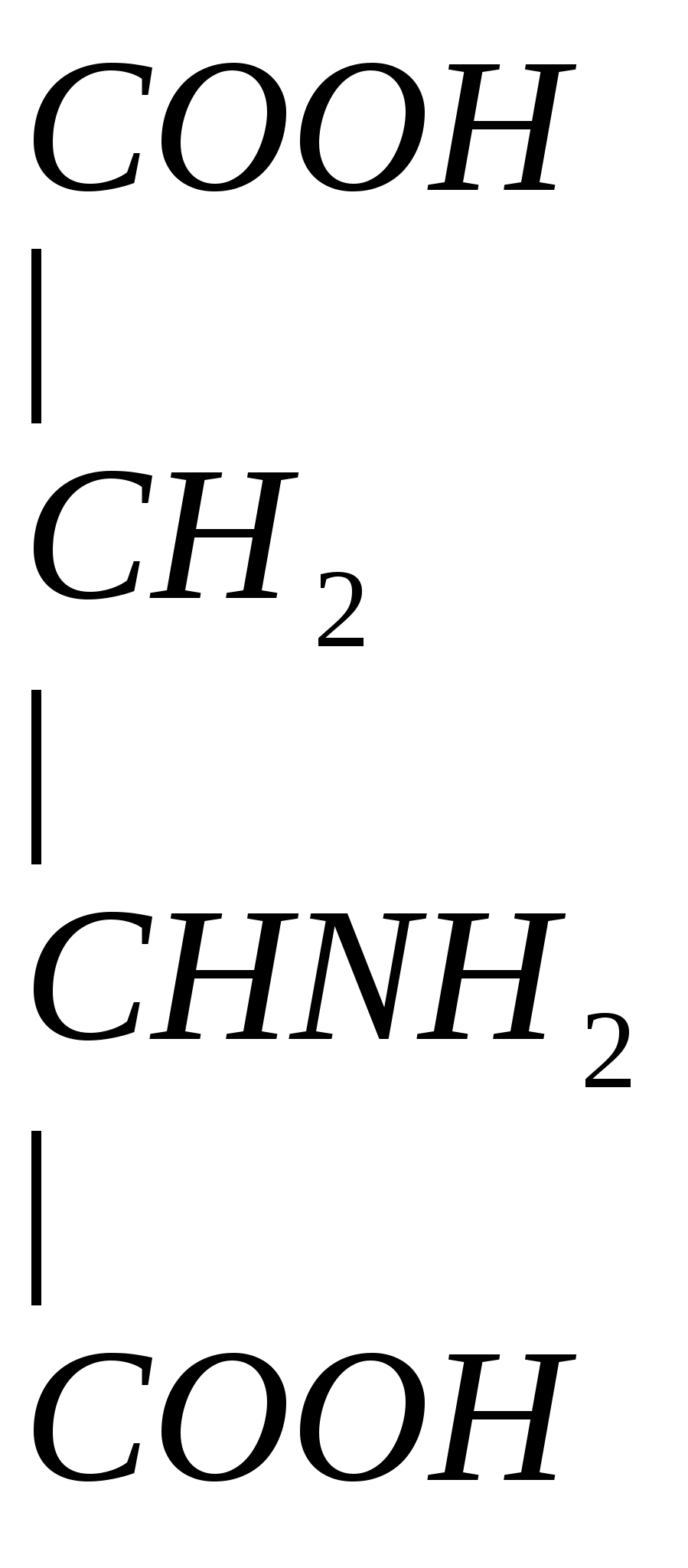 частвует в обезвреживании NH3 с образованием аспарагина (связыв. NH3 в 10 раз меньше, чем глу). Асн входит в полипептидную цепь (в геноме есть триплет).
частвует в обезвреживании NH3 с образованием аспарагина (связыв. NH3 в 10 раз меньше, чем глу). Асн входит в полипептидную цепь (в геноме есть триплет).При дезаминировании превращается в ЩУК.
Два источника ЩУК
а) асп (энергонезависимый путь)
б) Карбоксилирование пирувата (энергозависимый путь).
Без ЩУК не идет ЦТК, невозможен для многих веществ путь превращения в глю, т.е. глюконеогенез.
Асп – основа для синтеза пиримидиновых оснований. 4 положения из асп кислоты (по Лениджиру только 3) 2 остальных положения из карбомаилфосфата. Обезвреживание NH3 связано с синтезом пиримидиновых оснований.
Асп
В других тканях таких дипептидов мало, нужны для функционирования мышечной ткани и повышения физической работоспособности.
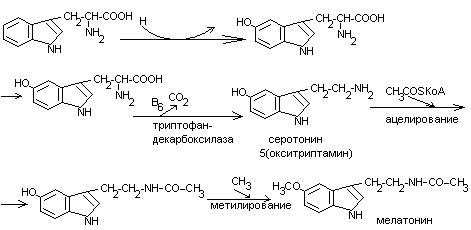
Обмен триптофана.
Триптофан – незаменимая кислота.
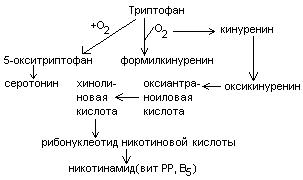
В физиологических условиях 95% триптофана окисляются по кинурениновому пути и не более 1% по серотониновому.
Основной обмен триптофана приводит к синтезу НАД, уменьшая потребность организма в витамине РР.
Обмен фенилаланина и тирозина.
Фен – незаменимая аминокислота. Тирозин может синтезироваться из фенилаланина. Глюко-кетогенные аминокислоты.
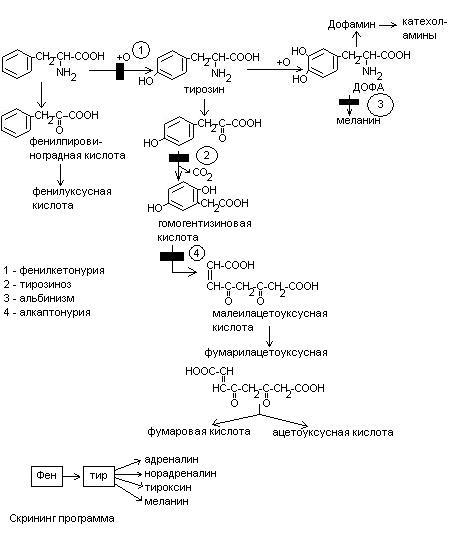
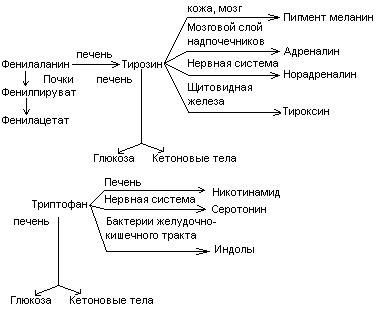
Синтез катехоламинов (адреналина, норадреналина)
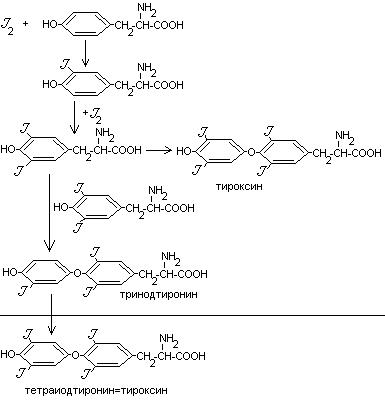
Синтез тироксина
.
Обмен разветвленных аминокислот.
Вал, лей, илей.
Незаменимые аминокислоты.
Вал
Лей
Илей
фумарат
глю
Лейцин
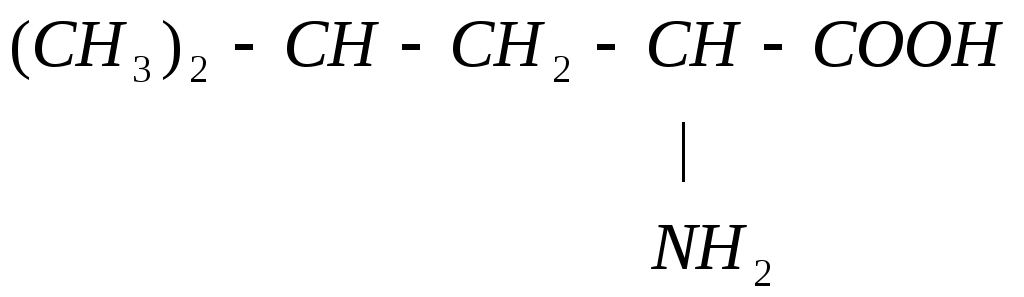
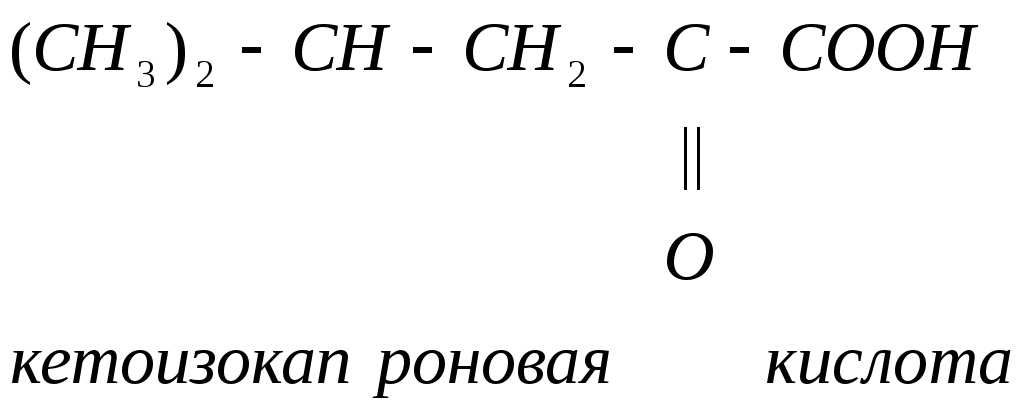
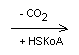
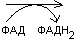


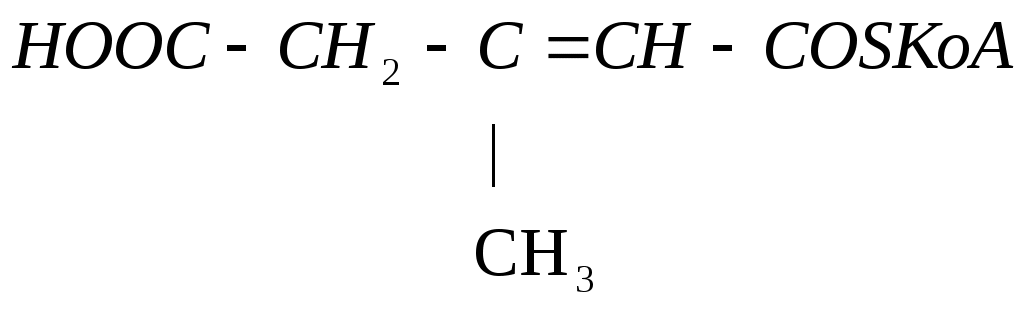
Ацетоацетат Ацетил-КоА
Структура и свойства нуклеопротеидов.
Функция нуклеопротеидов заключается в хранении и передаче наследственной информации.
Состоят из белков и нуклеиновых кислот. Простетической группой нуклеопротеидов является нуклеиновая кислота.
При легком гидролизе белок дает пептиды, а нуклеиновые кислоты дают нуклеотиды или нуклеозиды.
При жестком гидролизе образуются аминокислоты, азотистые основания (аденин, гуанин, урацил, цитозин, тимин), рибоза, дезоксирибоза.

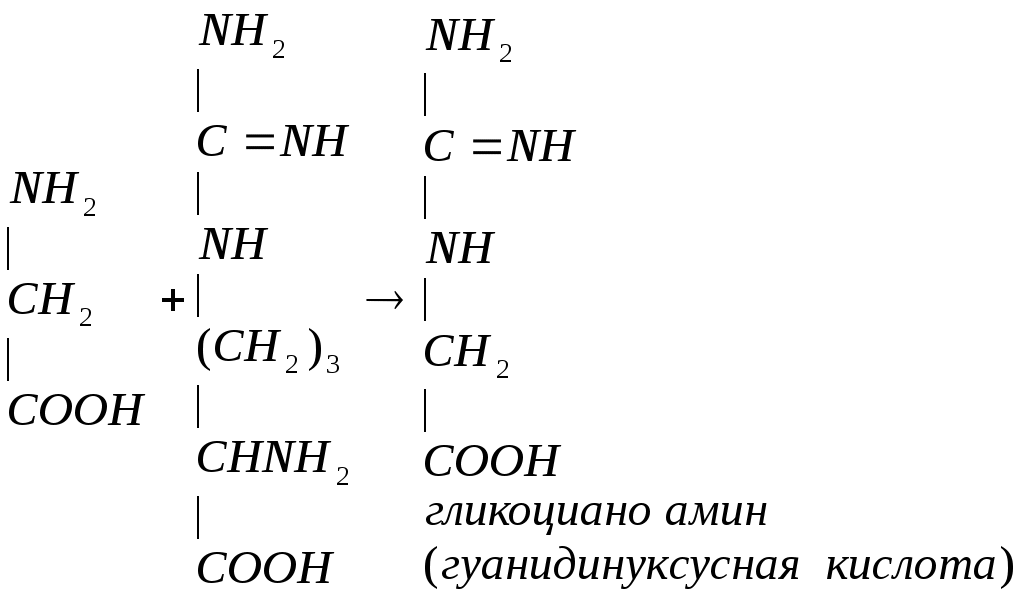
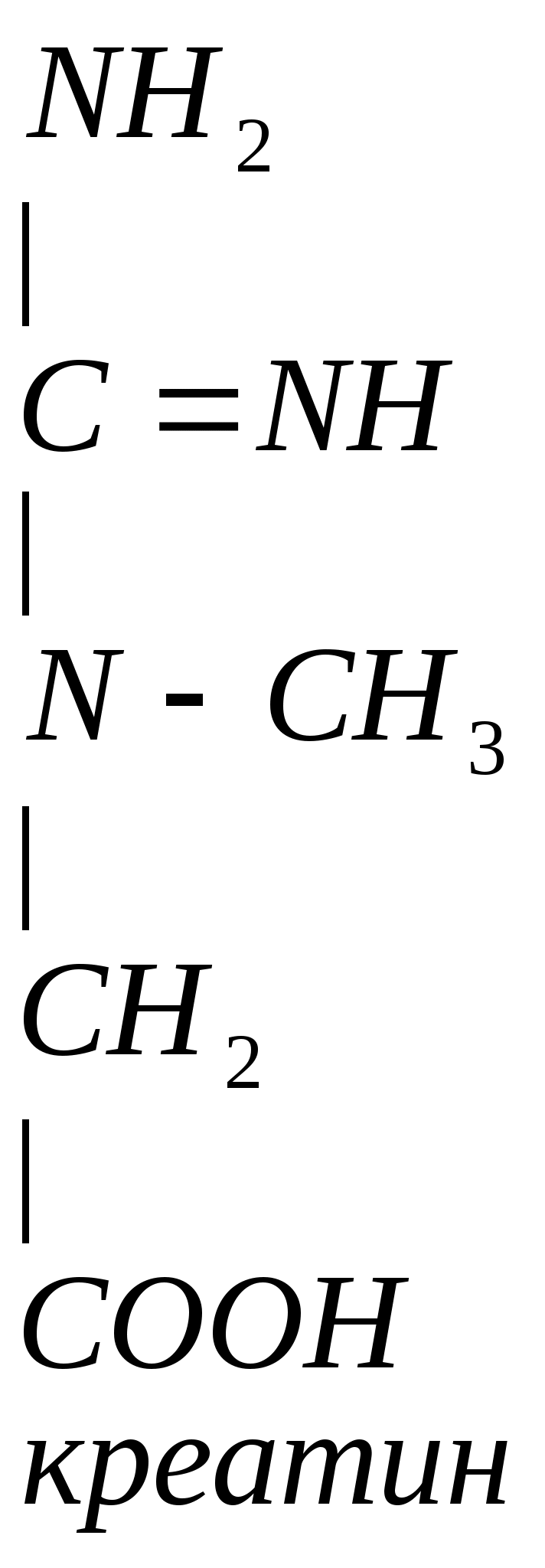
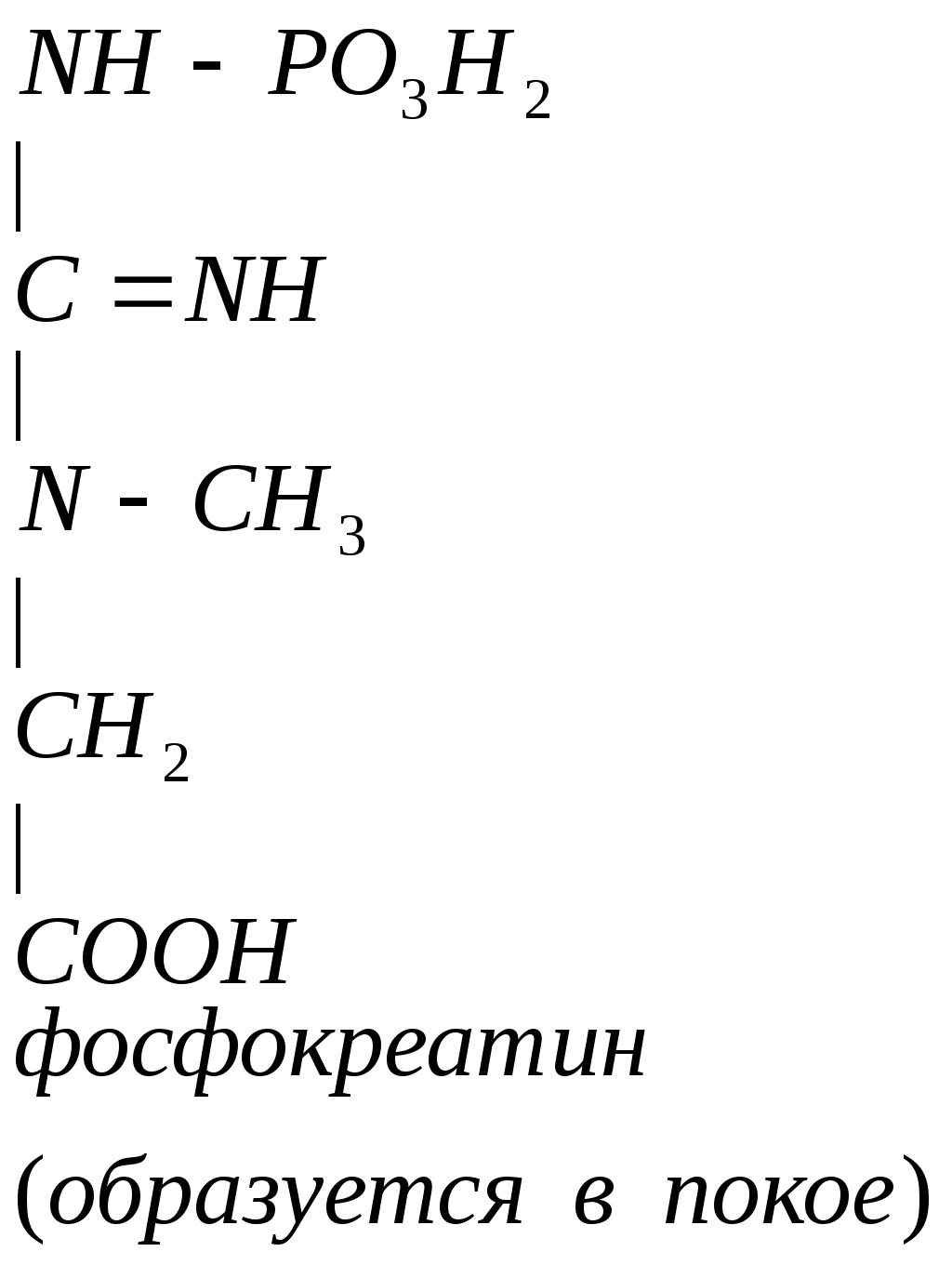
 | B6 |
| B6 |