Курсовая работа Лактоза Сукралоза Бальтер И.В. Курсовая работа по дисциплине Фармацевтическая технология по теме Фармацевтические аспекты и функциональная роль вспомогательных веществ лактозы и сукралозы в технологии лекарственных форм
 Скачать 3.62 Mb. Скачать 3.62 Mb.
|
|
Приложения 3.Лупанова, И. А. От фармацевтических ингредиентов к готовым лекарственным средствам / И. А. Лупанова, О. Ф. Верещагина, И. В. Воскобойникова. // Фармацевтические технологии и упаковка. — 2017. — № 3. — С. 11-16. ВВЕДЕНИЕ. Для создания эффективных, безопасных и качественных лекарственных средств необходимо грамотное использование вспомогательных субстанций на базе последних достижений в этой области. При этом ассортимент фармингредиентов постоянно расширяется как количественно, так и качественно; совершенствуются их технологические возможности, что открывает отличные перспективы для производства конкурентоспособных лекарственных форм. С 1998 года компания ЗАО «ФПК ФармВИЛАР» занимает одну из лидирующих позиций в поставках современных вспомогательных веществ на фармацевтические рынки России и стран СНГ. Мы представляем продукцию таких лидеров отрасли, как: DFE Pharma (Германия), Evonik Industries (Германия), Shin-Etsu (Япония), Dr. Paul Lohmann (Германия), Calmags (Германия), Beneo (Германия), StandardChem. and Pharm.Co. (Тайвань), а также производителей талька, крахмала и многих других фармацевтических ингредиентов. Хорошее знание рынка, его тенденций и потребностей, многолетний опыт работы и собственные научные разработки позволяют нам предлагать лучшие комплексные решения для фармацевтического производства. Ниже представлены, на наш взгляд, некоторые оптимальные комбинации вспомогательных веществ, а также технологические приемы для решения актуальных проблем, возникающих в процессе разработки и производства твердых лекарственных форм (ТЛФ). Наиболее распространенными ТЛФ являются таблетки, твердые дозированные лекарственные формы, чаще всего получаемые прессованием порошков или гранул, содержащих одно или более действующих веществ с добавлением или без вспомогательных веществ (ГФХIII, статья № 654). Технология прямого прессования (ПП) - один из наиболее экономичных и перспективных процессов производства ТЛФ. Мы рекомендуем следующие фармингредиенты для создания оптимальных комбинаций при ПП. Ниже мы рассмотрим более подробно вспомогательные вещества, используемые при прямом прессовании.  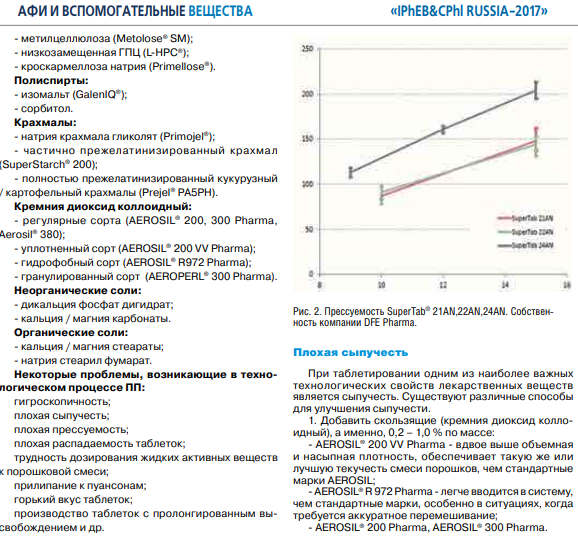  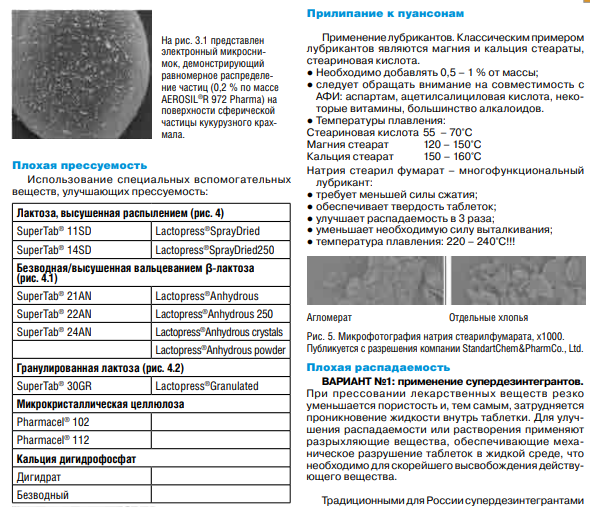    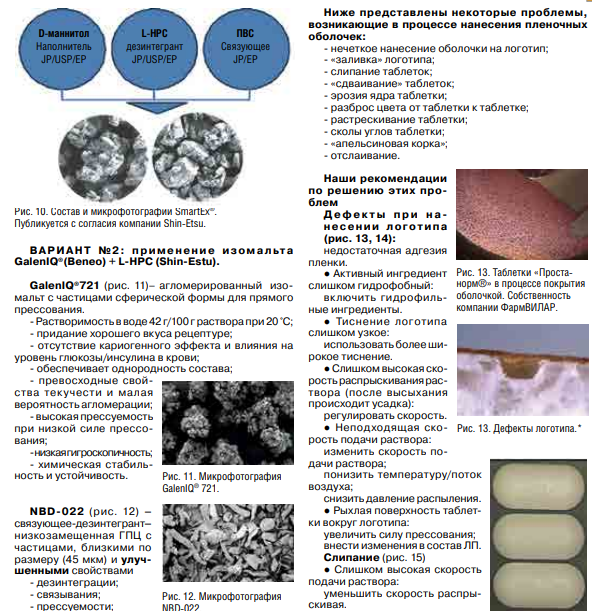  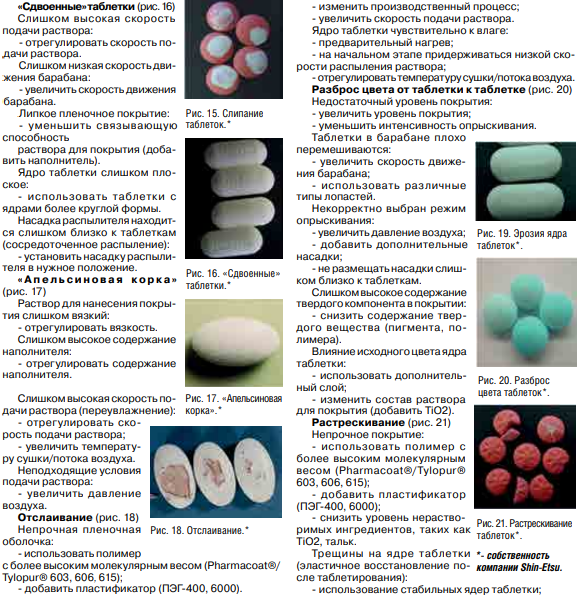  6. Майоров, А. А. Обоснование мембранных способов разделения молочной сыворотки / А. А. Майоров, Н. М. Сурай, С. Ю. Бузоверов. // Вестник Алтайского государственного аграрного университета. — 2012. — № 5 (91). — С. 104-107. Введение. Проблема дефицита молочного сырья в России и повышения эффективности молочной промышленности может быть решена за счет использования молочной сыворотки, ресурсы которой в нашей стране превышают 3,5 млн т в год. Переработка молочной сыворотки остается одной из главных проблем молочной промышленности [1]. Рациональное использование продуктов, получаемых из молочной сыворотки, является не менее актуальной и значимой проблемой, как и промышленная переработка. К сожалению, ей уделяется, в том числе переработчиками, потребителями и инвесторами, недостаточное внимание. Так, если в странах с высокоразвитой молочной промышленностью (США, Канада и др.) до 90% сыворотки идет на производство продуктов питания и кормовых средств, то в России только около 50% ее подвергается промышленной переработке [2, 3]. Таким образом, задача полного использования молочной сыворотки остается нерешенной и требует внедрения в практику новых технических и технологических решений. Молочная промышленность имеет достаточные резервы сыворотки, что указывает на актуальность поиска новых способов ее переработки. Молочная сыворотка является нормальным побочным продуктом при производстве сыров, творога, казеина, молочно-белковых концентратов и может быть отнесена к вторичным сырьевым ресурсам молочного подкомплекса АПК. Наиболее ценными компонентами молочной сыворотки являются сывороточные белки (альбумин и глобулин), содержание которых достигает 1%. Биологическая ценность их обусловлена оптимальным набором жизненно незаменимых аминокислот. Энергетическая ценность составляет 36% от цельного молока. Наряду с питательной ценностью молочная сыворотка и продукты, получаемые из нее, имеют диетическое и лечебное значение. Результаты исследований Развивающееся направление в переработке молока и молочных компонентов, основанное на использовании мембранных технологий, позволяет разрабатывать технологии, использующие преимущества мембранных технологий (ультрафильтрацию, нанофильтрацию, обратный осмос) с применением традиционных технологических приемов термокоагуляции белков. Небольшие габариты мембранных установок, их способность к изменению режимов работы, возможность коррекции состава получаемых продуктов позволяют разрабатывать широкую гамму продуктов с различным составом. Мембранные методы обработки можно разделить на два основных принципиальных направления: гиперфильтрация (микрофильтрация, ультрафильтрация, обратный осмос) и электродиализ (рис.). Сущность мембранных технологий основана на свойствах молочной сыворотки как гетерогенной системы с чётко выраженной селективностью компонентов по молекулярной массе, размерам и ионной силе. Применительно к молочной сыворотке главными достоинствами мембранных способов разделения являются: • возможность направленного регулирования её состава и свойств при сравнительно небольших энергетических затратах; • создание на этой основе новых молочных продуктов с пониженной калорийностью и высокой биологической ценностью; • рациональное использование молочной сыворотки на основе малоотходных и безотходных технологических процессов. Процесс гиперфильтрации основан на принципе обратного осмоса. Часть компонентов раствора, прежде всего растворитель, за счёт давления, создаваемого на раствор, проходит через мембрану, а другая, например, белки, задерживается. Происходит концентрация раствора. Гиперфильтрацию в зависимости от пористости применяемой мембраны и эффективности процесса разделения гетерогенных растворов условно делят. Ультрафильтрация. В случаях, когда осмотическое давление пренебрежимо мало по сравнению с рабочим давлением, что, например, характерно для водных растворов высокомолекулярных веществ, процесс разделения растворов с помощью полупроницаемых мембран называют ультрафильтрацией. Для проведения ультрафильтрации используют полупроницаемые мембраны диаметром пор от 10 до 100 нм, способные задерживать компоненты с молекулярной массой от 104 и выше. При ультрафильтрации мембрана задерживает только высокомолекулярные соединения и пропускает с фильтратом вещества, образующие «истинный» раствор. При ультрафильтрации молочной сыворотки задерживается (концентрируется) белок, а в фильтр уходят соли и лактоза. В фильтрат переходит около 30% кальция, 90% калия и натрия, 70% магния, 80% хлора и 50% фосфора, содержащихся в исходной сыворотке. В результате ультрафильтрации получаются белковые концентраты, содержащие высокомолекулярные соединения молочной сыворотки, и фильтрат (пермеат) — раствор лактозы, минеральных солей и других низкомолекулярных соединений. Основной задачей управления процессом ультрафильтрации является поддержание заданных технологических режимов с получением белковых концентратов с разной массовой долей сухих веществ [2]. Состав и физико-химические показатели УФ-концентратов в зависимости от массовой доли сухих веществ представлены в таблице. 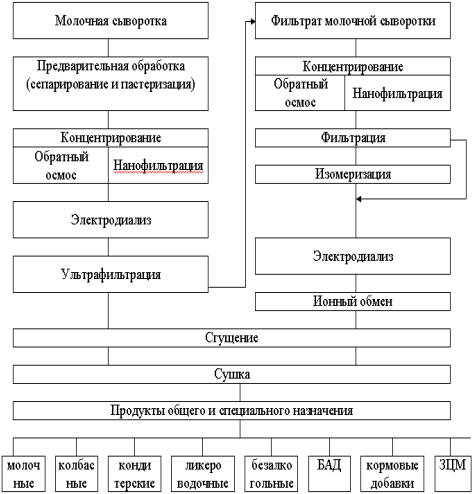 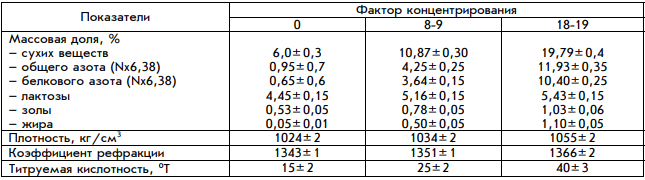 Частным случаем ультрафильтрации является диафильтрация, используемая для получения высокобелковых молочных концентратов. При диафильтрации концентраты, получаемые ультрафильтрацией, разбавляют водой (лучше деминерализованной) и подвергают повторной ультрафильтрации с целью «вымывания» низкомолекулярных компонентов, в частности лактозы и минеральных веществ. Недостаток ультрафильтрации и других методов мембранного разделения заключается в том, что одновременно с концентрированием белка происходит и концентрирование жировой фракции, что обусловлено практически полной селективностью мембран по жиру. Обратный осмос. Разграничить высоко и низкомолекулярные соединения трудно, деление это условно, поэтому нельзя четко разграничить процесс ультрафильтрации и обратного осмоса. В обоих случаях требуется преодолеть осмотическое давление фильтруемого раствора, так как растворитель переносится в направлении, противоположном возрастанию концентрации растворенного вещества, задерживаемого фильтром. Способом обратного осмоса производят концентрирование всех веществ, находящихся в растворе, и выделение чистого растворителя из раствора, за исключением некоторого количества одновалентных ионов Na, К, Cl. Практически обратный осмос сводится к сгущению раствора. Фильтры, применяемые для ультрафильтрации и обратного осмоса, принципиально различаются лишь размерами пор, последние мельче и обеспечивают перенос только растворителя. При обратном осмосе применяют полупроницаемые мембраны диаметром пор от 1 до 10 мм, способные задерживать компоненты раствора с молекулярной массой от 50 D и выше. Преимуществом обратного осмоса перед существующими способами концентрации растворов (например, сгущения в вакуум-выпарных установках) является возможность проведения процесса при любых температурах. Кроме того, расчёты показывают, что затраты энергии при обратном осмосе меньше, чем при использовании других традиционных способов концентрации, а расход тепловой энергии может быть исключен совсем. Оптимальным считается концентрирование методом обратного осмоса до массовой доли сухих веществ 20-30%. Обратный осмос должен найти применение для концентрирования сыворотки, что снизит потери и расширит пути ее рационального использования. Кроме того, одним из перспективных направлений использования обратного осмоса является обработка соленой сыворотки в целях исключения нежелательных явлений, связанных с наличием хлористого натрия, а также обработка конденсата вакуум-выпарных установок, что позволит рационально использовать оборотную воду и уловить отходящие с пеной и вторичными парами компоненты молочного сырья. Электродиализ. Одним из эффективных способов деминерализации молочной сыворотки является электродиализ. Применение электролиза позволяет снизить в сыворотке содержание минеральных веществ. Сущность процесса электродиализа заключается в том, что селективная ионитовая мембрана (перегородка) находится в контакте с раствором, под влиянием электрического поля пропускает ионы одного заряда и служит барьером для ионов противоположного заряда. При пропускании постоянного (или выпрямленного) электрического тока катионы солей, содержащихся в молочной сыворотке и рабочем растворе, перемещаются по направлению к катоду, а анионы солей — к аноду. Электронейтральные молекулы других веществ, входящих в состав молочной сыворотки, в электродиализном процессе не участвуют, поэтому при электродиализном обессоливании молочной сыворотки в рабочий раствор переходят только ионы солей, а содержание белков и лактозы не меняется. Изучение деминерализации творожной сыворотки показало возможность удаления до 90% минеральных веществ при незначительных потерях сывороточных белков и лактозы. Электродиализ молочной сыворотки не оказывает существенного влияния на качество и содержание сывороточных белков, лактозы и витаминов. В результате электродиализной обработки органолептические показатели молочной сыворотки значительно улучшаются. Установлено, что при обессоливании натуральной сыворотки капитальные и производственные затраты выше, чем при обессоливании сгущенной сыворотки, на 15% при 59%-ном и на 30% - при 90%-ном уровне деминерализации. Сгущение сыворотки приводит к снижению энергозатрат на процесс ее обессоливания и на перекачивание насосами, а также к повышению рабочей плотности тока и, следовательно, скорости обессоливания. Полученные методом электродиализа продукты часто используются в качестве основы для заменителей женского молока. В последнее время разрабатывается комбинированная технология, предусматривающая объединение методов электродиализа и ультрафильтрации. При этом получают сухой белковый препарат с максимальной концентрацией белка 35% и содержащий лактозу деминерализованный ультрафильтрат. Заключение При решении проблемы переработки молочной сыворотки необходима комбинация нескольких процессов разделения или концентрирования, позволяющая при минимальных затратах обеспечить производство высококачественных и безопасных продуктов, включающих все компоненты молочной сыворотки. Частным случаем ультрафильтрации является диафильтрация, используемая для получения высокобелковых молочных концентратов. При диафильтрации концентраты, получаемые ультрафильтрацией, разбавляют водой (лучше деминерализованной) и подвергают повторной ультрафильтрации с целью «вымывания» низкомолекулярных компонентов, в частности лактозы и минеральных веществ. Недостаток ультрафильтрации и других методов мембранного разделения заключается в том, что одновременно с концентрированием белка происходит и концентрирование жировой фракции, что обусловлено практически полной селективностью мембран по жиру. Обратный осмос. Разграничить высоко и низкомолекулярные соединения трудно, деление это условно, поэтому нельзя четко разграничить процесс ультрафильтрации и обратного осмоса. В обоих случаях требуется преодолеть осмотическое давление фильтруемого раствора, так как растворитель переносится в направлении, противоположном возрастанию концентрации растворенного вещества, задерживаемого фильтром. Способом обратного осмоса производят концентрирование всех веществ, находящихся в растворе, и выделение чистого растворителя из раствора, за исключением некоторого количества одновалентных ионов Na, К, Cl. Практически обратный осмос сводится к сгущению раствора. Фильтры, применяемые для ультрафильтрации и обратного осмоса, принципиально различаются лишь размерами пор, последние мельче и обеспечивают перенос только растворителя. При обратном осмосе применяют полупроницаемые мембраны диаметром пор от 1 до 10 мм, способные задерживать компоненты раствора с молекулярной массой от 50 D и выше. Преимуществом обратного осмоса перед существующими способами концентрации растворов (например, сгущения в вакуум-выпарных установках) является возможность проведения процесса при любых температурах. Кроме того, расчёты показывают, что затраты энергии при обратном осмосе меньше, чем при использовании других традиционных способов концентрации, а расход тепловой энергии может быть исключен совсем. Оптимальным считается концентрирование методом обратного осмоса до массовой доли сухих веществ 20-30%. Обратный осмос должен найти применение для концентрирования сыворотки, что снизит потери и расширит пути ее рационального использования. Кроме того, одним из перспективных направлений использования обратного осмоса является обработка соленой сыворотки в целях исключения нежелательных явлений, связанных с наличием хлористого натрия, а также обработка конденсата вакуум-выпарных установок, что позволит рационально использовать оборотную воду и уловить отходящие с пеной и вторичными парами компоненты молочного сырья. Электродиализ. Одним из эффективных способов деминерализации молочной сыворотки является электродиализ. Применение электролиза позволяет снизить в сыворотке содержание минеральных веществ. Сущность процесса электродиализа заключается в том, что селективная ионитовая мембрана (перегородка) находится в контакте с раствором, под влиянием электрического поля пропускает ионы одного заряда и служит барьером для ионов противоположного заряда. При пропускании постоянного (или выпрямленного) электрического тока катионы солей, содержащихся в молочной сыворотке и рабочем растворе, перемещаются по направлению к катоду, а анионы солей — к аноду. Электронейтральные молекулы других веществ, входящих в состав молочной сыворотки, в электродиализном процессе не участвуют, поэтому при электродиализном обессоливании молочной сыворотки в рабочий раствор переходят только ионы солей, а содержание белков и лактозы не меняется. Изучение деминерализации творожной сыворотки показало возможность удаления до 90% минеральных веществ при незначительных потерях сывороточных белков и лактозы. Электродиализ молочной сыворотки не оказывает существенного влияния на качество и содержание сывороточных белков, лактозы и витаминов. В результате электродиализной обработки органолептические показатели молочной сыворотки значительно улучшаются. Установлено, что при обессоливании натуральной сыворотки капитальные и производственные затраты выше, чем при обессоливании сгущенной сыворотки, на 15% при 59%-ном и на 30% - при 90%-ном уровне деминерализации. Сгущение сыворотки приводит к снижению энергозатрат на процесс ее обессоливания и на перекачивание насосами, а также к повышению рабочей плотности тока и, следовательно, скорости обессоливания. Полученные методом электродиализа продукты часто используются в качестве основы для заменителей женского молока. В последнее время разрабатывается комбинированная технология, предусматривающая объединение методов электродиализа и ультрафильтрации. При этом получают сухой белковый препарат с максимальной концентрацией белка 35% и содержащий лактозу деминерализованный ультрафильтрат. Заключение При решении проблемы переработки молочной сыворотки необходима комбинация нескольких процессов разделения или концентрирования, позволяющая при минимальных затратах обеспечить производство высококачественных и безопасных продуктов, включающих все компоненты молочной сыворотки. 8. Сеткина, С. Б. Биофармацевтические аспекты технологии лекарственных средств и пути модификации биодоступностью / С. Б. Сеткина, О. М. Хишова. // Вестник ВГМУ. — 2014. — № 4. — С. 162-172. Биофармацевтическая оценка может быть определена как исследование влияния физико-химических свойств лекарственного средства (ЛС), его формы выпуска, фармацевтических и технологических характеристик готовой лекарственной формы на степень и скорость всасывания действующего вещества. Как известно, для получения требуемого фармакотерапевтического эффекта действующее вещество должно находиться в месте реализации своего действия требуемое количество времени. Концентрация ЛС в системном кровотоке зависит от ряда факторов, включающих степень абсорбции, особенности распределения между системным кровотоком и другими тканями и жидкостями организма, параметры метаболизма и элиминации. Таким образом, факторы, влияющие на процессы всасывания, определяют количество поступающего в организм лекарственного вещества (в случае его поступления в фармакологически активной форме, не в форме пролекарства) и, соответственно, оказывают непосредственное влияние на биодоступность и оказываемое фармакотерапевтическое действие. Если рассматривать ситуацию при одинаковом режиме дозирования (доза, частота и время приема), следующие факторы могут быть значимыми с точки зрения их влияния на процесс всасывания: – факторы, связанные с индивидуальными параметрами организма пациента (возраст, пол, сопутствующие заболевания, особенности функционирования органов и систем, ритмичность физиологических процессов и др.); – факторы, связанные с биофармацевтическими параметрами готовой лекарственной формы (физико-химические свойства действующего вещества, вид готовой лекарственной формы и ее характеристики, состав и характеристика вспомогательных веществ, технологические параметры производственного процесса); – внешние факторы, не связанные с пациентом и ЛС, но модифицирующие процесс всасывания (прием пищи, одновременно принимаемые ЛС). Тщательное изучение характера влияния каждого из перечисленных факторов во многом определяет, насколько предсказуема достигаемая биодоступность в каждой отдельно взятой фармацевтической модели пероральной лекарственной формы. Хотя технологическая разработка должна в конечном итоге оценить и учесть влияние каждого из вышеуказанных факторов, биофармацевтические факторы представляют собой предмет особого интереса, поскольку являются причиной вариабельности терапевтического эффекта ЛС с одинаковым действующим веществом у одного и того же пациента, т.е. при прочих равных условиях in vivo. Ключевыми биофармацевтическими свойствами, определяемыми биофармацевтическими факторами и влияющими на абсорбцию твердых лекарственных форм (таблеток, капсул), являются: – высвобождение фармакологически активного вещества из лекарственной формы в раствор (растворимость и кинетика растворения); – стабильность растворенного вещества в физиологических жидкостях; – транспорт лекарственного вещества через биологические мембраны (проницаемость); – подверженность пресистемному метаболизму. Каждый из данных процессов моделируется целым рядом биофармацевтических факторов, требующих отдельного рассмотрения. Результаты и обсуждение Высвобождение фармакологически активного вещества из лекарственной формы в раствор (растворимость и кинетика растворения) В целом лекарственная форма формируется с целью обеспечения и контроля требуемого высвобождения и растворения действующего вещества. Абсорбции подвергается растворенное вещество, в связи с этим процесс растворения (количество и скорость перехода ЛС в раствор), является одним из наиболее значимых факторов в обеспечении требуемой биодоступности фармакологически активного вещества из готовой лекарственной формы. Скорость растворения сферических частиц лекарственного вещества описывается уравнением Ноя-Уитни (уравнение 1), впервые предложенного еще в 1897 году. Уравнение описывает процесс растворения, основанный на диффузии и не связанный с химическими реакциями. DA (Cs – C) dC/dt = _________________ (1) h в котором: dC/dt– скорость диффузии частиц лекарственного вещества; D– коэффициент диффузии; А – площадь активной поверхности частиц лекарственного вещества, находящаяся в контакте с внутренней средой желудочно-кишечного тракта; h – толщина диффузного слоя вокруг частицы лекарственного вещества; Cs – концентрация насыщения растворимости лекарственного вещества в диффузионном слое; С – концентрация лекарственного вещества в желудочно-кишечной жидкости. Хотя уравнение имеет ряд ограничений, оно позволяет показать, как изменения физико-химических и физиологических факторов могут влиять на скорость растворения лекарственного вещества в желудочно-кишечном тракте. 164 Физико-химические факторы, оказывающие влияние на значение переменных факторов, включают в себя размер частиц, молекулярную и кристаллическую структуру, гидрофильность и степень солюбилизации, размер молекулы действующего вещества. Значимыми физиологическими факторами являются рН, буферная емкость, содержание сурфактанта в желудочном соке и желчи, наличие компонентов пищи и вязкость полостного содержимого, двигательная активность ЖКТ, желудочно-кишечная секреция и количество жидкости в зоне растворения ЛС. Каждый из указанных факторов оказывает различное влияние на параметры скорости растворения ЛС. Молекулярная структура Как известно сходные типы межмолекулярных сил могут способствовать установлению взаимодействий между молекулами лекарственного вещества и растворителем (средой желудочно-кишечного тракта). Однако сила притяжения между полярными молекулами значительно более выраженная, чем неполярными. Полярный растворитель будет в большей степени растворять вещество, молекулы которого полярные (принцип «подобное растворяется в подобном»), и наоборот. Следует, однако, относиться к данному обобщению с определенной осторожностью, поскольку силы межмолекулярного взаимодействия, вовлеченные в процесс растворения, находятся под влиянием ряда факторов не столь очевидных с точки зрения общей полярности молекулы (например, образование межмолекулярных водородных связей может быть более значимым в реализации растворимости). Моделирование растворимости путем модификации молекулярной структуры является достаточно распространенным подходом повышения биодоступности. С учетом среды растворения ЛС повышение растворимости может быть достигнуто путем введения в молекулярную структуру полярных заместителей. Необходимо, однако, принимать во внимание, что данные заместители одновременно с повышением в целом растворимости могут повышать и химическую нестабильность молекулы ЛС, являясь субстратом для гидролитического расщепления и иных типов возможных химических реакций. Растворимость лекарственного вещества в диффузионном слое Скорость растворения лекарственного вещества согласно уравнению Ноя-Уитни прямо пропорциональна его растворимости в диффузном слое. Помимо аспектов растворимости в воде, для ЛС, являющихся слабыми электролитами, большое значение в обеспечении надлежащего перехода в раствор имеет рН диффузионного слоя, которое определяется рКа и растворимостью растворяемого ЛС и рКа и растворимостью буферов желудочно-кишечного содержимого. Скорость растворения ЛС слабых кислот в желудке (рН= 1-3,5) относительно низкая и относительно высокая для слабых оснований. С повышением рН по мере продвижения ЛС по ЖКТ соответственно меняется и растворимость. Зависимость скорости растворения от рН диффузионного слоя также является одним из путей моделирования растворимости готовой лекарственной формы. Поскольку рН диффузионного слоя будет повышаться с изменением химической природы растворяемого лекарственного вещества со слабой кислоты на соль слабой кислоты и сильного основания (например, натриевую или калиевую соль) вплоть до 5-6, данная модификация способствует значительному повышению растворимости ЛС, являющихся слабыми кислотами. Дальнейшая диффузия растворенной формы слабой кислоты в окружающее пространство за рамками диффузионного слоя приводит к его седиментации, однако ввиду крайне большой площади эффективной поверхности происходит быстрое повторное растворение. Так, например, гипогликемическое средство толбутамид натрия в 5000 раз быстрее растворяется в форме натриевой соли, нежели в форме слабой кислоты, что способствует быстрому и непродолжительному гипогликемическому эффекту, в то время как в форме кислоты гипогликемический эффект нарастает медленно и более продолжителен. Комплексообразование представляет собой один из факторов как снижения биодоступности, так и ее повышения. Негативный результат комплексообразования наблюдается при нежелательном образовании плохо растворимых комплексов между лекарственным веществом и содержимым желудочно-кишечного тракта (муцин, компоненты пищи) или вспомогательными веществами (например, дикальция фосфат и тетрациклин, амфетамин и натрия карбоксиметилцеллюлоза, фенобарбитал и ПЭГ 4000). Интересным является направление использования комплексообразования с группой циклодекстринов для повышения растворимости плохо растворимых ЛС. Циклодекстрин, представляющий собой энзиматически модифицированный крахмал, имеет гидрофильную поверхность снаружи кольца и гидрофобную внутри кольца, при этом внутренний диаметр близок по размеру большинству молекул низкомолекулярных ЛС. Повышение растворимости благодаря использованию циклодекстринов приводит к увеличению биодоступности до 2 раз и используется при производстве ряда ЛС (пироксикам, итраконазол, индометацин, гидрокортизон, диазепам и др.). Кристаллографические параметры: полиморфизм и сольватация Способность органических веществ существовать в виде двух и более кристаллических форм называется полиморфизмом. Различные полиморфные формы могут отличаться температурой плавления, гигроскопичностью, физической и химической стабильностью, растворимостью, биодоступностью, технологическими параметрами. При этом метастабильные формы, как правило, характеризуются большей скоростью растворения по сравнению со стабильной кристаллической полиморфной формой. Различия между растворимостью полиморфных форм могут оказывать существенное влияние на биодоступность, и, соответственно, терапевтическую эффективность. Например, для хлорамфеникола пальмитата, были продемонстрированы существенные различия в растворимости между метастабильной полиморфной формой В и стабильной полиморфной формой А, что в конечном итоге приводило к значимому снижению биодоступности формы А вплоть до терапевтической неэффективности лекарственной формы на ее основе. Известен также феномен конверсии более растворимой кристаллической формы (формы II) кортизона ацетата в менее растворимую форму (форму V) в ходе производства жидкой суспензионной формы, сопровождающийся образованием не ресуспендируемого осадка в готовой форме. Помимо наличия нескольких кристаллических форм, у лекарственного вещества может существовать и аморфная форма, для которой, в силу ее меньшей стабильности по сравнению с кристаллическими формами, может быть характерна большая растворимость и биодоступность. Кристаллографические изменения первичной формы действующего вещества могут происходить на этапах измельчения/микронизации, влажного гранулирования (переходы ангидраты-гидраты, кристаллическая - аморфная формы), распылительной сушки (кристаллическая – аморфная форма). Так, выявленный впоследствии переход кристаллических форм ритонавира в ходе производства (из I во II) явился причиной существенного снижения терапевтической эффективности капсулированной готовой лекарственной формы, обусловленной тем, что форма II ритонавира характеризовалась более чем в два раза меньшей растворимостью и, соответственно, биодоступностью. Это повлекло отзыв с рынка нескольких серий ЛС до выявления причин и обеспечения получения в готовом продукте формы I действующего вещества. Образование сольватов (в случае водного растворителя – гидратов), ассоциации молекул лекарственного вещества и молекул растворителя, может рассматриваться как иная кристаллографическая форма (иногда именуемая как псевдополиморфная форма), также модифицирующая свойство растворения ЛС. В целом, сольватация кристалла снижает растворимость и скорость растворения, влияя, таким образом, на биодоступность в частности плохо растворимых ЛС, которая существенно зависит от скорости растворения. Например, для безводной формы ампициллина характерна значительно более быстрая растворимость и абсорбция по сравнению с тригидратом ампициллина. Изучение кристаллографических свойств лекарственного вещества (в том числе в целевом растворе), а также отличий в характеристиках различных полиморфных форм, является важным условием выбора оптимальной с точки зрения стабильности и растворимости кристаллографической формы для получения 166 фармацевтической формы с заданными свойствами. Важным аспектом данной проблемы является способность взаимного перехода кристаллических и аморфных форм в процессе производства и хранения под воздействием различных физико-химических факторов, что требует тщательного изучения аспектов кристаллографической нестабильности и принятия мер по обеспечению условий, исключающих нежелательные изменения кристаллической структуры субстанции. Кристаллографическая оценка может быть проведена при помощи дифракционного рентгенографического анализа, дифференциальной сканирующей калориметрии, ЯМР спектроскопии, инфракрасной спектроскопии, или оптической микроскопии. Площадь поверхности и размер частиц Согласно уравнению растворимости, увеличение общей площади поверхности, контактирующей с жидкой средой желудочно-кишечного тракта, способствует повышению растворимости. Чем меньший размер частиц может быть достигнут, тем больше площадь активной поверхности, больше скорость (и в определенных случаях степень) растворения и выше биодоступность. Данный фактор особенно значимым является для плохо растворимых ЛС. Классическим примером влияния размера частиц на биодоступность является гризеофульвин, для которого продемонстрировано увеличение биодоступности в два раза при снижении размера частиц с 10 мкм (специфическая площадь поверхности = 0,4 м2г -1) до 2,7 мкм (специфическая площадь поверхности = 1,5 м2г -1). Существенное повышение биодоступности при снижении размера частиц было показано для многих ЛС (ацетилсалициловая кислота, ибупрофен, напроксен, толбутамид, нитрофурантоин, дигоксин, медроксипрогестерон и многие другие). Для многих плохо растворимых ЛС для получения частиц с наименьшим размером используется метод микронизации. Следует, однако, помнить о двух негативных факторах, сопровождающих процесс значительного уменьшения размера частиц. С одной стороны, значительное повышение биодоступности по сравнению с клинически изученным аналогом может изменять профиль безопасности ЛС вплоть до развития серьезных побочных реакций. Исходя из этого для определенных ЛС (в особенности имеющих узкий терапевтический интервал и выраженную зависимость биодоступности от размера частиц) фармакопейными статьями определяется оптимальный размер частиц, соблюдение которого в ходе производства готовой формы является частью требований к готовой лекарственной форме. С другой стороны, ряд плохо растворимых ЛС при достижении определенной степени измельчения начинают проявлять свойства агрегации, что приводит к снижению площади активной поверхности и в конечном итоге биодоступности. Такими свойствами, например, обладают ацетилсалициловая кислота, фенобарбитал и другие. Одним из способов преодоления данного нежелательного аспекта является проведение микронизации (измельчения) в присутствии какого-либо смачивающего или гидрофильного агента (например, полисорбата 80), позволяющих добиться тонкого измельчения и большой активной площади без эффекта агрегации, существенно повысив благодаря этому биодоступность плохо растворимой субстанции. Химическая стабильность В случае если ЛС проявляет свойства химической нестабильности, подвергаясь кислотному или ферментному гидролизу в просвете желудка, переход его в растворенное состояние в желудке будет означать снижение содержания действующего вещества и снижение биодоступности вплоть до потери эффективности. Для данной группы ЛС используется ряд технологических подходов и химическая модификация, направленные на замедление перехода веществ в растворенное состояние. Кишечное покрытие, капсулирование, микрокапсулирование, замедление высвобождения направлены на предотвращение разрушения действующего вещества в просвете желудка. Вспомогательные вещества Исторически вспомогательным веществам отводилась роль абсолютно инертных веществ, необходимых для формирования лекарственной формы. Однако стремительное развитие фармацевтической технологии привело к значимому повышению роли вспомогательных веществ в возможности реализации надлежащего терапевтического эффекта. При этом влияние вспомогательных веществ на терапевтический эффект также может быть как крайне положительным, так и крайне отрицательным и реализуется большей частью на уровне высвобождения, растворения и всасывания действующего вещества. Каждая из групп вспомогательных веществ и ее отдельно взятые представители способны в различной степени моделировать фармакокинетические параметры ЛС. Наполнители Являясь наиболее инертными с точки зрения своей функции в готовой лекарственной форме, данная группа веществ может, тем не менее, значимо повлиять на процесс высвобождения и растворения действующего вещества. Каждый из используемых в фармацевтическом производстве наполнителей обладает совокупностью специфических технологических и биофармацевтических характеристик, оказывающих в конечном итоге значимое влияние на параметры готовой лекарственной формы и высвобождение действующего вещества. Например, лактоза (марки Fast-Flo и безводная) характеризуется значительно лучшей распадаемостью и растворимостью по сравнению с микрокристаллической целлюлозой (МКЦ) или дикальция фосфатом. Один и тот же с химической точки зрения наполнитель может обладать совершенно различными технологическими свойствами. Для лактозы характерны существенные отличия между разными видами данного наполнителя, что было подтверждено физико-химическими и функциональными измерениями. Помимо различий размера и формы частиц обычной гидрированной лактозы, лактоза, полученная методом распылительной сушки, значимо отличается по своим кристаллографическим параметрам, представляя собой агломераты кристаллической α-лактозы моногидрата с порядка 10% аморфных молекул. Данный тип лактозы обладает лучшими свойствами текучести, но худшими компрессионными характеристиками, что требует добавления МКЦ в качестве связывающего вещества. Специфический брэндированный тип лактозы Fast-Flo обладает лучшими компрессионными характеристиками, обусловленными сферической формой кристаллов, и растворимостью. Лактоза безводная обладает наихудшими из двух указанных типов лактозы свойствами прессуемости и текучести. В ряде случаев наполнители могут неблагоприятно влиять на профиль высвобождения действующего вещества. Данное влияние может реализовываться на уровне формирования трудно растворимых комплексов, создания неблагоприятной среды для действующего вещества с точки зрения обеспечения стабильности, вступления в реакцию химического взаимодействия, а также формирования готовой формы с ненадлежащими свойствами (замедление разрушения, высвобождения действующего вещества). Одним из классических примеров является случай замены наполнителя в таблетированной форме фенитоина натрия с кальция сульфата дигидрата на лактозу. В первом случае фенитоин образовывал плохо растворимые комплексы с кальцием, что приводило к снижению всасывания и биодоступности. После изменения вспомогательного вещества на лактозу, всасывание фенитоина резко повысилось и у пациентов с эпилепсией, ранее стабилизированных на прежней технологической форме, на той же дозе фенитоина развились признаки фенитоиновой токсичности. Снижение антибактериальной активности наблюдалось при добавлении магния стеарата в таблетки цетилпиридиния хлорида ввиду абсорбции катионов действующего вещества анионами стеарата. Применительно к ЛС со свойствами физико-химической нестабильности, ненадлежащие характеристики наполнителя (повышенное содержание воды, катионы щелочно-земельных металлов) могут создавать благоприятные условия для их разрушения (гидролиза, окисления). Это может проявляться тенденцией стремительного роста примесей-продуктов деградации действующего вещества, что не только изменяет содержание действующего вещества в готовой лекарственной форме, но и может изменять профиль переносимости ЛС. Антифрикционные вещества: Влияние антифрикционных веществ, как в большинстве случаев веществ с выраженными гидрофобными свойствами, на высвобождение и всасывание действующих веществ может быть связано с замедлением проникновения жидкой среды желудочного содержимого в таблетку или капсулу, что может приводить к снижению скорости растворения. Данный нежелательный аспект может быть нивелирован добавлением смачивающих агентов (например, более гидрофильных сурфактантов или гидрофильных вспомогательных веществ). Одновременно с этим некоторые из антифрикционных веществ могут являться неиндифферентными с химической точки зрения и проявлять свойства катализаторов процессов гидролиза и окисления действующих веществ со свойствами физико-химической нестабильности. Подобного рода несовместимость описана, например, для одних из самых распространенных антифрикционных веществ, стеарата магния и кальция за счет наличия в их молекуле ионов щелочно-земельных металлов. Дезинтегранты: Парадокс процесса таблетирования заключается в том, что необходимо достигнуть максимальной компактности и механической прочности готовой лекарственной формы, обладающей при этом требуемым профилем высвобождения ЛС. Роль дезинтегрантов в обеспечении должного высвобождения и растворения действующего вещества крайне важна. Их функция заключается в разрушении твердой дозированной формы до уровня первоначальных частиц порошка, повысив тем самым до максимума активную площадь поверхности. Скорость разрушения таблетированной формы зависит от целого ряда факторов, помимо наличия дезинтегрантов, включая параметры производственного процесса (давления прессования, аспекты гранулирования и другие), количество и характеристики вспомогательных веществ. Однако при прочих равных условиях количество и функциональные характеристики дезинтегрантов могут существенно повлиять на скорость разрушения таблетки и высвобождения действующего вещества, что в конечном итоге может повлиять на биодоступность. Например, двухкратная разница в содержании дезинтегранта в двух различных таблетированных формах толбутамида сопровождалась существенными различиями в биодоступности и оказываемом гипогликемическом эффекте при одинаковом времени разрушения in vitro. Наличие в составе таблеток супердезинтегрантов (например, натрия крахмала гликолят) приводит к существенному снижению времени их распада и значимому изменению во времени высвобождения действующего вещества. Свойствами супердезинтегрантов обладают зачастую высокозамещенные и поперечносшитые полимерные соединения, при этом имеется определенная корреляция между дезинтегрирующей способностью, степенью замещения и числом поперечных связей полимера. Связывающие вещества Большинство связывающих веществ, используемых при влажном гранулировании, являются полимерами по своей природе. Физико-химические параметры и количество связывающих веществ оказывают непосредственное влияние на размер гранул и параметры готовой лекарственной формы (механическая прочность, распадаемость), что в свою очередь оказывает непосредственное влияние на высвобождение ЛС и его биодоступность. Ранжирование связывающих веществ по их влиянию на прочность гранул показало, что наибольшая прочность при наименьшем вводимом количестве достигается при использовании в качестве связывающих веществ желатина. Промежуточное положение по влиянию на данный параметр занимает поливинилпирролидон (ПВП) и наихудшими связывающими свойствами (достигается наименьшая механическая прочность гранул при наибольшем вносимом количестве) обладает полиэтиленгликоль 4000 (ПЭГ 4000). Связывающие вещества способны улучшать свойства пластической деформации гранул. Гидроксиметилпропилцеллюлоза, использование которой в качестве связывающего вещества существенно возросло в последние годы, характеризуется выраженным благоприятным влиянием на способность пластической деформации гранул, что способствует существенному снижению проявления эффекта разрушения по диагональным плоскостям в таблетированной форме по сравнению с МКЦ, ПВП и крахмалом. Добавление натрия лаурилсульфата к ПВП способствует улучшению пластичности гранул. Исследования показывают, что не только физико-химические параметры и количество связывающих веществ, но и способ их введения в гранулируемую массу существенно влияют на параметры таблетированной формы. Например, изучение влияния роторного гранулирования на результаты использования в качестве связывающих веществ гидроксипропилметилцеллюлозы (ГПМЦ), желатина и ПВП показало, что применение ГПМЦ способствовало формированию более длительного профиля высвобождения действующего вещества, меньшим размерам частиц и лучшей однородности массы. Процесс производства Процесс производства представляет собой сложный многофакторный процесс, в ходе которого таблетируемая масса подвергается множественному воздействию, направленному в конечном итоге на формирование из порошковой массы таблеток с заданными механическими и физическими свойствами. Характер модифицирующего воздействия переменных факторов производственного процесса на конечные свойства готовой лекарственной формы находится в тесной взаимосвязи с иными параметрами такой сложной физико-химической системы, как таблетка, а именно составными компонентами и их физико-химическими, кристаллографическими и функциональными характеристиками. В рамках данного краткого обзора биофармацевтических факторов, оказывающих значимое влияние на параметры биодоступности, среди множества сложных процессов, лежащих в основе формирования микроструктуры таблетки в ходе производственного процесса, возможным представляется указание основных векторов реализации влияния двух наиболее значимых в рамках данного контекста процессов - процесса гранулирования и прессования - на рассматриваемые параметры системы. Гранулирование в настоящее время: большая часть таблетированных лекарственных форм производится с применением в ходе технологического процесса этапа гранулирования, хотя имеется тенденция к более широкому использованию метода прямого прессования при разработке новых лекарственных форм. Гранулирование направлено на решение как ряда технологических задач (повышение насыпной плотности порошка, улучшение свойств текучести, гомогенности смеси, улучшение прессуемости и другие), так и на модификацию биодоступности ряда веществ, в особенности гидрофобных по своей природе, путем формирования гранул из тонко измельченной субстанции с добавлением гидрофильного наполнителя и гидрофильного связывающего вещества. Использование гранулирования порошковой смеси повышает скорость процесса дезинтеграции таблетки, повышая скорость перехода действующего вещества в раствор и его всасывание. Введение в гранулы дезинтегранта способствует значительному повышению скорости деагрегации гранул и также модифицирует скорость высвобождения и всасывания в сторону ее дальнейшего повышения. Таким образом, можно сказать, что гранулирование оказывает влияние на конечные параметры биодоступности путем модификации скорости разрушения таблетки и скорости растворения за счет влияния на микроструктуру таблетки, а также за счет повышения скорости растворения гидрофобных действующих веществ путем их «внешней» гидрофилизации. Исходя из этого совершенно очевидно, что использование либо не использование производителями готовых таблетированных форм процесса гранулирования, множественные параметры его проведения (прессованное или влажное гранулирование, способ гранулирования и технологические параметры гранулятора, параметры смешивания гранулируемой смеси, состав гранулята и другие), добавляемые в гранулы вспомогательные вещества приводят к формированию существенных различий в конечных свойствах готовой лекарственный формы, непосредственно влияющих на биодоступность. Прессование Параметры процесса прессования (давление прессования и скорость прессования) оказывают непосредственное воздействие на ряд характеристик готовой таблетированной формы: плотность, распадаемость, твердость, пористость, растворимость, площадь специфической поверхности. Безусловно, такие параметры, как твердость, хрупкость, распадаемость и растворимость определяются, прежде всего, составом и свойствами входящих в состав таблетируемой массы компонентов, од- 170 нако параметры прессования также способны оказывать определенное воздействие на данные важные с точки зрения биодоступности параметры. Наиболее важным в рамках рассматриваемой темы представляется влияние параметров прессования на прочность таблетки и, соответственно, ее распадаемость и растворение, поскольку данные параметры, с одной стороны, находятся в непосредственной взаимосвязи со скоростью высвобождения действующего вещества и его биодоступностью, а с другой стороны, являются интегральными характеристиками совокупности ряда других параметров. В целом увеличение давления прессования приводит к увеличению прочности и времени распада таблетки. В упрощенном виде зависимость прочности от давления прессования в интервале низких значений давления прессования будет носить линейный характер (чем выше давление, тем больше прочность таблетки). Однако от определенного значения давления уже не будет наблюдаться прямо пропорционального возрастания прочности, кривая зависимости принимает форму плато для хорошо таблетируемых материалов или демонстрирует резкое снижение (сигмоидальная форма) для таблетируемых материалов, подвергающихся процессам расслоения или разрушения по диагональным плоскостям при приложении давления прессования превышающего определенное критическое значение [5]. Эти формы зависимости объясняются физико-механической теорией прессования, сложными процессами изменения частиц под воздействием прилагаемой силы (фрагментация, пластичная или эластичная деформация, деформация во времени) и для каждого из прессуемых материалов определяются совокупностью индивидуальных параметров каждого прессуемого компонента в отдельности и смеси (в том числе гранулята) в целом, такими как пористость, плотность, форма, размер и прочность кристаллов (частиц) и другими. Не следует забывать и о посткомпрессионных изменениях таблетки, также видоизменяющих параметры прочности в сторону ее увеличения либо уменьшения, при этом каждая из таблетируемых смесей характеризуется своим типом посткомпрессинных изменений, определяемых свойствами таблетируемой массы и использованным режимом прессования [1, 5]. Зависимость между временем распада и давлением прессования зачастую в интервале низких значений давления прессования носит экспоненциальный характер, однако для составов, содержащих дезинтегранты, данная зависимость может иметь гораздо более пологий характер. При этом для разных дезинтегрантов и их количества характер данной зависимости в каждом случае будет различным. Влияние параметров прессования на конечные свойства и формируемую микроструктуру таблетки носит достаточно сложный характер и в каждом случае данная зависимость характеризуется уникальными числовыми и функциональными характеристиками, поскольку определяется всем многообразием физических и механических свойств таблетируемой смеси. В конечном итоге точный тип зависимости может быть определен для отдельно взятой таблетируемой смеси (включая гранулят) только экспериментальным путем при моделировании различных режимов прессования на определенном типе оборудования (давления прессования, времени прессования и др.). Группы веществ с критическим типом влияния параметров растворения на биодоступность и терапевтический эффект Рассмотренные выше некоторые биофармацевтические факторы в своей совокупности способны модифицировать параметры разрушения твердой лекарственной формы и перехода действующего вещества в растворенное состояние. Следует отметить, что степень влияния данных факторов имеет различную клиническую значимость для ЛС с разным профилем высвобождения действующего вещества, различными физико-химическими и фармакологическими свойствами. Исходя из указанной выше направленности модифицирующих свойств биофармацевтических факторов, наиболее значимым, вплоть до потери терапевтической эффективности или изменения профиля безопасности, данное влияние может являться для следующих групп лекарственных веществ: – лекарственные вещества с низкой растворимостью. Варьирование биофармацевтических факторов для ЛС данной группы (использование оптимальной кристаллографической формы, степень измельчения, модификация рН и толщины диффузного слоя, гидрофилизирующие вспомогательные вещества, параметры гранулирования) существенно влияет на всасывание веществ данной группы и их биодоступность. – лекарственные вещества, имеющие особенности всасывания (всасывание на определенном участке желудочно-кишечного тракта, «окно всасывания»). Путем обеспечения нахождения и растворения ЛС на определенном участке ЖКТ достигается максимально возможное всасывание и биодоступность, в противном случае всасывание действующего вещества не достигает требуемого уровня. – соединения, обладающие свойствами физико-химической нестабильности в кислой либо щелочной среде. Использование различных биофармацевтических подходов (использование оптимальной кристаллографической формы, защитные оболочки, капсулирование и микрокапсулирование, модифицированное высвобождение, комбинация вспомогательных веществ, параметры прессования и гранулирования) позволяют обеспечить переход действующего вещества в раствор в той части ЖКТ, где достигается оптимальная стабильность и всасывание действующего вещества. – лекарственные вещества с узким терапевтическим интервалом, для которых незначительные изменения биодоступности могут привести к существенному изменению терапевтического эффекта. Критические аспекты биофармацевтических свойств лекарственных веществ, требующих в ряде случаев реализации специфических технологических подходов с учетом биофармацевтических факторов, отражены в биофармацевтической классификации, разделяющей все лекарственные вещества на четыре класса: хорошо растворимые и хорошо всасываемые, плохо растворимые и хорошо всасываемые, плохо всасываемые и хорошо растворимые, плохо растворимые и плохо всасываемые [2]. Совершенно очевидно, что наиболее сложной для фармацевтической и технологической разработки представляется вторая и четвертая группы веществ по данной классификации. Заключение: Таким образом, многообразие вышеуказанных биофармацевтических факторов способно значимо модифицировать конечные свойства таблетированной микросистемы, что в конечном итоге может приводить к существенным различиям в биодоступности и реализуемом терапевтическим эффекте. Полная оценка всех биофармацевтических факторов на этапе фармацевтической разработки, определение оптимального состава и параметров производственного процесса требуют глубоких знаний не только в разрезе целого ряда фармацевтических и химических наук, но и затрагивает ряд иных сфер научных знаний, включая фармакологию, физиологию (в том числе патологическую физиологию для моделирования процесса при условии изменения нормальных физиологических параметров), ряд направлений физических наук, математическое моделирование. Пренебрежение биофармацевтическими факторами может привести к созданию лекарственной формы со свойствами, не обеспечивающими оптимальное всасывание и биодоступность ЛС, что в конечном итоге может оказать значимое влияние на фармакотерапевтический эффект вплоть до его утраты и развития у пациента жизнеугрожающего состояния. Изучение и адекватное применение данных знаний способствует оптимизации фармацевтических и фармакокинетических свойств готовой твердой лекарственной формы и должно рассматриваться как неотъемлемая часть фармацевтической разработки создаваемых ЛС. 11.Петерс, Х. Д. Функциональные свойства лактозы для сухой грануляции / Х. Д. Петерс. — Текст : непосредственный // Медицинский бизнес. — 2016. — № 3. — С. 6-7.     15.Котикович, Ю. С. Биологические эффекты сукралозы — популярного искусственного сахарозаменителя / Ю. С. Котикович. — Текст : непосредственный // Украинский медицинский журнал (Український Медичний Часопис) . — 2013. — № 6.    |
