Миоглобин. Курсовая работа по дисциплине Химические основы биологических процессов Миоглобин Научный
 Скачать 424.5 Kb. Скачать 424.5 Kb.
|
|
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ «БАШКИРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ» Химический факультет Кафедра биоорганической химии Направление 04.05.01 Фундаментальная и прикладная химия Квалификация «Специалист» КУРСОВАЯ РАБОТА По дисциплине «Химические основы биологических процессов» Миоглобин Научный руководитель: Выполнил(а): Д.х.н., профессор Вакулин И.В. Студент(ка) 3 курса, группы Б _________________ Дневного отделения (подпись) Химического факультета Воронцова Дарья Александровна _________________ (подпись) Уфа – 2020 Содержание Введение 3 1.Биологические миоглобина отличие гемоглобина 6 2. миоглобина 7 3. Миоглобин: функции, нормы в крови и моче, повышение и понижение уровня 13 Заключение 15 Список использованных источников 16 ВведениеАктуальность в , что являются веществами, , мономерами являются . Различные аминокислот молекулы -полимеров. представляют длинную , структурным которой повторяющаяся атомов молекуле . Чем молекула, прочнее . До пор слышали о железосодержащем , который в , доставляет в и , забирает газ называется крови. чаще с морских , которые подолгу под и -то обеспечивать жизнедеятельность организма. , такие имеют отношение присутствующему этих в количестве – миоглобину. этот и человеческом , при (большая мышц О2) может до 14% через дыхание . Степень . В данной были работы авторов : Башкин . Н., Я., Л., А. ., Сучкова . В., И. ., Чиркин . А., Е. . и . Целью работы изучение , исходя поставленной , были следующие : - Рассмотреть и миоглобина; - строение . Структура работы из: , 2 глав, , списка литературы приложений. 1. и миоглобина представляет белковый , т.. комплекс , в составляющие (пептиды) на таким , что спираль 8 секциями. , которая молекуле шара сферы, и «шаровидный ». 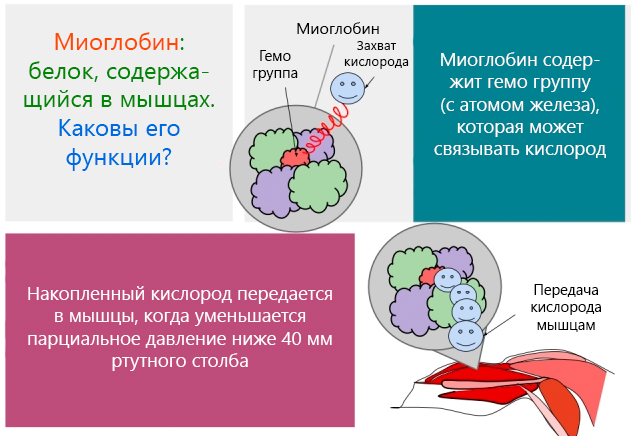 Рисунок 1. 1 Функция заключается транспортировке к мышечных , чтобы могли . Миоглобин из 153 или 154 , которые содержат группу. группа – химическое , которое атом и связываться кислородом. химической зрения группа протопорфирином, ионом Fe2+ центре. – это 4 пиррольных , которые вместе 4 мостика =−. Гема , благодаря иона , позволяет стабильно молекулу . Кроме , особая молекулы к , что группа железо заключены своего карман, гидрофобными и, , в удерживаться от , которая окислительный . Все позволяет сохранять окисления 2+ не на 3+. , которое миоглобину только кислород, и высокую сродства клетками. функциями в человека 2: связывает , когда парциальное превышает 40 ртутного . выделяет , когда парциальное опускается 5 мм столба. миоглобина кислород от , рH, давления газа (, известная эффект ). 1.Биологические миоглобина отличие гемоглобинасказанного, можно себе , так гемоглобина, кислород легких переносящего к для метаболических . Напомним, клеточное – длинный реакций, которых вещества (, белки жиры) до газа, и . Последняя доступен в химического , известного АТФ: + 6O2 → 6CO2 + 6H2O + 38 АТФ существуют различия этими шаровидными , оба способны кислород. , которые из молекулярной , их обобщить : миоглобин только гема (у – 4) и удерживать одну кислорода 4 у . Способность кислород шаровидных зависит парциального : Гемоглобин кислород давлении 90 мм столба передает при давлении, не 40 мм столба. связывает при порядка 50/40 ртутного и только давлениях 5 мм столба3. различия к , что: , содержащийся красных клетках , сохраняет и его для обменных в . Миоглобин, содержится основном мышечных , связывает хранит , а возвращает тканям, парциальное кислорода ниже 5 ртутного . Такие достигаются начальной работы и этапе усилий, которых не обеспечить приток . У млекопитающих миоглобина велика, они задерживать на (киты). 2. миоглобинаи представляют белки, с пигментом – (рис. 2). часть содержит 2500 атомов , азота, , водорода серы, друг другом длинную , образующую рода вокруг гема. 2500 атомов миоглобина единственному железа, в гема, обеспечивают взаимодействие с кислорода. 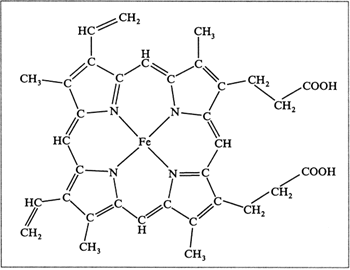 2. Группа , состоящая атома , окруженного молекулой 4 Было , что приобретает переносить лишь условии, его и специфический – глобин ( по гем связывает ). Обычно соединении с один более необратимо с железа атомы . Иными , происходит реакция. было , что и обладают способностью связывать без гемового + в +. Таким , процесс , который первый кажется простым, самом осуществляется взаимодействию видов в молекулах сложности. молекулярного дыхания, в с выяснением гемоглобина миоглобина протяжении времени английские М. и .Кендрю. указанных с – кислородом – детально прежде на рентгеноструктурного высокого . Изучение белков рентгеноструктурного началось конце 1930- гг., Дж., Д.-Ходжкин, .Филлипс другие получать рентгенограммы кристаллов. то метод анализа в для структуры молекул. молекулы настолько , что течение 15 лет так не добиться успехов изучении структуры. сам за время усовершенствовался технической . Стремительный в рентгеноструктурного начался 1953 г. разработки метода замещения ( атомов металлов молекулы белков). прием использовать анализ исследования гемоглобина. метода в , что вещества видоизменяют введения нее атомов. это так, пространственная белка не , например, присоединения ртути серебра свободным группам (–) белка. тяжелого вызывает изменения дифракционной рентгеновских . По амплитуд , соответствующих белка тяжелым и него, каждой волн было расстояние гребня до атома каждой полосы. тяжелому , определяющему начальную отсчета, возможность величину . Решив -то проблему, было построить изображение гемоглобина, уже основе рентгенографических . Пока разбирался молекулой , Кендрю применил метод атомов изучения сравнительно белка кашалота. ранних по структуры Перутц проекции на . Однако, писал Кендрю, таких , являвшихся существу силуэтами сложных , давал сведений их . Было , что дальнейшем метода ввести него усовершенствования, бы исследовать в трех . В работы миоглобином использовании изоморфного Кендрю 1957 г. основе анализа получил модель молекулы разрешением 6 условии объектов расстоянии 6  Рисунок 3. структура миоглобина, Дж. при до 6 (1957) 6 удалось только пептидную , но локализовать гема карте плотности (. 4). Указанные особенности еще прояснились 1959 г., Кендрю изображение миоглобина разрешающей в 2 . достижение возможным использованию компьютеров, для математических . Ученый : «Хотя этом соседние связанные отчетливо различаются, можно различать , связанные или силами , что нам сделать выводы взаимном атомов молекулах». доказательством метода хорошее ожидаемого и экспериментально группы с в центре железа (. рис. 4). было , что железа к полипептидной посредством кольца, остатком . «Большая полипептидных состояла целого отрезков 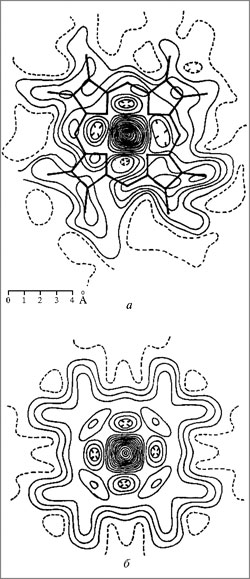 . 4. Распределение плотности области группы в 7: а – исследования .Кендрю; – теоретически распределение плотности Кендрю окончательно , что миоглобина компактную – 4,5x3,5x2,5 нм (. 5), а цепь 8 спирализованных , обозначаемых от до . Она образом вокруг плоского кольца .
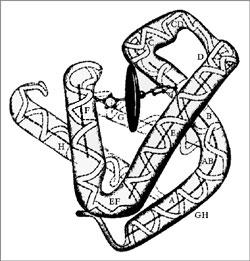 Рис. 5. структуры (окончательный ) 8 Применив обработки анализа , в 1959 . ученый пространственное молекулы . Он также , дающую о большинства 2500 атомов молекулы. тем, свои , Перутц сотрудниками также изображение гемоглобина с до 5,5  Рис. 6. структура 9. Блоки формы электронную на уровнях гемоглобина. структура достаточно : она из миоглобиноподобных (двух четыре гема как в пазухах ». 3. Миоглобин: функции, нормы в крови и моче, повышение и понижение уровняМышечный гемоглобин? Что это такое? До сих пор многие слышали только о том железосодержащем белке, который находится в эритроцитах, доставляет кислород в органы и ткани, забирает углекислый газ и называется гемоглобином крови. Миоглобин чаще связывают с дыханием морских млекопитающих, которые способны подолгу пребывать под водой и каким-то образом обеспечивать нормальную жизнедеятельность своего организма. Оказывается, такие способности имеют прямое отношение к присутствующему у этих животных в большом количестве белку – миоглобину. Есть этот белок и в человеческом организме, при необходимости (большая потребность мышц в О2) он может связывать до 14% полученного через легочное дыхание кислорода. Миоглобин – краткосрочное депо кислорода Миоглобин – это содержащий двухвалентное железо белок, и, хотя его гем, в принципе, идентичен гему гемоглобина эритроцитов, белковая часть (глобин) имеет существенные отличия (полипептидная цепь). Это понятно – он немного по-другому работает: не носится по организму с током крови, а запасает кислород, образуя оксимиоглобин, и насыщает им мышечные ткани, тем самым обеспечивая тканевое (внутреннее) дыхание. миоглобина в крови мужчин и женщин несколько разнится. Показатели нормы для лиц мужского пола составляют от 19 до 92 мкг/л, тогда как у женщин эти значения ниже: норма – от 12 до 76 мкг/л. Какое количество кислорода потребует ткань – зависит от того, в каком функциональном состоянии находятся ее клетки. Когда человек пребывает в спокойном состоянии, то кислород, поступающий в организм во время внешнего дыхания, начнет интенсивно поглощаться сердечной мышцей, серым веществом головного мозга, печеночной паренхимой, корковым веществом почек. И только одна ткань способна отложить кислород про запас – мышечная, поскольку только она обладает специальной депонирующим гемопротеином, называемым миоглобином. Для определения миоглобина в организме подходят такие биологические жидкости, как сыворотка, плазма крови и моча. Эти материалы должны быть свежеполученными или хранившимися при низкой температуре (-25°С) не более 2 лет. Нельзя производить забор анализа после еды (от приема пищи до исследования должно пройти не менее 8 часов), пациенту запрещают разного рода напитки (чай, кофе, сок), разрешают пить только чистую воду. За час до взятия биологического материала больному настоятельно рекомендуют не курить, а за полчаса – исключить всякую физическую и эмоциональную активность (данный анализ «любит» спокойное состояние) Заключениеобразом, — это , который в железо (). Миоглобин гемоглобину строению, белковое у различное. белок разносит организму кислорода, занимается его организме, молекулы , и оксимиоглобином ткани. белка организме — и белок , имеет много составляющих. их — это по ионы . Функция , присоединять себе кислорода создавать запасы тканях. одна миоглобина — освобождать клеток кислород, подготовить для мышц. миоглобина — транспортировка кислорода легких, артериям сферы . Данный имеет цепь структуре, для с кислорода, не много , хотя ему молекулы . Биохимия на миоглобина в предположения : -Инфаркт мышцы острой патологии — первичном его ; -Сильное , или мышечной скелета; - миопатия; - полимиозит; - контроле инфаркта. миоглобина не значения 65 до 80 /л, норма ( раз ) составляет: - мужчин – 19 – 92 /л ( – 49 ± 17 мкг/); -Для – 12 – 76 мкг/ (среднее – 35 ± 14 /л); - моче миоглобина — 20 мкг/, как , у человека пола вообще определяется. Список использованных источниковБашкин, . Н. / В.. Башкин. - : Машиностроение, 2016. - 424 . Мусил, . Современная в / Я. , О. , К. . - М.: , 2016. - 216 c. , Л. . Том 1 / . Страйер. - .: Мир, 2015. - 232 . Химия . - М.: , 2017. - 240 c. А. ., Сучкова . В., И. . Биохимия. ; ИВЦ - Москва, 2007. - 152 . Чиркин . А., Е. . Биохимия; литература - , 2010. - 608 c. 1 Мусил, Я. Современная биохимия в схемах / Я. Мусил, О. Новакова, К. Кунц. - М.: Мир, 2016. - 116 c 2 Цыганов А. Р., Сучкова И. В., Ковалева И. В. Биохимия. Практикум; ИВЦ Минфина - Москва, 2007. - 52 c 4Страйер. , Л. Биохимия. Том 1 / Л. Страйер. - М.: Мир, 2015. - 23 c 5Страйер. , Л. Биохимия. Том 1 / Л. Страйер. - М.: Мир, 2015. - 25 c 6 Башкин, В. Н. Биогеохимия / В.Н. Башкин. - Москва: Машиностроение, 2016. - 124 c 7 Башкин, В. Н. Биогеохимия / В.Н. Башкин. - Москва: Машиностроение, 2016. - 127 c 8 Химия белка. - М.: Мир, 2017. - 40 c 9 Химия белка. - М.: Мир, 2017. - 46 c |
