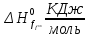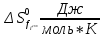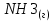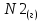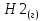Курсовая работа по дисциплине Общая химическая технология Тема Синтез аммиака в производстве аммиака
 Скачать 1.46 Mb. Скачать 1.46 Mb.
|
3.1 Термодинамический анализПроведем термодинамический анализ для реакции синтеза аммиака в производстве аммиака, ключевым компонентом реакции будет являться аммиак. 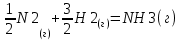 Таблица 3.1. - Термодинамические параметры веществ[1].
Найдем изменение энтальпии реакции при стандартных условиях: 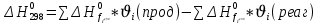 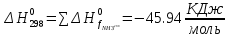 Определим изменение энтропии реакции: 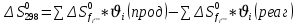 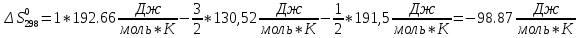 Определим изменение энергии Гиббса: 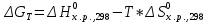 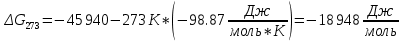 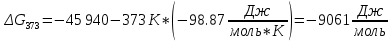 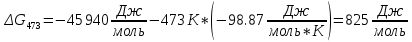 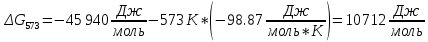 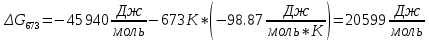 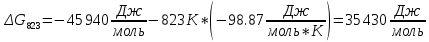 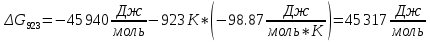 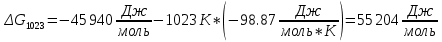 На основании полученных данных, построим график, отражающий зависимость  (рис. 1). (рис. 1).Рис. 1 – Зависимость 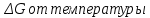 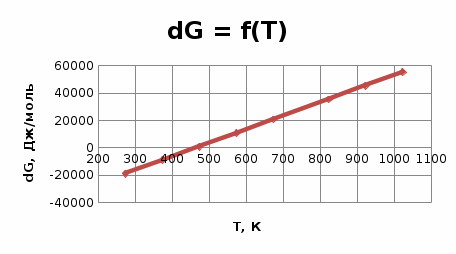 Реакция обратима на интервале температур, поэтому рассчитаем температуру инверсии. 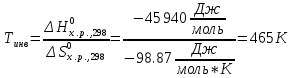 Из графика очевидно, что при увеличением температуры 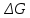 также увеличивается. Значит, при повышении температуры равновесие сдвигается в сторону обратной реакции, а при понижении температуры – в сторону прямой. также увеличивается. Значит, при повышении температуры равновесие сдвигается в сторону обратной реакции, а при понижении температуры – в сторону прямой.3.2 Принцип Ле-ШательеСинтез аммиака протекает в газовой фазе, с уменьшением ее объема в результате прямой реакции. В таком случае, по принципу Ле-Шателье, увеличение давления приведет к сдвигу равновесия реакции в сторону продуктов, а уменьшение давления – в сторону реагентов. По принципу Ле-Шателье для сдвига равновесия реакции синтеза аммиака в сторону продуктов, необходимо в равновесной газовой смеси увеличить концентрацию азота и водорода или уменьшить концентрацию аммиака. Последнее можно осуществить на практике: после образования из азота и водорода некоторого количества аммиака, газовую смесь необходимо как можно более полно освободить от аммиака. 3.3 Кинетический анализРеакция синтеза аммиака, является гетерогенной каталитической реакцией, так как протекает между газообразными веществами на поверхности твердого катализатора, поэтому её механизм будет соответствовать данным стадиям: перенос газообразных реагирующих веществ к поверхности катализатора, адсорбция реакция на поверхности десорбция продукта реакции с поверхности перенос продукта реакции от поверхности в объем газовой фазы. Адсорбция при гетерогенно-газовых каталитических реакциях характеризуется, относительно высокой энергией активации и сопровождается выделением значительного количества тепла. Данная адсорбция называется активированной. Скорость суммарного процесса будет определять лимитирующая стадия. Какая из них будет медленной, зависит от свойств системы и значений внешних параметров. Иногда скорость каталитического процесса определяют стадии переноса газообразных веществ к поверхности и продуктов реакции от поверхности. К примеру, если смесь в газовой фазе проходит через слой катализатора с малой линейной скоростью, то перенос веществ к поверхности катализатора совершается медленнее и может ограничивать скорость суммарного процесса — реакция характеризуется малым значением энергии активации и незначительным увеличением скорости реакции с повышением температуры. Однако чаще всего скорость реакции ограничивается скоростью адсорбции, десорбции или реакции на поверхности. В случае с синтезом аммиака, с помощью многочисленных исследований было установлено, что лимитирующей стадией является адсорбция азота. На основании литературных данных, механизм процесса синтеза аммиака состоит из последующих этапов[2]: Диффузия азота и водорода на поверхность катализатора из газовой фазы через пограничный слой Диффузия из пор kat в реакционный центр Адсорбция молекул азота и водорода на поверхности kat Химическое взаимодействие азота и водорода Десорбция аммиака с поверхности Транспортировка аммиака через систему пор обратно на поверхность Диффузия аммиака в газовый объем В виде химического процесса это будет выглядеть так: 1. N2+↔ N2⁕ 2. N2⁕ + ⁕↔ 2N⁕ 3.N⁕ +H⁕ ↔ NH⁕ 4. NH⁕ +H⁕ ↔ NH2⁕ + ⁕ 5. NH2⁕ +H⁕ ↔ NH3⁕ + ⁕ 6.NH3⁕↔ NH3+ ⁕ 7.H2+ 2⁕↔ 2H⁕ Стадии каталитического синтеза аммиака следующие. Азот и водород диффундируют из объема газовой фазы к поверхности катализатора, где протекает активированная адсорбция обоих газов. Воздействие условий, адсорбция азота на поверхности катализатора зависит от микроскопической структуры поверхности катализатора. Железо имеет разные кристаллические поверхности, реакционная способность которых сильно различается. Далее адсорбированный азот вступает во взаимодействие с адсорбированным или газообразным водородом, причем последовательно образуются имид NH, амидNH2и аммиак NH3. Последний десорбируется с поверхности и поступает в объем газовой фазы. Из всех перечисленных стадий, одна является лимитирующей, то есть определяющей скорость суммарного процесса. Очевидно, что первые и последние два этапа (транспортировка и диффузия) будут протекать быстрее, чем адсорбция и десорбция, по причине оболочечной структуры катализатора. Кинетика синтеза аммиака на железных катализаторах изучалась многими авторами. По общему признанию, лимитирующей стадией процесса является адсорбция молекул азота на поверхности катализатора. М. И. Темкин и В. М. Пыжев предложили уравнение для скорости синтеза аммиака на большинстве известных катализаторов: 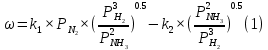 , где , гдеk1, k2 – константы скорости прямой и обратной реакции; PN2, PH2, PNH3 – парциальные давления компонентов; α – коэффициент, характеризующий степень покрытия поверхности катализатора азотом, для железного kat величина составляет 0,5. Зависимость влияния температуры на константы скоростей прямой и обратной реакции k1 и k2 выражает закон Аррениуса: 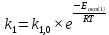 ; ; 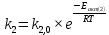 ; ;где Eакт – энергия, активации прямой и обратной реакции; R – универсальная газовая постоянная = 8,31⸱103; k1,0 и k2,0 - константы. 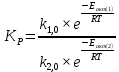 – константа равновесия синтеза аммиака – константа равновесия синтеза аммиакаРеакция синтеза аммиака экзотермическая из чего следует, что энергия активации для прямой реакции меньше, чем для обратной. По выражениям констант скоростей можно сделать вывод, что с увеличением температуры они будут возрастать, а при понижении температуры - уменьшаться. По уравнению Аррениуса было выведено уравнение для расчета оптимальной температуры: 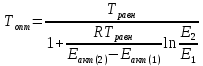 Имеется две характерные точки: оптимальная и равновесная температура. Оптимальная температура - температура, при которой скорость максимальна. Химическое равновесие - состояние, при котором скорость прямой и обратной реакции равны. (Рис. 2) Рис.2. - Зависимость выхода аммиака от температуры при различных объёмных скоростях азотоводородной смеси (Р = 30 МПа) 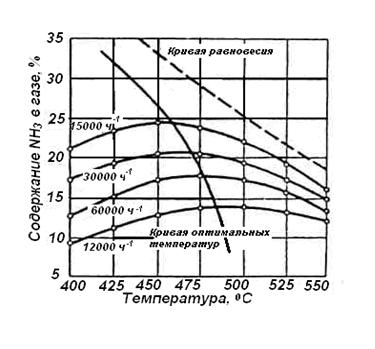 Из рисунка видно следующее: • с увеличением объёмной скорости (то же самое, что «с уменьшением времени соприкосновения газа с катализатором») выход аммиака уменьшается; • для каждой объёмной скорости имеется оптимальная температура, которой соответствует максимальный выход аммиака. Сначала, когда концентрации исходных веществ велики, скорость прямой реакции большая по сравнению с обратной, содержание аммиака в газовой смеси растёт, кроме того, увеличение температуры также способствует этому. [4] Можно подвести итог, что для начального содержания исходных веществ повышение температуры будет влиять положительно на скорость реакции, а при дальнейшем увеличении содержания аммиака в смеси, температуру необходимо уменьшать, чтобы скорость реакции не уменьшалась. По уравнению Тёмкина-Пыжова (1) можно сделать вывод: На скорость протекания синтеза аммиака повышение температуры будет влиять положительно, так как k1иk2 будут увеличиваться, и Kр тоже будет расти, а понижение температуры – отрицательно, так как Kр будет уменьшатьсяи скорость соответственно тоже. Разложим уравнение Тёмкина-Пыжева (1) на две части, для прямой и обратной реакции соответственно: 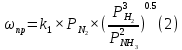 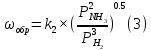 Мы видим, что для прямой реакции с ростом давления исходных реагентов (PH2, PN2) скорость будет увеличиваться, с уменьшением давления наоборот – снижаться. Для обратной реакции с увеличением давления исходных веществ (PH2), скорость будет уменьшаться, а с увеличением давления продукта (PNH3), скорость будет увеличиваться. Поэтому обратимся к закону Дальтона, чтобы сделать вывод о влиянии общего давления на систему: 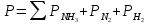 Повышение парциального давления исходных реагентов увеличивает общее давление, что благоприятно сказывается наскорости реакции синтеза аммиака, а понижение давления реагентов будет уменьшать общее давление, что отрицательно отразится на скорости реакции. Преобразуем уравнения скорости (2) и (3): 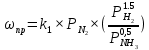 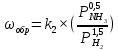 Скорость реакции зависит от концентрации исходных веществ и по мере протекания процесса исходные вещества расходуются, и их концентрация уменьшается, поэтому скорость прямой реакции тоже уменьшается. С дальнейшим протеканием процесса будет увеличивается скорость обратной реакции, потому что будет происходить увеличение концентрация конечных веществ. Поэтому при увеличении концентрации N2, скорость процесса будет увеличиваться, потому что PN2 тоже будет увеличиваться. Если мы будем увеличивать H2, то 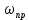 будет увеличиваться, что видно по уравнению, а будет увеличиваться, что видно по уравнению, а 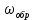 будет уменьшаться, значит общая скорость процесса будет увеличиваться. При увеличении содержания NH3скорость прямой реакции будет уменьшаться, а обратной реакции – увеличиваться. будет уменьшаться, значит общая скорость процесса будет увеличиваться. При увеличении содержания NH3скорость прямой реакции будет уменьшаться, а обратной реакции – увеличиваться.Тогда для увеличения скорости можно увеличить содержание исходных продуктов, либо уменьшить начальное содержание аммиака и инертных веществ. Рассмотрим, как катализаторы будут влиять на кинетику реакции. Катализаторы используются для ускорения процесса при низких температурах, поэтому, чем катализатор будет активнее, тем температура, при которой с оптимальной скоростью можно проводить реакцию будет ниже. В процессе синтеза аммиака применяются железные катализаторы с добавлением промоторов, для повышения его активности, потому что чистое железо быстро теряет свою активность. Промоторы в промышленном использовании бывают двух видов: 1. Структурообразующие (Al2O3, MgO, SiO2 и др.) 2. Модифицирующие (K2O, CaO и др.) Каталитическими действиями они не обладают, но улучшают активность и селективность катализаторов. Катализатор, применяемый для синтеза аммиака, содержит 90-93% Fe3O4 и 7-10% промоторов. Один из которых K2O, он, повышая удельную каталитическую активность поверхности, снижает термостойкость и устойчивость к кислотосодержащим ядам. Содержание Al2O3 увеличивает активную поверхность, термоустойчивость и стойкость к кислородосодержащим ядам, которые снижают активность катализатора. Селективность характеризуется избирательностью катализатора, то есть если мы имеем основную реакцию и побочные, то катализатор не должен влиять на побочные. Для синтеза аммиака побочных реакций не имеется, значит, селективность катализатора не будет играть важную роль. В случае синтеза аммиака ядами являются инертные вещества, такие как аргон, гелий, они снижают общее давление и уменьшают реакцию протекания процесса. Если применять гранулированный катализатор будет обеспечиваться более равномерная структура слоя и равномерное распределение газового потока, а мелкозернистый катализатор в свою очередь уменьшает диффузионное торможение, увеличивая выход аммиака. Для синтеза аммиака выпускают два вида катализатора CA-1(окисленный) по ОСТ 113-03-71-78 и СА-2(восстановленный) по ТУ-6-03-394-79в гранулированном и дробленом виде [3]: Таблица 3.2 – Характеристики катализаторов
В промышленных каталитических реакторах процесс синтеза аммиака протекаетприменяющихсяподлинезоныкатализаторатемпературе, объемнойскорости,составегазаит.д.,чтоприводиткизменению химического состава и строения поверхности катализатора и вследствие этого – активности катализатора. В окисленном состоянии катализатор содержит 90-93G% магнетита Fe 3 O 4 c некоторымизбыткомFeOпосравнениюсостехиометрическим,7-10G% промотирующих(Al 2 O 3 ,К 2 О,СаО)ипримесных(SiO 2 идр.)соединений. Качество катализатора гарантируется единым отраслевым стандартом. Катализатор синтеза аммиака выпускают двух марок СА-1 (окисленный) и СА-1В (восстановленный), в гранулированном и дробленном виде. Основныефизическиесвойствакатализаторов:содержание нерасколотыхгранул,коэффициентокруглости,насыпнаяплотность, прочность гранул, удельная поверхность, общая пористость, Gпорозность слоя Призагрузкекатализаторахвколоннунеобходимоучитывать конструктивныеособенностиколонны,допустимоегидравлическое сопротивлениесистемы,формучастицкатализатора.Приприменении гранулированного катализатора обеспечивается более равномерная структура слояиболееравномерноераспределениегазовогопотока.Использование мелкозернистогокатализаторапозволяетуменьшитьдиффузионное торможениеиувеличитьвыходаммиака,однакоприэтомувеличивается гидравлическое сопротивление слоя. Восстановлениекатализатораипускколонныприеезагрузкетолько окисленным катализатором продолжается 7-10 суток. Восстановленныйкатализаторобладаетпирофорнымисвойствами (самовозгорается на воздухе). Чтобы предотвратить самовозгорание проводят пассивацию (окисление поверхности катализатора) кислородом воздуха, дозируемого впотоказота,которыйпропускаютчерезкатализатор с объемнойскоростьюдо1000час -1 притемпературевзонепассивациине выше 150 о С В промышленных каталитических реакторах процесс синтеза аммиака протекаетприменяющихсяподлинезоныкатализаторатемпературе, объемнойскорости,составегазаит.д.,чтоприводиткизменению химического состава и строения поверхности катализатора и вследствие этого – активности катализатора. В окисленном состоянии катализатор содержит 90-93G% магнетита Fe 3 O 4 c некоторымизбыткомFeOпосравнениюсостехиометрическим,7-10G% промотирующих(Al 2 O 3 ,К 2 О,СаО)ипримесных(SiO 2 идр.)соединений. Качество катализатора гарантируется единым отраслевым стандартом. Катализатор синтеза аммиака выпускают двух марок СА-1 (окисленный) и СА-1В (восстановленный), в гранулированном и дробленном виде. Основныефизическиесвойствакатализаторов:содержание нерасколотыхгранул,коэффициентокруглости,насыпнаяплотность, прочность гранул, удельная поверхность, общая пористость, Gпорозность слоя Призагрузкекатализаторахвколоннунеобходимоучитывать конструктивныеособенностиколонны,допустимоегидравлическое сопротивлениесистемы,формучастицкатализатора.Приприменении гранулированного катализатора обеспечивается более равномерная структура слояиболееравномерноераспределениегазовогопотока.Использование мелкозернистогокатализаторапозволяетуменьшитьдиффузионное торможениеиувеличитьвыходаммиака,однакоприэтомувеличивается гидравлическое сопротивление слоя. Восстановлениекатализатораипускколонныприеезагрузкетолько окисленным катализатором продолжается 7-10 суток. Восстановленныйкатализаторобладаетпирофорнымисвойствами (самовозгорается на воздухе). Чтобы предотвратить самовозгорание проводят пассивацию (окисление поверхности катализатора) кислородом воздуха, дозируемого впотоказота,которыйпропускаютчерезкатализатор с объемнойскоростьюдо1000час -1 притемпературевзонепассивациине выше 150 о С При разработке катализатора, используемого в промышленности следует учитыватьдлительностьслужбыкатализатора(нескольколет)вусловиях некоторой нестационарности технологического процесса. В промышленных каталитических реакторах процесс синтеза аммиака протекаетприменяющихсяподлинезоныкатализаторатемпературе, объемнойскорости,составегазаит.д.,чтоприводиткизменению химического состава и строения поверхности катализатора и вследствие этого – активности катализатора. В окисленном состоянии катализатор содержит 90-93G% магнетита Fe 3 O 4 c некоторымизбыткомFeOпосравнениюсостехиометрическим,7-10G% промотирующих(Al 2 O 3 ,К 2 О,СаО)ипримесных(SiO 2 идр.)соединений. Качество катализатора гарантируется единым отраслевым стандартом. Катализатор синтеза аммиака выпускают двух марок СА-1 (окисленный) и СА-1В (восстановленный), в гранулированном и дробленном виде. Основныефизическиесвойствакатализаторов:содержание нерасколотыхгранул,коэффициентокруглости,насыпнаяплотность, прочность гранул, удельная поверхность, общая пористость, Gпорозность слоя Призагрузкекатализаторахвколоннунеобходимоучитывать конструктивныеособенностиколонны,допустимоегидравлическое сопротивлениесистемы,формучастицкатализатора.Приприменении гранулированного катализатора обеспечивается более равномерная структура слояиболееравномерноераспределениегазовогопотока.Использование мелкозернистогокатализаторапозволяетуменьшитьдиффузионное торможениеиувеличитьвыходаммиака,однакоприэтомувеличивается гидравлическое сопротивление слоя. Восстановлениекатализатораипускколонныприеезагрузкетолько окисленным катализатором продолжается 7-10 суток. Восстановленныйкатализаторобладаетпирофорнымисвойствами (самовозгорается на воздухе). Чтобы предотвратить самовозгорание проводят пассивацию (окисление поверхности катализатора) кислородом воздуха, дозируемого впотоказота,которыйпропускаютчерезкатализатор с объемнойскоростьюдо1000час -1 притемпературевзонепассивациине выше 150 о С. При разработке катализатора, используемого в промышленности следует учитыватьдлительностьслужбыкатализатора(нескольколет)вусловиях некоторой нестационарности технологического процесса. В промышленных каталитических реакторах процесс синтеза аммиака протекаетприменяющихсяподлинезоныкатализаторатемпературе, объемнойскорости,составегазаит.д.,чтоприводиткизменению химического состава и строения поверхности катализатора и вследствие этого – активности катализатора. При разработке катализатора, используемого в промышленности следует учитыватьдлительностьслужбыкатализатора(нескольколет)вусловиях некоторой нестационарности технологического процесса. В промышленных каталитических реакторах процесс синтеза аммиака протекаетприменяющихсяподлинезоныкатализаторатемпературе, объемнойскорости,составегазаит.д.,чтоприводиткизменению химического состава и строения поверхности катализатора и вследствие этого – активности катализатора. При разработке катализатора, используемого в промышленности следует учитыватьдлительностьслужбыкатализатора(нескольколет)вусловиях некоторой нестационарности технологического процесса Для того, чтобы катализатор был эффективным, он должен обладать высокими селективностью, термостойкостью и износоустойчивостью, его зерна должны быть прочными, а также обладать стойкостью к действию ядов. При правильном соотношении промоторов катализатор будет иметь большую активную поверхность. |