Курсовая работа по дисциплине Общая химическая технология Тема Синтез аммиака в производстве аммиака
 Скачать 1.46 Mb. Скачать 1.46 Mb.
|
6.1 Расчет материального балансаПроводить расчет будем на 1000 Нм3/ч газовой смеси. Химическая реакция:N2(г)+3 H2(г)=2NH3(г) Воспользуемся литературными данными, чтобы определить количество веществ, которые будут на входе в колонну синтеза и расчитаем степень превращения, чтобы полученный материальный баланс совпал с литературными данными на выходе. Таблица 6.1 – Литературные данные материального баланса
Расчеты проводились с использованием программы Excel из пакета MS Office 2016. 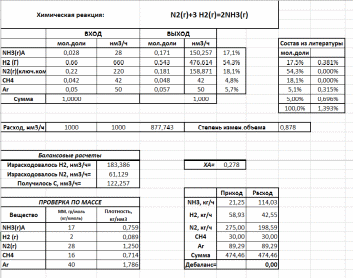 Таблица 6.2 – Результаты материального баланса
По итогам материального баланса мольное содержание сырья на выходе практически совпало с литературным. 6.2 Расчет теплового балансаНа основе материального баланса рассчитаем тепловой. Так как наша реакция является экзотермической и протекает в адиабатном реакторе, то для нас будет актуально данное уравнение: QФИЗ.ВХ + QХР = QФИЗ.ВЫХ + QПОТЕРЬ. Воспользуемся температурой, взятой из литературных данных, на входе: 128⁰С и на выходе 330⁰С.Полученная температура в тепловом балансе на выходе должна сойтись с литературной. Воспользуемся данными из таблицы 2.2. Рассчитаем в Exсel теплоемкости для всех веществ, а так же теплоты потоков для составления теплового баланса. 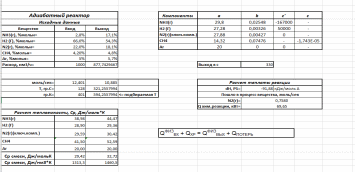 Полученные данные приведены ниже: Таблица 6.3 – Результаты теплоемкости
Таблица 6.4 – Результаты теплового баланса
Полученная Твых= 321,25 С Расходные коэффициенты: По газовой смеси – 5,114 кг/кг Для использования вторичных энергоресурсов можно осуществить рекуперацию тепла отходящих потоков. Для этого на проиводстве применяется ряд теплообменников. Например, тепло газа, вышедшего из колонны используется для газа, входящего в колонну. В производстве аммиака образуются технологические потоки газа, нагретые до высокой температуры. Это дымовые и конвертированные газы после конверсии метана, синтез-газ после метанирования и др. Их энергию с помощью теплообменников можно использовать для подогрева теплоносителей или азотоводородной смеси. 7. Экологическая оценка производства, отходы производства, их утилизация, ПДК Основные экологические проблемы производства аммиака - это газообразные выбросы аммиака, оксидов углерода, дымовых газов. Выбросы происходят из-за следующих процессов: 1) конверсия СО при двух температурах в присутствии катализатора оксида железа с образованием CO2; 2) поглощение CO2 в скруббере горячим раствором карбоната калия, моноэтаноламина (МЭА) или других веществ; На стадии абсорбции СО2 поглощается растворителем в насадочных колоннах и газ направляется на дальнейшую переработку. Насыщенный СО2 раствор подается на регенерацию; 3) конверсия остаточного CO2 в метан в присутствии никелевых катализаторов с целью очистки синтез-газа. При отгонке конденсата выбросы CO2 происходят в меньшем количестве. Обычно на производстве углекислый газ служит сырьем для синтеза других веществ (карбамид, сухой лёд) т.к. это достаточно дорогое вещество для сброса в атмосферу. Монооксид углерода СО (угарный газ) чрезвычайно ядовит. СО вдыхается вместе с воздухом и поступает в кровь, где конкурирует с кислородом за молекулы гемоглобина. Чрезвычайная ядовитость СО, отсутствие у него цвета и запаха, а также очень слабое поглощение его активированным углем обычного противогаза делают этот газ особенно опасным Диоксид углерода СО2. Повышенная концентрация углекислого газа влияет на здоровье человека, поскольку под его воздействием снижается рН крови, что ведет к состоянию перевозбуждения, вызывая сонливость и состояние беспокойства. Поскольку производство аммиака включает процессы, идущие при высокой температуре, то для ее поддержания необходимо использовать большое количество топлива, в результате чего образуются дымовые газы. 90-95 % (об.) дымовых газов производства аммиака составляет двуокись углерода. Кроме этого в дымовом газе содержится диоксид азота, оксид углерода, сернистый ангидрид. Проблема снижения выбросов решается комплексно: увеличивается доля крупнотоннажных производств, совершенствуется и оптимизируется технологический процесс, внедряется высокоинтенсивное оборудование, предлагаются более эффективные катализаторы, применяются новые способы очистки газов, разрабатываются совмещенные процессы и производства, оцениваются новые сырьевые источники. Проведение комплексных мероприятий по улучшению экологического влияния производства аммиака позволяет достичь хороших показателей и минимизировать ущерб, наносимый природе. Таблица 7.1 – ПДК основных отходов
Заключение и выводы В данной курсовой работе были подробно рассмотрены теоретические основы процесса синтеза аммиака: выбраны и обоснованы способы производства, источники сырья и энергоресурсов. С помощью термодинамического и кинетического анализов установлены оптимальные параметры производства. Благодаря рассчитанным материальным и тепловым балансам была подобрана степень превращения исходных веществ, расходные нормы и температура на выходе из реактора. Благодаря курсовой работе мы научились рассматривать процесс проектирования химического производства как совокупность отдельных стадий, и поняли, что синтез аммиака — это лишь отдельная часть полноценного производства аммиака. Именно на стадии синтеза происходит получение основного продукта, но сырье для него получают на предыдущих. И, исходя из этого, нами были тщательно подбраны аппарат и параметры производства для наиболее энергоэффективного и экологически безопасного химического процесса. Но, несмотря на подобранные нами агрегаты, экологичность процесса все еще нуждается в доработке, тем более учитывая актуальность этой темы в 2021 году. Так как синтез аммиака является важнейшим звеном в химической промышленности, с помощью него можно получить различные органические и неорганические азотосодержащие удобрения. Список используемой литературы «Краткий справочник физико-химических величин» под редакцией К.П. Мищенко и А.А. Равделя, Л.: Химия, 1974 г. – 200 стр. Кутепов А.М., Бондарева Т.И., Беренгартен М.Г. - Общая химическая технология. (2004, Академкнига).pdf – 390 стр. Справочник азотчика: Физико-химические свойства газов и жидкостей. Производство технологических газов. Очистка технологических газов. Синтез аммиака. – 2-е изд., перераб., М: Химия, 1986 г. – 512 с., ил. – 355 стр. Шевченко, Т. М. Химическая технология неорганических веществ. Основные производства: курс лекций / Т. М. Шевченко, А. В. Тихомирова; Кузбас. гос. техн. ун-т. – Кемерово, 2012. – 198с. Хабарова Е.И., Панова С.А. Экология в таблицах. Справочное пособие. М., Дрофа, 1999 . В.С. Бесков, B. Флокк. Моделирование каталитических процессов и реакторов. - М.: Химия, 1991. - 256 с. Иоффе И. Л. Проектирование процессов и аппаратов химической технологии: учебник для техникумов / И. Л. Иоффе. Л.: Химия, 1991. 352 с. Теплофизические свойства аммиака. Голубев И. Ф., и др. М.: Издательство стандартов, 1978, 264 с. [https://revolution.allbest.ru/chemistry/00927199_0.html] - Экологические аспекты производства аммиака Справочное руководство для производства аммиака и водорода / под ред. В. П. Семенова. - Д.: Химия, 1973. - 248 с. Вредные вещества в промышленности, том 1-3. Под ред. Н. В. Лазарева и Э.Н. Левиной, Л., Химия, 1977, т.3, с. 115-134. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
