Курсовая Масалова София (1). Курсовая работа по дисциплине основы научных исследований Название Электрохимические методы исследования катодных и анодных материалов
 Скачать 3.27 Mb. Скачать 3.27 Mb.
|
|
Санкт-Петербургский Государственный Технологический Институт (Технический Университет) Курсовая работа по дисциплине «ОСНОВЫ НАУЧНЫХ ИССЛЕДОВАНИЙ» Название: «Электрохимические методы исследования катодных и анодных материалов» Выполнила: студентка группы №1210 Масалова София Факультет: химии веществ и материалов Кафедра: физической химии Санкт – Петербург 2023 Содержание Цели и задачи работы………………………………………………………………………3 Литературный обзор……………………………………………………………………….4 2.1. Химические источники тока…………….…………………………………………....4 2.2. Литий-ионный аккумуляторы……………...…………………………………………4 2.3. Хронопотенциометрия…………………………………………...……………...……5 Экспериментальная часть………………………………………………………………….7 1.Методика изготовления электродов…………………………………………………….7 2.Методика сборки дисковых макетов…...……………………………………………….9 3. Методика проведения электрохимических испытаний…….………………...………10 4. Результаты измерений…………………………………………………………………..12 Выводы…………………………….……………………………………………………….13 Список литературы………………………………………………………………………..14 Цели и задачи работы Цель: Освоение методики хронопотенциометрических измерений для диагностики электродных материалов литий-ионных аккумуляторов. Задачи: -изготовление графитовых электродов по намазной технологии; -сборка двух электродных ячеек; - проведение гальваностастических измерений. Литературный обзор 2.1. Химические источники тока (ХИТ) Химические источники тока (ХИТ) – это устройства, в которых энергия ОВР (ОВР (окислиительно – восстановительные реакции) - встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ (или ионов веществ), реализующиеся путём перераспределения электронов между атомом-окислителем (акцептором) и атомом-восстановителем) преобразуется непосредственно в электрическую. Химические источники тока подразделяются на три вида: первичные, вторичные и топливные элементы[3]. Первичные, или гальванические элементы. После разряда, когда израсходованы реагенты на электродах (активные массы), они больше не пригодны к употреблению (не заряжаются). Пример – всем известные марганцево-цинковые элементы («батарейки»). Вторичные ХИТ или аккумуляторы, то есть топливные элементы - это химические источники тока, которые допускают многократное использование. Будучи разряженными, они способны восстанавливаться (заряжаться) от внешнего источника постоянного тока[1]. 2.2. Литий-ионный аккумуляторы (ЛИА) Пример реакции в литий-ионном аккумуляторе 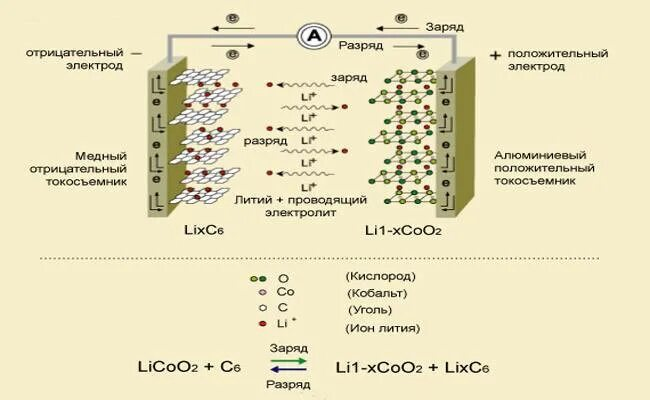 Рисунок 1 Li+ 6C + e− → LiC6 В процессе зарядки ионы лития из электролита восстанавливаются и внедряются в структуру графита с образованием соединения включения состава LiC6[5]. 2.3. Хронопотенциометрия Сущность хронопотенциометрии состоит в снятии кривых зависимости потенциала электрода от времени при прохождении через электролитическую ячейку постоянного тока заданной величины[6]. Изменение потенциала происходит в соответствии с уравнением Нернста: E= E^0+RT/zF * ln aox/ared, где E – реальный потенциал E^0 – стандартный потенциал R – универсальная газовая постоянная (8,31 Дж/ (моль*К)) T – температура Z – число электронов, участвующих в процессе F – постоянная Фарадея (9,6 Кл/моль) aox – активность окисленной формы ared – активность восстановленной формы Закон электролиза Фарадея m = kq k – электрохимический эквивалент вещества [k] = кг/Кл  Рисунок 2 Хронопотенциометрия позволяет решать следующие задачи электрохимической кинетики: 1. Определение коэффициентов диффузии. 2. Определение электродной поляризации и механизма электродных ре- акций. 3. Определение констант скоростей химических реакций, связанных с электродными процессами. 4. Определение концентрации разряжающихся ионов[4]. Электрохимическая ячейка содержит рабочий - индикаторный и вспомогательный электроды и электрод сравнения, относительно которого измеряется потенциал рабочего электрода[2]. Экспериментатора обычно интересует только процесс, протекающий на индикаторном электроде. В общем виде этот процесс может быть представлен реакцией: Экспериментальная часть 1.Методика изготовления электродов Производство электродов – узкоспециализированный, сложный технологический процесс. Они необходимы во многих отраслях и используются в больших масштабах. Рассмотрим, как делают электроды, каковы особенности их изготовления. Процесс приготовления активной массы является первоначальным этапом в ходе изготовления электродов. Суть процесса заключается в растворении связующего (поливинилиденфторид Solef 5130) в растворителе (N-метилпирролидон). К полученному раствору добавляется активная масса (в случае анодов – графит, кремний, катоды – LiCoO2, LiMn2O4), для улучшения электропроводности активного материала – соответствующая проводящая добавка (сажа). Полученная масса наносится на токосъемник с помощью намазочной машины и приспособления DrBlade, медную фольгу в случае анодов, алюминиевая – катоды. Задаваемая толщина намазки (100, 200 мкм) регулируетя опусканием/поднятием лезвия Dr. Blade при помощи двух микрометрических винтов.  Рисунок 3 – намазочная машина Заготовка электродов сушится в течение 15 минут в сушильном шкафу с усиленной конвекцией при температуре 800С или 70.  Рисунок 4 – Сушильный шкаф Высушенная фольга с намазкой прокатывается на прокаточном станке для подпрессовки активной массы и упорядочения структуры поверхности.  Рисунок 5 - Прокаточные валики Вырубка электродов заданного диаметра (15 мм) производится с помощью устройства для вырубки дисков со сменным вырубным штампом. Сепаратор вырубался аналогично.  Рисунок 6 - Устройство для вырубки дисков со сменным вырубным штампом Полученные электроды сушатся в течение 10 часов под вакуумом при температуре 1100С. Каждый электрод взвешивается на аналитических весах. maк = 2% сажи + 3% связующего +95% = 9,7 мг. mэл-да – 33,2 мг. 2.Методика сборки дисковых макетов Сборка макетов осуществляется в лаборатории для работы в инертной атмосфере, рисунок 6. Стандартной характеристикой OmniLab является способность достигать и поддерживать уровень кислорода и влажности 1ч./млн. Газоочиститель удаляет кислород и следы загрязнений влагой в герметичной среде перчаточного бокса. Система OmniLab оборудована газоочистителем и ручными циркуляционными клапанами, используемыми для изоляции атмосферы бокса от очистителя. Система приборов включает сенсорный экран для удобного наблюдения и контроля давления в боксе, системы продувки, циркуляционной воздуходувки и регенерации очистителя. Простота и легкость работы с сенсорным экраном позволяет новым пользователям быстро подстраиваться под скорость процесса. 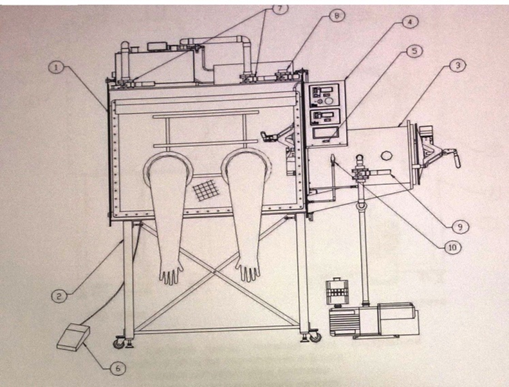 Рисунок 7 - Вид спереди, система OmniLab, модель 2 с отверстиями перчаточного бокса 101975.1- перчаточный бокс из нержавеющей стали; 2 – стенд бокса; 3 – формакера; 4 – панель управления (с сенсорным экраном и дополнительными анализаторами кислорода и влажности) 5 – системный выключатель; 6 – педальный переключатель давления; 7 – циркуляционные клапаны бокса; 8 – клапаны продувки бокса; 9 – клапаны вакуумирования форкамеры; 10 – клапан пополнения форкамеры. Корпус дискового макета СR2032 состоит из следующих деталей: крышки, днища с запрессованной изолирующей прокладкой, пружины и металлической прокладки.  Рисунок 8 - Детали дискового корпуса макета На днище напрессована прокладка, которая изолирует его и крышку и обеспечивает надежную герметизацию корпуса при его завальцовке. 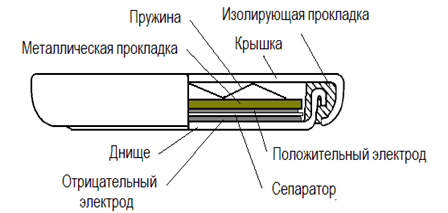 Рисунок 9 - Конструкция дискового макета аккумулятора В днище вкладывается отрицательный электрод из металлического лития. Затем в корпус помещается сепаратор (полипропилен). После этого заливается электролит Tinci TC–E18.Затем помещается исследуемый электрод. Далее - прокладка, прижимная пружина и крышка. Затем корпус завальцовывался на ручной завальцовочной машине. 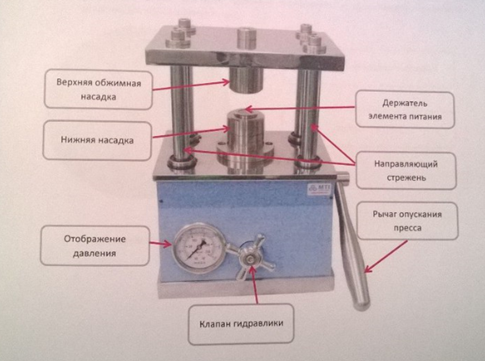 Рисунок 10 - Гидравлический ручной аккумуляторный блок CHY-110. Комплект завальцовывающих насадок подходит для всех дисковых элементов питания серии СR2OXX, таких как CR2032, CR2025, CR2016. Перед испытаниями необходимо проверить наличие короткого замыкания и замерить НРЦ (напряжение разомкнутой цепи) макета. При наличии изменения НРЦ во времени нужно дать макету пропитаться электролитом в течение нескольких часов. 3.Методика проведения электрохимических испытаний Электрохимические испытания проводятся в двухэлектродных ячейках CR2032 с использованием зарядно-разрядного стенда CT-3008W-5V10mA (Neware) (рисунок 10). С помощью программного обеспечения задаются условия: количество циклов, ток заряда, ограничения по напряжению, емкости. Напряжение – 5 В.  Рисунок 11 - Зарядно-разрядный стенд CT-3008W-5V10mA Neware Измерения
M актив = 2% сажи + 3% связ + 95% = 9,7мг J1 = 40 мА/г; J2 = 20 мА/г; J3 = 10 мА/г, где J – ток заряда. I1 = m * J I1 = 9,7*10^-3 г * 40 мА/г = 0, 388 мА. I2 = 9,7*10^-3 г * 20 мА/г = 0, 194 мА. I3 = 9,7*10^-3 г * 10 мА/г = 0, 097 мА. 4.Результаты измерений 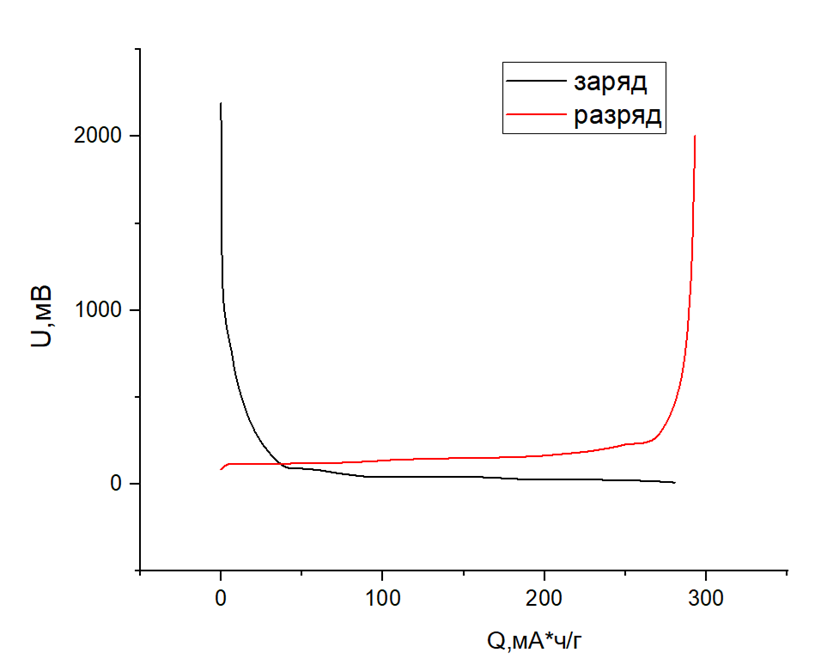 Рисунок 12 При заряде полуячейчки происходит понижение напряжения от 2000мВ до 10мВ, наблюдается постепенный набор емкости по оси X за счет образования соединения LiC6. То есть увеличивается количество электричества, которое мы внедрили. Li+ 6C + e− → LiC6 При разряде напряжение увеличивается от 0 до 2000, наблюдается постепенная потеря емкости, то есть уменьшается количество электричества, которое мы внедрили. Происходит обратная реакция. Таким образом, основной процесс внедрения, извлечения лития в графитовый электрод дисковым макете происходит в диапазоне напряжений от 10Мв до 2000Мв. Кулоновская эффективность исследуемого материала близка к 100%. Кулоновская эффективность – это отношение разрядной емкости к зарядной, то есть показывает степень заряда, который мы извлекли. Сколько внедрили – столько и извлекли. Выводы Освоена методика хронопотенциометрических (гальваностатических) измерений в технологии диагностики электродных материалов для ЛИА. -изготовление графитовых электродов по намазной технологии; -сборка двух электродных ячеек; - проведение гальваностастических ихмерений. Таким образом показано, что данный метод исследования позволяет определить значение набранной емкости количества электричества и извлеченного значения, кроме того они помогают нам определить диапазон напряжений, в которых происходит извлечение и внедрение лития. Список литературы Химические источники тока и защита металлов: курс лекций /В. Н. Соколов. – Екатеринбург: УрГУПС, 2015 – 203 с. Приборы и методы электрохимических измерений: метод. указания к практическим занятиям / В.И. Мишуров, Е.Н. Шубина. – Ростов-на-Дону: Донской гос. техн. ун-т, 2019. – 18 с. Химические источники тока. Справочник. – М.: МЭИ, 2003. – 740 с. А.П. Окатов. Химические источники тока. – М.: Государственное научно-техническое издательство химической литературы, 1948. – 340 с. Галия Тулибаева, О.Ярмоленко und А.Шестаков. Транспорт ионов лития в литиевых источниках тока. – М.: LAP Lambert Academic Publishing, 2011. – 144 с. Хронопотенциометрия [Текст] / М.С. Захаров, В.И. Баканов, В.В. Пнев. - Москва : Химия, 1978. - 199 с. : ил.; 20 см. - (Методы аналитической химии). |
