контрольная. 2.+Якияев. Курсовая работа по дисциплине Теория гидрометаллургических процессов
 Скачать 116.09 Kb. Скачать 116.09 Kb.
|
|
Министерство образования и науки Российской Федерации Федеральное государственное бюджетное образовательное учреждение высшего образования «Норильский государственный индустриальный институт» Кафедра металлургии цветных металлов КУРСОВАЯ РАБОТА по дисциплине «Теория гидрометаллургических процессов» Вариант 13 Выполнил: Якияев К.Н. Проверил: Рогова Л.И.  Норильск 2018 Норильск 2018Содержание Задание........................................................................................................................3 Введение.....................................................................................................................4 1 Кинетика выщелачивания......................................................................................8 1.1 Зависимость извлечения цинка в раствор от продолжительности процесса.8 1.2 Определение кинетических параметров процесса выщелачивания.............11 1.3 Определение времени достижения максимального извлечения цинка........16 1.4 Построение кинетической функции выщелачивания....................................17 Вывод по разделу.....................................................................................................18 2 Процесс выпаривания солевого раствора..........................................................19 2.1 Составление материального баланса...............................................................19 2.2 Расчет статей прихода и расхода тепла...........................................................21 2.3 Составление теплового баланса процесса.......................................................23 Вывод........................................................................................................................23 Заключение...............................................................................................................24 Список используемых источников........................................................................25 Задание Теоретический вопрос: «Наиболее распространенные растворители» 1 Кинетика процесса выщелачивания: - рассчитать кинетические характеристики выщелачивания; - определить продолжительность максимального извлечения из Т1 = 60, ˚С, концентрацией кислоты С1 = 40, г/л, и скорости вращения ω2 = 40 об/мин; - определить время достижения максимального извлечения при Т2 = 80, ˚С, с концентрацией кислоты С2 = 110, г/л, и скорости вращения ω1 = 200 об/мин; - определить время достижения максимального извлечения при Т3 = 100, ˚С, с концентрацией кислоты С3 = 70, г/л, и скорости вращения ω3 = 150 об/мин. 2 Рассчитать материальный и тепловой баланс процесса выпаривания, а также конечную концентрацию раствора, если в выпарной аппарат поступает греющий пар с влажностью 4,5%. выпариванию подвергают под атмосферным давлением 6% водный раствор нитрата натрия с температурой 95 0С. Производительность выпарного аппарата 3000 кг\ч. Конечная температура упаренного раствора составляет 102 0С. Тепловые потери в окружающую среду составляют 6100 кДж. Избыточное давление греющего насыщенного водяного пара, 2.0 кгс\см2. Площадь поверхности теплообмена в аппарате 52 м2, коэффициент теплопередачи 1060 Вт\(м2·К). Плотность исходного раствора 1108 г\дм3. · ВведениеНаиболее распространенные растворители Существуют несколько подходов к классификации растворителей. Для этого обычно выбирают какой-то один (реже несколько) характерный признак растворителей, оставляя в стороне другие. Таким образом, заранее нельзя ожидать безупречной классификации, так как любая из них будет условной. Поскольку вода является уникальным растворителем, то ее часто не включают ни в одну из классификаций, а оставляют как эталон для сравнения. Некоторые системы классификации основаны на физических свойствах растворителей. В их основу положены такие параметры, как диэлектрическая проницаемость, вязкость, температура кипения растворителей, а также дипольные моменты молекул растворителей. Растворы бывают: 1) ненасыщенные 2) насыщенные 3) пересыщенные. Ненасыщенным называется раствор, у которого граница растворимости не достигнута. Насыщенный раствор — это раствор, содержащий максимально возможное при определенных условиях количество вещества. Пересыщенный — это раствор, в котором содержится растворенного вещества больше того количества, что соответствует его нормальной растворимости при данных условиях. В аптечных условиях чаще готовят ненасыщенные растворы, реже — насыщенные и пересыщенные, так как они являются нестойкими системами. Кроме растворов твердых и жидких лекарственных средств, применяются еще некоторые растворы газов в воде, например, аммиака (10—25 %), хлористого водорода (25 %), формальдегида (36,5—37,5 %) и т. д. В аптеках эти концентрированные растворы в меру необходимости разводятся водой или другим растворителем до указанной в рецепте концентрации. Однако наиболее распространенные классификации основаны на химических свойствах растворителей. Перечислим некоторые из них. Классификация на неорганические и органические растворители. К числу неорганических растворителей относятся: вода - самый распространённый растворитель в природе, жидкий аммиак — хороший растворитель для щелочных металлов, производные фосфора, серы, солей, аминов. Большое значение имеют многочисленные органические растворители. Это, прежде всего, углеводороды и их галогенопроизводные, спирты, простые и сложные эфиры, кетоны, нитросоединения. 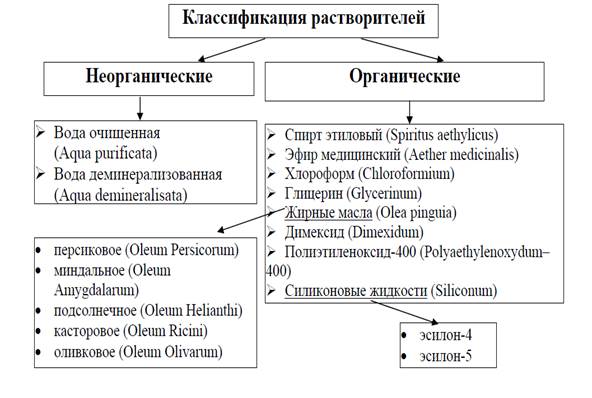 Рисунок 1 - Схема классификации растворителей Классификация на основе кислотно-основных свойств. Здесь особую роль отводят кислотно-основным представлениям Бренстеда-Лоури. Растворители делят на протонные и апротонные. К протонным относят растворители, которые проявляют протон-донорную или протон-акцепторную функцию по отношению к растворенному веществу. В зависимости от этого протонные растворители, в свою очередь, делят на протогенные (способные поставлять протоны), протофильные (способные принимать протоны) и амфипротонные (способные как поставлять, так и принимать протоны). Классификация по способности растворителей к образованию водородных связей, поскольку при взаимодействии ионов с молекулами растворителей важную роль играют именно эти связи. По этой классификации растворители разделены на пять групп. · К первой относятся жидкие растворители, способные к образованию объемной трехмерной сетки водородных связей (муравьиная кислота, гликоли и т.п.). · Ко второй относятся растворители, в которых образуется двумерная сетка водородных связей. Они, как правило, содержат одну группу ОН (фенолы, одноатомные спирты, одноосновные низшие карбоновые кислоты, за исключением муравьиной). · К третьей группе относятся растворители, которые имеют в своем составе электроотрицательные атомы азота, кислорода, серы, фтора, способные участвовать в образовании водородных связей (эфиры, тиоэфиры, амины, кетоны, альдегиды и др.). · К четвертой группе относятся растворители, молекулы которых имеют атом водорода, способный к образованию водородных связей, но не имеют атомов, которые могли бы быть акцепторами протонов (хлороформ, дихлорэтан и т.п.). · К пятой группе относятся растворители, молекулы которых при обычных условиях не способны к образованию водородных связей ни в качестве доноров, ни в качестве акцепторов протонов (углеводороды, четыреххлористый углерод и т.п.). Среди весьма большого количества жидкостей, используемых в фармацевтической технологии в качестве растворителей, наибольшее значение для аптечного способа изготовления лекарств имеют дистиллированная вода, вода для приготовления инъекций, деминерализованная вода, этиловый спирт, эфир, жирные масла, глицерин, вазелиновое масло. Новые синтетические растворители типа полиэтиленоксидов и пропиленгликоля, диметилсульфоксида, диметилформамида, бензилбензоата, этилолеата, нашедшие в последние два десятилетия весьма заметное распространение в заводском производстве лекарств, к сожалению, до сих пор практически не используются в условиях аптек. В зависимости от природы растворителя выделяют водные и неводные растворы [1] 1 Кинетика процесса выщелачивания Исходные данные для расчета кинетических параметров процесса выщелачивания цинкового огарка приведены в таблице 1 [2]. Таблица 1- Исходные данные для выполнения задания
1.1 Зависимости извлечения цинка от параметров процесса выщелачивания Основными параметрами, влияющими на извлечение для процесса выщелачивания являются: температура, концентрация и гидродинамическая обстановка в аппарате. Опытные данные зависимости извлечения от температуры приведены в таблице 2 [2].
По приведенным в таблице 2 данным строим графическую зависимость 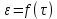 для температур 60 и 80 ˚С (рисунок 2). для температур 60 и 80 ˚С (рисунок 2).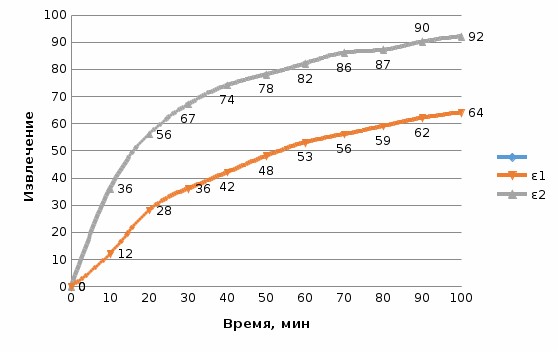 Рисунок 2 - Зависимость извлечения от температуры Из рисунка 2 видно, что температура оказывает существенное влияние на извлечение. С увеличением температуры извлечение цинка в раствор значительно увеличивается. Таблица 3 – Зависимость извлечения от концентрации кислоты (С1, С2) [2]
По приведенным данным в таблице 3 строим графическую зависимость 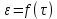 для концентрации кислот 40 и 110 г/л (рисунок 3). для концентрации кислот 40 и 110 г/л (рисунок 3).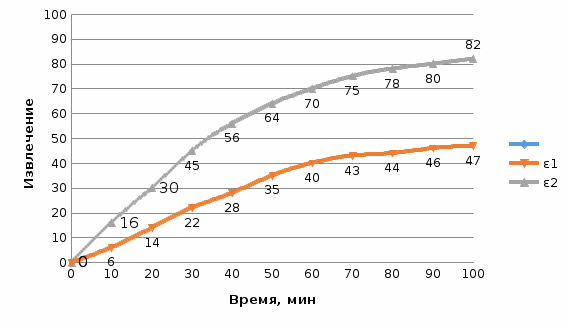 Рисунок 3 - Зависимость извлечения от концентрации кислоты Из рисунка 3 видно, что концентрация кислоты оказывает наибольшее влияние на извлечение. С увеличением концентрации извлечение цинка в раствор значительно увеличивается. Таблица 4 – Зависимость извлечения от скорости вращения мешалки (ω1, ω2) [2].
Аналогично таблицам 2 и 3 строим графическую зависимость извлечения от скорости вращения мешалки (рисунок 4). 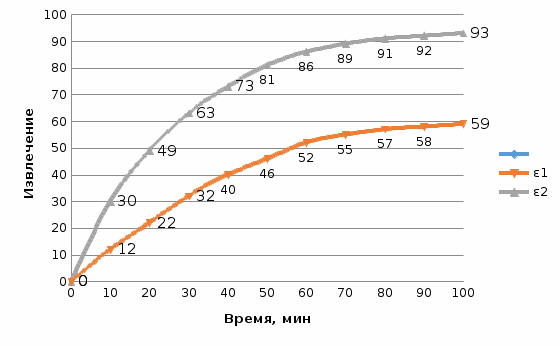 Рисунок 4 - Зависимость извлечения от скорости вращения мешалки Из рисунка 4 видно, что скорость вращения мешалки оказывает не столь существенное влияние на извлечение, как температура и концентрация кислоты. С увеличением температуры извлечение цинка в раствор значительно увеличивается. 1.2 Определение кинетических параметров процесса выщелачивания Основными кинетическими параметрами процесса выщелачивания являются: - энергия активации, - порядок реакции, - интенсивность перемешивания. Определение энергии активации Для определения энергии активации необходимо знать зависимость извлечения цика от температуры. Для определения средней величины энергии активации, по приведенной на рисунке 2 зависимости, определяем за какое время достигается одинаковое извлечение при температуре температурах 60 и 80 0С. Полученные данные приведены в таблица 5. [2] Таблица 5 – Продолжительность одинаковых извлечений при различных температурах
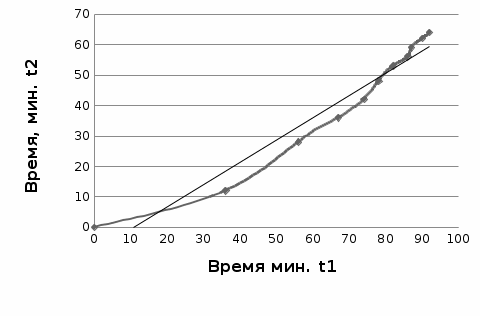 Рисунок 5 - График для определения энергии активации Энергия активации может быть вычислена по формуле: 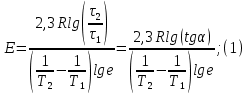 где: e – основание логарифма, численно равное 2,7 [4]; R – универсальная газовая постоянная, численно равная 8,31 [4]. Из графика (рисунок 5) определяем угол наклона прямой к оси абсцисс: 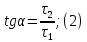 tgα= 50/70 = 0,65; С учетом определенного значения тангенса наклона прямой к оси абсцисс (рисунок 5), равного 0,65 определяем среднюю величину энергии активации процесса выщелачивания цинка из огарка: 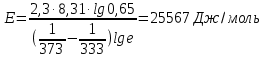 Определение порядка реакции Для определения порядка реакции исследованы зависимости извлечения цинка в раствор от концентрации серной кислоты в отработанном электролите (рисунок 5). С учетом данных зависимостей построена и исследована зависимость продолжительности достижения одинаковых извлечений при концентрации свободного реагента 40 и 110 г/л. Таблица 6 - Зависимость извлечения от концентрации кислоты [2]
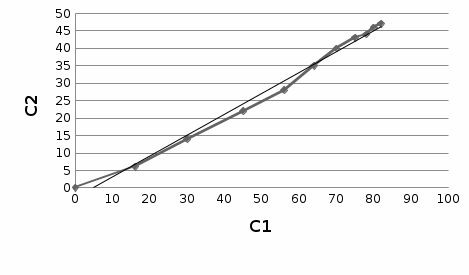 Рисунок 6 – График для определения порядка реакции Порядок реакции определяем по формуле: 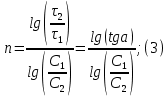 Из графика (рисунок 6) определяем угол наклона прямой к оси абсцисс: tgα = 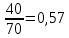 С учетом определенного значения тангенса наклона прямой к оси абсцисс (рисунок 6), равного 0,57 определяем порядок реакции процесса выщелачивания цинка из огарка: 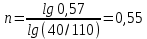 Так как порядок реакции целое число, следовательно, n = 1. Определение величины гидродинамического коэффициента β Д Таблица 7 - Зависимость извлечения от скорости вращения мешалки [2]
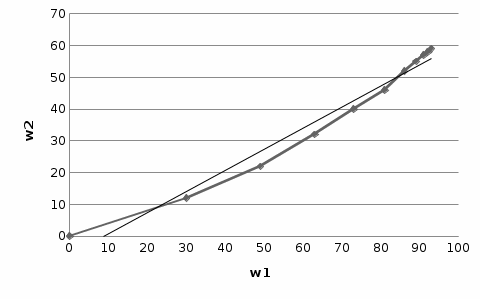 Рисунок 7 - График для определения гидродинамического коэффициента р По экспериментальным данным 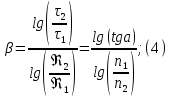 Из графика (рисунок 7) определяем угол наклона прямой к оси абсцисс: tgα = 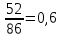 0 0С учетом определенного значения тангенса наклона прямой к оси абсцисс (рисунок 7), равного 0,60 определяем гидродинамический коэффициент β процесса выщелачивания цинка из огарка: 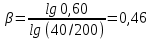 Будем считать, что в исходном растворе изначальная концентрация цинка была равна нулю, так как график идет из начала координат. Определение времени достижения максимального извлечения цинка Для условий, приведенных выше, определить продолжительность достижения максимального извлечения цинка в раствор при температуре 60 оС, концентрации серной кислоты 40 г/л и скорости вращения мешалки 40 об/мин. Продолжительность полного завершения процесса при изменяющихся условиях может быть установлена по соотношению: 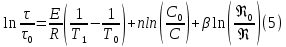 где τ0 = 90 мин - время полного растворения цинка, определенное экспериментально. Re0 – коэффициент гидродинамической обстановки. С учетом того, что третье и четвертое слагаемое будет равно нулю, рассчитывают продолжительность процесса при температуре 60 оC: 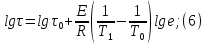 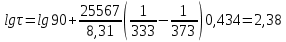 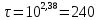 мин минДля условий, приведенных выше, определить время достижения максимального извлечения цинка в раствор при температуре 80 оC, концентрации серной кислоты 110 г/л и скорости вращения мешалки 150 об/мин. Для определения времени достижения максимального извлечения цинка в раствор при изменяющейся скорости вращения мешалки: 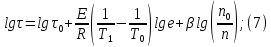 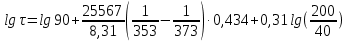 = 2,17 = 2,17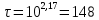 мин минДля условий, приведенных выше, определить время достижения максимального извлечения цинка в раствор при температуре 100 оС, концентрации серной кислоты 70 г/л и скорости вращения мешалки 150 об/мин. Для определения времени достижения максимально возможного извлечения при изменении всех параметров процесса: 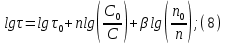 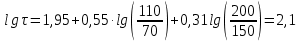 τ= 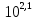 = 126 мин = 126 мин1.4. Построение кинетической функции выщелачивания В качестве кинетической характеристики процесса используют зависимость доли не растворившегося компонента w от безразмерного времени х при соответствующих концентрации реагента и температуре. х = 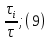 , ,где 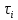 – текущая продолжительность растворения (выщелачивания), – текущая продолжительность растворения (выщелачивания),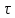 – продолжительность необходимая для достижения полного растворения (выщелачивания), – продолжительность необходимая для достижения полного растворения (выщелачивания),w = 1 – ε Инвариантность кинетической функции для условий максимального извлечения 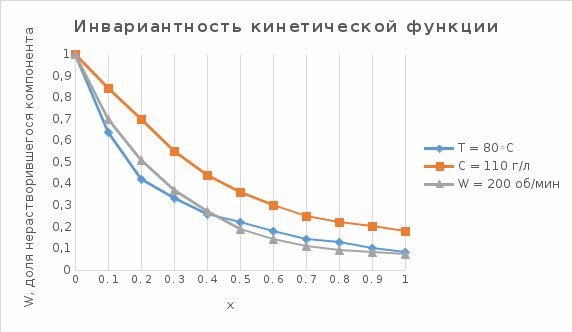 Рисунок 7 – Зависимость доли не растворившегося электролитаВывод В соответствии с расчетами и построенным графиком видно, что кинетическая функция выщелачивания цинка имеет разброс значений, следовательно, проведенных экспериментов недостаточно и необходимо провести дополнительные исследования. 2 Процесс выпаривания солевого раствораВыпаривание проводят выпарном аппарате для выпаривания концентрированных растворов, а также при повышенном и атмосферном давлениях. Выбор давления, зависит от свойств выпариваемого раствора и возможности использования теплоты вторичного пара. Хотя при выпаривании в аппарате достигается большая скорость циркуляции и уменьшается выделений накипи на поверхности теплообмена, т.к. отсутствует кипение в трубах, такой аппарат пригоден для выпаривания концентрированных, кристаллизующихся и вязких растворов.[3] 2.1 Составление материального баланса Поверхность нагрева выпарного аппарата определяется по формуле: 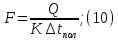 Выразим и определим теплоту в выпарном аппарате: 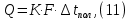 где F = 52 м2 – поверхность нагрева выпарного аппарата [3]; К = 1060 Вт\м2·град – коэффициент теплопередачи [3]; ∆tпол – полезная разность температур в системе, которая находится по формуле: 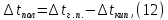 где 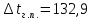 0С – температура греющего пара [3] при давлении Pабс = Pизб + Pатм = 2+1 = 3 кгс/см2 [3]; 0С – температура греющего пара [3] при давлении Pабс = Pизб + Pатм = 2+1 = 3 кгс/см2 [3];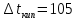 0С – средняя температура кипения в выпарном аппарате. 0С – средняя температура кипения в выпарном аппарате. 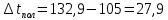 0С 0СQ = 1060·52·27,9 = 1537,85 кДж Найдем расход греющего насыщенного водяного пара, принимая его влажность 5% [3] по формуле: 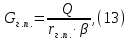 где rг.п. = 2171 кДж/кг – удельная теплота парообразования [3] при давлении Pабс = 3 кгс/см2; β = (100-5)/100 = 0,95 – степень сухости. 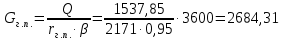 кг/ч кг/чЗапишем уравнение теплового баланса выпарного аппарата, оно примет вид: 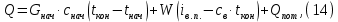 где Gнач= 3000 кг/ч – масса начального раствора [3]; снач = 4190·(1-0,07) = 3896,7 – теплоемкость начального раствора, Дж/кг·К: tкон,tнач – температуры конечного и начального растворов [3]; iв.п. – 2730 кДж/кг – удельная энтальпия вторичного пара [3] при давлении: Pабс = 3 кгс/см2; св = 4190 Дж/кг·К – теплоемкость воды [5]; Qпот = 110 кВт – тепловые потери аппарата в окружающую среду [3]. Из данного уравнения можно определить количество выпариваемой воды: 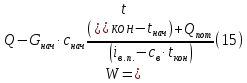 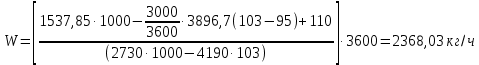 Запишем формулу для определения количества выпариваемой воды при изменении концентрации раствора: 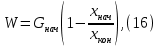 где xнач = 6% - начальная концентрация раствора (из усл. зад.). Из данной формулы можно определить конечную концентрацию раствора: 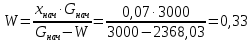 Количество конечного раствора определим, как разность выпаренной воды и массы начального раствора по следующей формуле: Gкон = Gнач – W (17) Gкон = Gнач – W = 3000 – 2368,03 = 631,97 кг/ч Все расчетные данные материального баланса сведем в таблицу 8. Таблица 8 – Материальный баланс
Невязка составляет 0 %. Н = ((mкон - mнач)/mнач)·100 (18) Н = ((3000 - 3000)/3000)·100 = 0% 2.2 Расчет статей прихода и расхода тепла Определим расход теплоты на нагревание поступающего раствора до температуры кипения: 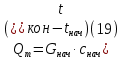 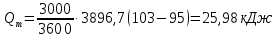 Определим расход теплоты на испарение воды: 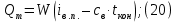 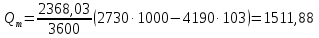 кДж кДжОпределим теплоту исходного раствора: 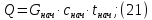 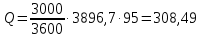 кДж кДжОпределим расход теплоты конечного раствора: 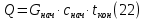 где скон = 4190  (1-0,33) = 2807,3 – теплоемкость конечного раствора [6] Дж/кг·К; (1-0,33) = 2807,3 – теплоемкость конечного раствора [6] Дж/кг·К; Q = 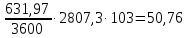 кДж кДжОпределим расход теплоты вторичного пара: 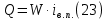 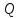 = = 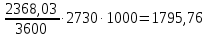 кДж кДжгде iк – 558,9 – удельная энтальпия конденсата [3] при давлении: Pабс = 3 кгс/см2; 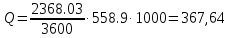 кДж кДжПринимаем, что расход теплоты на дегидратацию в процессе выпаривания растворителя (воды) не превышает 0,5% от теплоты испарения, тогда[3]: 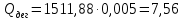 кДж кДжКоличество теплоты передаваемой от греющего пара к раствору определим, как разность суммы расхода тепла и тепла исходного раствора: 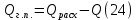 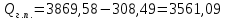 кДж кДж2.3 Составление теплового баланса процесса Все расчетные данные теплового баланса сведем в таблицу 9. Таблица 9 – Тепловой баланс [кДж]
Расходы электроэнергии на выпаривание: 3870/3600 = 1,07 кВт·ч ВыводПри выпаривании в выпарном аппарате 3000 кг/ч 6% раствора нитрата аммония, мы можем получить 631,97 кг/ч раствора. При этом будет получено на выходе 2368,03 кг/ч вторичного пара. Для достаточного прихода тепла, помимо физической теплоты раствора, приходящей в аппарат, нам необходимо подать тепло при помощи подачи греющего пара 3869,58 кг. Итого будет получено от греющего пара 3561 кДж тепла, что в сумме с физической теплотой раствора даст 3870 кДж, которые и необходимы для проведения процесса при заданных условиях. Заключение По проведенным расчётам кинетических характеристик выщелачивания: - энергия активации процесса выщелачивания Е = 25567 Дж/моль; - порядок реакцииn = 1; - величина гидродинамический коэффициента β = 0,46. При определении продолжительности максимального извлечения При Т2 = 60 °C, С1 = 40 г/л, ω1 = 40 об/мин, будет равна τ = 240 мин; При Т1 = 80 °C, С2 = 110 г/л, ω1 = 200 об/мин, будет равна τ = 148 мин; При Т1 = 100 °C, С1 = 70 г/л, ω2 = 150 об/мин, будет равна τ = 126 мин. При расчёте материального баланса получено 3869,58 кДж тепла и электроэнергии на выпаривание 1 м3 нитрата натрия электролита составит 1,07 кВт·ч Список литературы1 Подлинная медицина: Информационный сайт. – URL: http://www.originalmedicine.ru 2 Большаков, Л.А. Теория гидрометаллургических процессов, Определение кинетических параметров реакции / Л.А. Большаков [и др.]. - Норильский индустр. ин-т. – Норильск: НИИ, 2009. – 108 с. 4 Брусенцева, Л.Ю. Краткий справочник физико-химических величин некоторых неорганических и органических соединений / Л.Ю. Брусенцева, АА. Кудряшова – Самара: НОУ ВПО СМИ «РЕАВИЗ», 2011 - 68 с. 5 Рогова Л.И. Теория гидрометаллургических процессов / Л.И. Рогова, И.Г. Тулупова - Норильский индустр. ин-т. — Норильск: НИИ, 2011. – 88 с. 6 Рогова Л.И. Металлургические расчеты в металлургии цветных металлов / Л.И. Рогова – Норильский индустр. ин-т. — Норильск: НИИ, 2013. – 222 с. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
