ИЗУЧЕНИЕ РАСТЕНИЙ КАК ИСТОЧНИКОВ ВАКЦИН. Дёмина А.С. курсовая. Курсовая работа Проректор по административнокадровой и воспитательной работе, Кандидат биологических наук
 Скачать 182.57 Kb. Скачать 182.57 Kb.
|
|
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОАТЕЛЬ- НОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ САНКТ-ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ ХИМИКО-ФАРМАЦЕВТИЧЕСКИЙ УНИВЕРСИТЕТФармацевтический факультет Кафедра фармакогнозии ДЁМИНА АНАСТАСИЯ СЕРГЕЕВНА 3 курс 3384 группа ИЗУЧЕНИЕ РАСТЕНИЙ КАК ИСТОЧНИКОВ ВАКЦИН Курсовая работа Руководитель: Проректор по административно-кадровой и воспитательной работе, Кандидат биологических наук Лужанин Владимир Геннадьевич Работа защищена «»2021 года Санкт-Петербург 2021 ОглавлениеВВЕДЕНИЕ 3 Основное содержание 5 1.1 Получение трансгенных растений 8 1.2 Продуцирование растительных вакцин 10 1.3 Использование метода «биобаллистики» при создании вакцин 14 Вывод……………………………………………………………………………...18 Заключение……………………………………………………………..............20 Список литературы………………………………………………………….21 Введение Цель: Изучить разработку вакцин на основе трансгенных растений. Задачи: Выявить преимущества растительных вакцин такие как, эффективность ,экономичность, возможность хранения и транспортировки без использования холодильного оборудования, что существенно для наименее развитых стран с жарким климатом , оценить перспективу разработки вакцин. Одним из главных критериев процветания страны является средняя продолжительность жизни ее населения. В последнее время наблюдается преждевременная смертность: от сердечно-сосудистых заболеваний, злокачественных новообразований, нездорового образа жизни, неблагоприятных воздействий окружающей среды. Кроме того, причиной более чем 30 % смертей во всем мире являются инфекционные заболевания. Особенность проблемы инфекционных заболеваний состоит в глобальном распространении их по всему миру. Наиболее эффективным средством снижения заболеваемости инфекционными болезнями со времен открытия Пастера и до наших дней является вакцинация. Она способствует формированию у реципиента более или менее стойкого иммунитета к патогенным микроорганизмам, защищая его от инфекции. Более ста лет ученые всего мира разрабатывают и совершенствуют вакцины, создающие иммунитет против возбудителей инфекционных заболеваний. С помощью вакцин спасены миллионы жизней, остановлены эпидемии. С появлением вакцин, антибиотиков и внедрением мер профилактики удалось взять под контроль такие инфекционные болезни, как туберкулез, оспа, холера, брюшной тиф, бубонная чума и полиомиелит. Однако защитные меры со временем становятся не эффективными, и возникают новые вспышки заболеваний. Поэтому в последние десятилетия это заставило совершенно по-новому осмыслить эту проблему. Человечество столкнулось с так называемыми «возникающими» и «повторно возникающими» инфекциями. Под первым ВОЗ понимает ранее неизвестные, или известные, но охватывающие новые территории и типы популяций, где они прежде не регистрировались. Под вторым - известные инфекции, уровень заболевания которыми вновь возрастает. Основными причинами проявления таких инфекций считают: ослабление контроля над ними, повышение миграции населения, увеличение числа людей с ослабленным иммунитетом, а также изменения окружающей среды. При вирусных заболеваниях важную роль играют две ветви иммунного ответа: гуморальный и клеточный. Гуморальный ответ (антитела) направлен на внеклеточную стадию жизненного цикла паразита и препятствует проникновению вируса в клетку. Клеточный ответ направлен на внутриклеточную стадию, цитотоксические лимфоциты-киллеры распознают клетки, зараженные вирусом, и убивают их, препятствуя появлению нового зрелого вирусного потомства. Основное содержание Революционным направлением в современной вакцинологии является разработка вакцин на основе трансгенных растений, в геном которых был встроен соотвествующий фрагмент генома патогенного микроорганизма. Многочисленные экспериментальные данные свидетельствуют о широкой перспективе в разработке и практическом использовании таких вакцин. Оральный способ иммунизации является самым безопасным и доступным. Ассортимент пищевых источников растительных вакцин не ограничен. Немаловажное значение имеет высокая экономичность растительных вакцин с учетом, что по прогнозам многих специалистов стоимость существующих вакцин будет возрастать, а цена многих вновь разрабатываемых вакцин будет выше стоимости при- меняемых в практике. Такие трансгенные культуры, как томаты, морковь, кукуруза, картофель и другие найдут широкое применение в профилактической медицине. Работы в этом направлении ведут и отечественные ученые. Вакцинация - наиболее эффективный и экономичный способ защиты от инфекционных заболеваний, особенно вирусных, поскольку лекарственных препаратов для лечения ряда из них практически нет. Ранее из патогенных микроорганизмов вакцины получали методом проб и ошибок, но с развитием молекулярной биологии и генетической инженерии в последние годы появились более совершенные технологии их создания. Новинки этого ряда должны быть безопасными, недорогими, простыми по способу введения, храниться и транспортироваться без использования холодильного оборудования, что существенно для наименее развитых стран с жарким климатом. Таким требованиям вполне удовлетворяют съедобные растительные вакцины. Большинство инфекционных агентов проникают в организм через слизистые оболочки пищеварительной, дыхательной и мочеполовой систем человека (общая их поверхность - более 400 м, тогда как кожа - лишь около 2 м), поэтому так важны защитные функции слизистых, служащих первым оборонительным барьером на пути вторжения патогенов. Эту роль обеспечивают многочисленные иммуно-компетентные клетки, организованные в так называемую мукозальную иммунную систему. По функциям она отличается от той, что реализует защиту внутренних органов, иными словами, обеспечивает системный ответ. Многочисленные исследования показали: вакцинация с помощью инъекций эффективно предотвращает развитие инфекционного процесса в этих органах, однако не защищает слизистые оболочки. А вот мукозальная иммунизация (доставка антигена на такие поверхности) успешно решает обе задачи. Интересен факт взаимосвязи иммунного ответа слизистых оболочек желудочно-кишечного, респираторного и генитального трактов. Так, если стимулировать его в первом, то специфичная реакция против антигена в виде продукции соответствующего секреторного иммуноглобулина будет наблюдаться и во втором, и в третьем. Для эффективной защиты слизистых оболочек необходима мукозальная иммунизация. В ряду ее преимуществ - повышенная эффективность, упрощенное введение препарата, снижение риска заражения другими микроорганизмами по сравнению с инъекционными или иными методами, нарушающими кожные покровы (например, в случае прививки от оспы). Правда, чтобы эти достоинства реализовать на практике, необходимо учитывать следующее обстоятельство. Интересующие нас оболочки обладают защитными физиологическими механизмами удаления любых антигенов с собственных поверхностей, в том числе при участии ферментов. Как же в таком случае преодолеть естественный барьер и благополучно доставить иммунизирующий компонент к месту назначения? Традиционно для этого используют упаковку - биодеградируемые полимерные или липидные частицы, которые чаще всего вводят через рот или нос. Другой, более современный подход состоит в получении упомянутых выше трансгенных растений, продуцирующих протективные антигенные белки инфекционных агентов, и использование их в качестве съедобных вакцин. В чем преимущества данного подхода? В том, что стенки клеток растений обеспечивают эффективную защиту находящегося в них антигена после его попадания в ротовую полость человека, проглатывания и последующего прохождения через желудок. "Упакованный" таким образом антиген в целости и сохранности достигает кишечника, где и представляется мукозальной иммунной системе. Важная особенность съедобных вакцин - их потенциальная низкая стоимость. По оценкам, такие рекомбинантные белки заметно дешевле аналогов, произведенных в других генно-инженерных системах (даже с применением бактерий или дрожжей), ибо не требуют специального выделения и очистки. Другие привлекательные свойства - биологическая безопасность (в них нет вирусных и других патогенов человека и животных), простота хранения и применения. Более того, можно создавать растения, одновременно продуцирующие несколько протективных антигенов различных патогенов, что на практике означает появление мультивалентных съедобных вакцин. Получение трансгенных растений В настоящее время, употребляя пищу, мы можем не только удовлетворять свои вкусовые потребности и поддерживать развитие организма в целом, но и тем самым защищать себя от болезней. Именно поэтому в XXI веке интенсивное развитие новых методов генетической инженерии позволило провести работы по получению съедобных вакцин на основе генетически модифицированных растений. Растения имеют очень важное преимущество перед животными как предмет интереса специалистов в области экспериментальной биологии. Из недифференцированных соматических тканей, выделенных из единичных клеток растений, вполне возможна регенерация с образованием полноценных фертильных (способных завязывать семена) экземпляров. Это свойство - тотипотентность - открывает для молекулярных биологов большие возможности в разработке генетически модифицированных образцов. Ключевую роль в развитии генетической инженерии растений сыграло изучение природных механизмов переноса специфичных фрагментов плазмидной ДНК (Т-ДНК) из почвенной бактерии Agrobacterium tumefaciens в ядро растительной клетки с последующей их интеграцией в хромосомную ДНК. Выяснение основных закономерностей этого процесса американскими и голландскими учеными в 1980-х годах позволило создать относительно простую и надежную систему введения чужеродных генов в клетки с последующей селекцией растений, содержащих целевой трансген и названных поэтому трансгенными. [1] В природе агробактериальный инфекционный процесс начинается в месте повреждения растения и ведет к образованию опухолевых разрастаний тканей - корончатых галлов. Их клетки напоминают раковые у животных. Они способны к неограниченному, нерегулируемому росту, при культивировании in vitro происходящему даже в отсутствие специальных гормонов (нормальные растительные клетки такой способностью не обладают). Изучая природу индуктора опухолей A. tumefaciens, бельгийский исследователь Iva Zenin в 1974 г. выявил, что соответствующим агентом у этой бактерии является плазмида Ti (tumor inducing) - ее размер обычно составляет 200 - 250 тыс. пар нуклеотидов. Позднее Mary Hilton (США) с соавторами обнаружили: Ti содержит Т-ДНК, а она, прежде всего за счет активности примерно 35 расположенных на плазмиде генов вирулентности (патогенности), способна "выщепляться" из ее состава и передаваться в растительную клетку с последующей встройкой в хромосому ядра. Причем Т-ДНК с обеих сторон ограничена прямыми повторами длиной 25 нуклеотидных пар, называемыми правой и левой границами (RB и LB). же необычных аминокислот и сахаров - опинов. Штаммы агробактерий, вызывающие опухоли, способны к избирательному катаболизму (ферментативному процессу расщепления) опинов, синтез которых они индуцируют. Гены ферментов биосинтеза гормонов и опинов, кодируемых Т-ДНК, хотя и находятся в самой бактерии, эволюционно адаптированы для экспрессии только в растительных клетках. A. tumifaciens является своеобразным природным генным инженером. Важная ее особенность заключена в том, что последовательность нуклеотидов, находящихся между RB и LB, не влияет на эффективность переноса Т-ДНК из агробактерий в клетку растения. Вот почему она может послужить инструментом для переноса чужеродных генов из A. tumefaciens в геном растительных клеток. Продуцирование растительных вакцин В Государственном научном центре вирусологии и биотехнологии "Вектор" в содружестве с Сибирским институтом физиологии и биохимии растений СО РАН (Иркутск) и Институтом химической биологии и фундаментальной медицины СО РАН (Новосибирск) разработали растительные профилактические вакцины против некоторых опасных заболеваний, в частности, впервые были получены кандидатная бинарная вакцина против ВИЧ и гепатита В на основе химерного гена TBI-HBS и моновалентная вакцина против гепатита В на основе белка оболочки PreS2-S. При создании этих вакцин была использована классическая агробактериальная трансформация, которая обеспечивает инсерцию одной копии целевого гена в геном трансформируемого растения и его экспрессию, причём эта экспрессионная система не была защищена от РНК-интерференции. Обе вакцины были испытаны на лабораторных животных и вызывали высокий и длительный иммунный ответ, обеспечивающий превентивность. [2; 3]. Концепцию такого производства впервые сформулировал в 1992 г. Hugh Mason с соавторами (США). Они стремились получить препарат против вируса гепатита В на основе трансгенного табака. Создав растения, продуцирующие поверхностный антиген HBsAg этого вируса, и проведя инъекционную иммунизацию мышей очищенным рекомбинантным белком, в 1995 г. ученые показали: синтезированный в растениях вирусный белок стимулирует специфичный иммунный ответ. В том же 1995 г. Charles Arntzen с соавторами (США) получили новый вариант растений трансгенного картофеля. Уже после четырех кормлений подопытных мышей его сырыми клубнями начинали вырабатываться специфичные антитела в сыворотке крови и слизистой кишечника. Так впервые была показана принципиальная возможность создания съедобных растительных вакцин. А спустя три года аналогичные клубни апробировали на небольшой группе добровольцев и обнаружили появление в крови людей специфичных антителопродуцирующих клеток. Позднее группа американского биолога Stephen Stratfield получила трансгенные растения кукурузы, зерна которой вызывали сильный иммунный ответ у подопытных мышей. Указанная культура - привлекательный объект для конструирования съедобных вакцин, ибо обеспечивает длительную сохранность зерна и рекомбинантного антигена в его составе без использования холодильного оборудования. Важное направление данных исследований - создание вакцин на основе растений, которые могут широко использоваться в пищу без термообработки. Сотрудники центра с коллегами из Сибирского института физиологии и биохимии растений и Института химической биологии и фундаментальной медицины решили получить препарат одновременно против вируса гепатита В и иммунодефицита человека на основе трансгенных растений томата. Вирусы иммунодефицита человека (ВИЧ) и гепатита В - опаснейшие возбудители социально значимых, имеющих эпидемический характер инфекционных заболеваний. По данным Всемирной организации здравоохранения, от ВИЧ/СПИДа в мире ежегодно умирает 2 - 3 млн. человек. Количество хронических носителей вируса гепатита В на планете составляет около 350 млн, а смертность, обусловленная им, достигает 1 млн. человек в год. Безигольное вакцинирование представляет обоснованную альтернативу инъекционному, поскольку инъекционное вакцинирование вызвало до 15 млн. случаев заражения гепатитом В, 1 млн. заражения гепатитом С, 340 тыс. заражения ВИЧ, 3 млн. бактериальных инфекций и 850 тыс. случаев инфекций, приводящих к абсцессам. [4] Во многих лабораториях мира идет интенсивный поиск средств предупреждения указанных патологий. В частности, многообещающий подход к конструированию синтетических вакцин в виде белков с оптимальным составом антигенных детерминант (фрагментов белков) соответствующих агентов. Для проверки этой концепции сотрудники "Вектора" рассчитали искусственный полиэпитопный белок, состоящий из набора иммуногенных детерминант белков Env и Gag ВИЧ-1 и названный TBI (T- and B-cellular immunogen). Эксперименты на мышах показали: последний индуцирует иммунный ответ против ВИЧ. Учитывая это, сотрудники центра предложили создать растения томата, синтезирующие химерный белок, состоящий из последовательностей TBI и уже упоминавшегося поверхностного белка оболочки (HBsAg) вируса гепатита В, а затем изучить иммуногенные свойства трансгенных плодов при скармливании их лабораторным животным. В эксперименте мышей кормили пастой из этих томатов. Позднее провели иммуноферментный анализ сыворотки крови и фекалий иммунизированных животных на наличие антител к вирусам гепатита В и ВИЧ-Было показано: полученные трансгенные растения продуцируют белок, обеспечивающий при кормлении мукозальный и гуморальный иммунные ответы против указанных вирусов, и могут рассматриваться в качестве кандидатной съедобной вакцины одновременно против двух указанных инфекций. Совместно со специалистами Института цитологии и генетики СО РАН (Новосибирск) удалось получить растения трансгенной моркови, продуцирующей HBsAg вируса гепатита В, и при кормлении лабораторных мышей ее сырыми корнеплодами выявить развитие специфичного иммунного ответа против данного вируса. Работы по созданию съедобных вакцин в последние несколько лет интенсивно развиваются, в них вовлекается все большее число лабораторий в разных странах мира. Несомненно, эти новые препараты в недалеком будущем найдут свое место в общей системе защиты от патогенов. В частности, их можно будет использовать для ревакцинации людей или животных, ранее привитых классическим способом, что повысит общий уровень иммунной защиты от инфекционных заболеваний. Инициатива создания профилактических пероральных вакцин вызвала большой интерес и получила широкое развитие. Оказалось, что трансгенные растения с введённым целевым геном способны успешно синтезировать многие антигенные белки разных опасных вирусных и бактериальных инфекций. За 20 лет после провозглашения инициативы создания пероральных, или, как их вначале называли, «съедобных» вакцин, было разработано примерно 700 профилактических кандидатных растительных вакцин против таких возбудителей, как энтеропатогенная Escherichia coli, холера, малярийный плазмодий, золотистый стафилококк, возбудитель пневмонийного пастеррелёза, некоторые гепатиты, вирусы иммунодефицита, кори, краснухи, ротавирус, риновирус, вирусы Норволка, респираторного синцития, бешенства, ящура, сибирской язвы, цитомегаловируса и других. Около 20 растительных вакцин были одобрены Управлением по санитарному надзору США (FDA) для применения на людях, среди них вакцины против холеры, гепатита В, бешенства, сезонного и пандемического гриппа. [5] Проведенные эксперименты говорят о масштабной перспективе развития и применения таких вакцин. Разнообразие пищевых продуктов, являющихся основным источником получения съедобных вакцин, не ограничено. Сам способ вакцинации – оральный – становится наиболее доступным и безопасным. Стоимость новых вакцин будет выше стоимости традиционных, откуда важное значение придается высокой экономичности растительных вакцин. В настоящее время подвергаются испытанию «картофельные» вакцины против вируса Ньюарк – возбудителя диареи. На животных проводятся исследования вакцин против бешенства, полученных из помидоров. Сейчас ведутся работы по получению съедобных вакцин из растений, которые можно использовать в сыром виде, например, бананы, которые так любят дети. [6] Использование метода «биобаллистики» при создании вакцин В 1989 г. J. Sanford предложил идею создания метода быстрой и эффективной трансформации растений с помощью метода биобаллистики, при которой ДНК целевых генов или рекомбинантные плазмиды помещали на вольфрамовые или золотые «микропули», которые размещали на поверхности тефлоновых «макропуль» и выстреливали в растительные объекты с помощью генной пушки. Этот метод получил значительное развитие, так как такой способ трансформации оказался применимым не только для растений, но и других объектов, в том числе позвоночных, и даже их органов. [7] Метод получил название «биолистик, biolistic» (сокр. от «биобаллистика»). Впоследствии этот метод и генные пушки, работающие на основе инертных газов (гелия, аргона) заняли на какое-то время главенствующее положение в биотехнологии трансгенных растений, поскольку метод позволял «застреливать» большое количество рекомбинантных плазмид с высокоэкспрессирующими конструкциями. Выход синтезируемых антигенных белков увеличился в 10–100 раз. G. Daniel и его сотрудники значительно усовершенствовали метод: были получены трансгенные гомопластомные растения с высоким выходом не только антигенных, но и других гетерологичных белков, полезных для человека. Наибольший выход был получен при создании цистронной сопряжённости целевого гена, маркерного гена и фланкирующих их рекомбинирующих фрагментов генов пластид хозяйских растений. Подход подстраивания целевого гена под цистрон генома пластид позволил увеличить выход целевого белка кристаллического токсина 2а Bacillus thuringiensis и составил до 46 % от ОРБ и более в листьях табака. [8] Экспрессия в пластидных конструкциях превышает в 1 000 или более раз экспрессию при ядерной трансформации. Следует упомянуть, что пластидная трансформация с использованием генов устойчивости к канамицину NPTII приводит к содержанию селективного фермента до 23 % от ОРБ. Однако такие вакцинные препараты представляют сомнительную ценность из-за очень высокого содержания ферментов устойчивости к антибиотику. Комбинированные системы трансформации пластид разработал Р. Малига, который впервые совместил агробактериальную трансформацию для помещения экспрессирующей конструкции в ядро, а целевые гены помещал под лидер/терминатор малой субъединицы RUBISCO, транспортирующий целевой ген/белок в пластиды. При использовании гена, кодирующего токсин столбняка TetC, помещённого под пластидный промотор Pprrn и с регуляторными последовательностями генома энтеропатогенного фага T7G10a, фрагментов пластид atpB/TrbcL удалось повысить экспрессию до 10–25 % от ОРБ. [9] В 2015–2016 гг. была сделана попытка биобаллистической трансформации каллусов томата с целью изучения возможности применения этого метода для получения растений с более высокой продукцией антигенных белков. Для получения каллусов выделяли зародыши, которые культивировали на среде Мурасиге и Скуга с добавлением индолилуксусной кислоты и кинетина в соответствующих концентрациях в течение 3 недель на свету. Генетическую трансформацию проводили в стерильных условиях с помощью пневматической генной пушки конструкции Р. К. Саляева. [10] На рис. 1 видны результаты обстрела препаратом плазмиды pBI121, несущей репортерный ген GUS, кодирующий синтез β-глюкуронидазы. Через 10 дней обстрелянные каллусы погружали в раствор субстрата 5-бром-4-хлор-3-индолилглюкуронида и наблюдали развитие сине-голубой окраски. В контрольных каллусах подобной окраски не наблюдали. 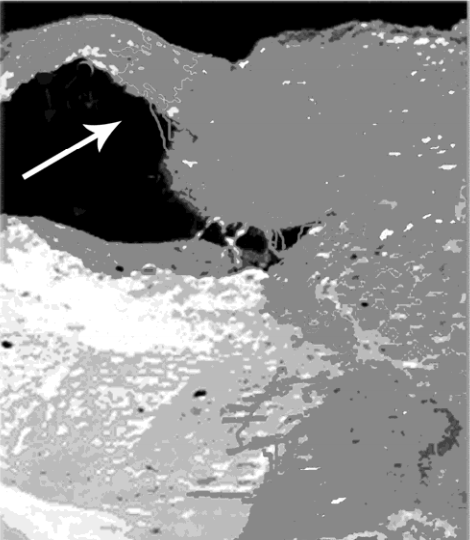 Рис. 1. Каллус томата через 10 дней после обстрела плазмидой pBI121 GUS. Стрелкой указан окрашенный в голубой цвет проросток, образовавшийся из генетически трансформированного каллуса. Увеличение х50 Результаты показали перспективность данного метода для дальнейшей работы уже с целевыми генами, имеющими пластидное адресование. Биобаллистическая трансформация позволяет значительно (до величины порядка 2 мкг на 1 мг ОРБ) повысить выход антигенного белка (рис. 2). Тем не менее пластидная трансформация всё ещё остаётся трудоёмким процессом, требующим к тому же сложной аппаратуры и значительных финансовых вложений. 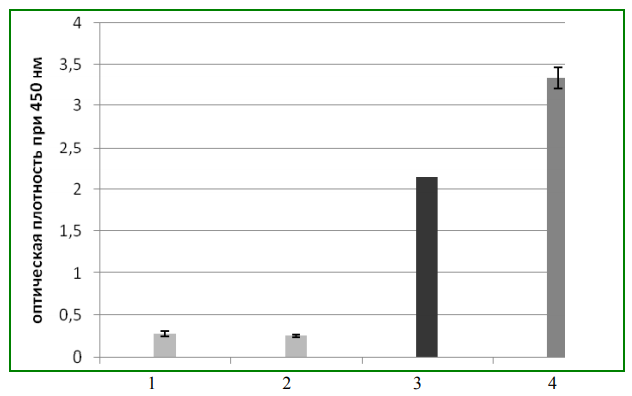 Рис. 2. Данные иммуноферментного анализа экстрактов, полученных из листьев контрольных и трансформированных растений томата. 1 – растения, трансформированные «микропулями» без целевой ДНК; 2 – растения, не подвергавшиеся биобаллистическому воздействию; 3 – стандартный белок HPV16 L1 в количестве 400 нг; 4 – листья растений, трансформированных «микропулями» с целевой ДНК (n = 17) Вывод Как следует из вышеизложенного, растительные экспрессионные системы находят широкое применение в биофарминге. В частности, вакцины, созданные на основе растений, имеют целый ряд предпочтительных качеств. Во-первых, это вакцины неинъекционные, изготовленные из съедобных плодов растений, широко употребляемых в пищу. Токсичность их практически сводится к нулю из-за отсутствия скрытых патогенов, прионов, транспозонов, патогенных вирусов растений, потенциально представляющих опасность для человека, а также других патогенов микробиального происхождения. При создании вакцин часто применяют различные адъюванты – соединения, способствующие усилению иммунного ответа организма. В качестве адъювантов чаще всего применяются соединения алюминия, которые одновременно являются сорбентами для вирусоподобных частиц вакцинного материала, продуцируемого дрожжевыми системами или экспрессионными системами на основе бакуловирусов. Известно также, что некоторые соли алюминия бывают токсичны. Используют в качестве адъювантов также холерный токсин СТВ или термолабильный токсин LTB энтеропатогенной E. coli. Эти токсины могут оказывать неблагоприятное воздействие на слизистую оболочку кишечника при пероральном применении. [11] При создании растительных вакцин можно использовать плоды таких растений, которые содержат природные адъюванты. В частности, в проекте исследовательской группы использовались плоды томата, которые в своём составе уже имеют природные адъюванты (томатин, ликопин, эскулетин, ликоперсицины, томатидины, соланины и др.). Это позволило избежать внесения в вакцинный материал искусственных адъювантов.[12] Будучи вакцинами перорального применения (в капсулах), растительные вакцины по сравнению с инъекционными не требуют при вакцинации специально обученного медицинского персонала. Поэтому вакцинация более проста и комфортна, особенно для детей. Растительные экспрессионные системы, по мнению ряда авторов, представляются не только более безопасными, но и более дешёвыми, вполне применимыми для крупномасштабного производства. [13] Немаловажным качеством растительных вакцин является то, что они не требуют соблюдения жёсткой «холодной» цепи при транспортировке и хранении. Траспортировка и хранение таких вакцин может осуществляться не при –70 или –30 °С, но и в условиях морозильного отделения обычного холодильника при –20 °С. Антигенная активность вакцины сохраняется даже при комнатной температуре в течение года и более и только содержание в течение 30 сут. при 40…45 °С уменьшает количество антигенного белка на треть. [14] Заключение Подводя итог всему изложенному, можно сделать вывод о том, что инновационные биотехнологии, широко использующие методы молекулярной биологии и генной инженерии, открыли новые возможности в создании перспективных типов растительных профилактических и терапевтических вакцин, работа над которыми интенсивно ведётся во многих странах. Список литературы 1. Трансгенные организмы: как уменьшить риски? - Наука в России /А. Куликов, В. Митрофанов. - 2009. - № 2. - с.54-60.– Текст: непосред- ственный. 2. Изучение длительности мукозального иммунного ответа у мышей после приема кандидатной съедобной вакцины на основе плодов томата, трансгенного по гену TBI-HBS / Р. К. Саляев [и др.] // Докл. Акад. наук. – 2009. – Т. 428, № 1. – С. 118–120. Текст: непосредственный. 3. Мукозальная кандидатная вакцина против гепатита В, созданная на основе плодов томата, трансгенного по гену preS2-S / Р. К. Саляев [и др.] // Докл. Акад. наук. – 2012. – Т. 446, № 5. – С. 583–586. Текст: непосредственный. 4. Oral delivery of human biopharmaceuticals, autoantigens and vaccine antigens encapsulated in plant cells / K.-Ch. Kwon [et al.] // Adv. Drug. Deliv. Rev. – 2013. – Vol. 65, N 6. – P. 782–799. Текст: непосредственный. 5. Streatfield S. J. Plant based vaccines / S. J. Streatfield, J. A. Howard // Intern. J. for Parasitology. – 2003. – Vol. 33, N 5–6. – P. 479–493. Текст: непосредственный. 6. Вакцины будущего. Текст: электронный Режим доступа: http://www.iamok.ru/podm/profilak_med/immunitet/vakciny_budushego.html Дата обращения - 29.03.2021 7. High-velocity microprojectiles for delivering nucleic acids into living cells / T. M. Klein [et al.] // Nature. – 1989. – Vol. 327, N 6117. – P. 70–73. Текст: непосредственный. 8. Plant-made vaccine antigens and biopharmaceuticals / H. Daniell [et al.] // Trends Plant Sci. – 2009. – Vol. 14, N 12. – P. 669–672. Текст: непосредственный. 9. Maliga P. Progress towards commercialization of plastid transformation technology / P. Maliga // Trends in Biotechnology. – 2003. – N 1. – P. 20–28 Текст: непосредственный. 10. Жимулев И. Ф. Общая и молекулярная генетика : учеб. пособие / И. Ф. Жимулев. – Новосибирск : Изд-во Сиб. ун-та, 2003. – 479 с. Текст: непосредственный. 11. Petrovsky N. Comparative safety of vaccine adjuvants: a summary of current evidence and future needs / N. Petrovsky // Drug. Saf. – 2015. – Vol. 38, N 11. – P. 1059– 1074 Текст: непосредственный. 12. Identification and mode of inheritance of quantative trait loci for secondary metabolite abundance in tomato / S. Alseekh [et al.] // The Plant Cell. – 2015. – Vol. 27, N 3. – P. 485–512. Текст: непосредственный. 13. Hefferon K. Plant virus expression vectors: a powerhouse for global health / K. Hefferon // Biomedicines. – 2017. – Vol. 5, N 3, 44; Текст: непосредственный. 14. Аn E7-based therapeutic vaccine protects mice against HPV16 associated cancer / A. Venuti [et al.] // Vaccine. – 2009. – Vol. 27, N 25–26. – P. 3395–3397 Текст: непосредственный. Иллюстрации: Рис.1;2 - Жимулев И. Ф. Общая и молекулярная генетика : учеб. пособие / И. Ф. Жимулев. – Новосибирск : Изд-во Сиб. ун-та, 2003. – 479 с. Текст: непосредственный |
