Курсовая работа - Малахит. Курсовая работа студентка 3 группы Шимко Ирина Александровна Воронежский Государственный Университет Воронеж 2009
 Скачать 186.55 Kb. Скачать 186.55 Kb.
|
|
Малахит Курсовая работа Выполнила: студентка 3 группы Шимко Ирина Александровна Воронежский Государственный Университет Воронеж 2009 I. Теоретическая часть. 1.1. Введение. Происхождение слова. История малахита. Русская мозаика. Происхождение слова. Малахит - один из красивейших минералов. Его окраска богата оттенками - вся палитра зеленых тонов от светло-зеленого с голубизной (бирюзового) до густого темно-зеленого цвета ("плисового"). Название минерал получил, вероятно, за зеленую окраску, напоминающую цвет листьев мальвы (греч. malache - мальва), либо за небольшую твердость (греч. malakos- мягкий). В средневековой Европе и в Древней Руси латинское «молохитес» имело синоним - муррин. В ученом же обиходе XVII в. пользовались вариациями плиниевского molochites - мелохилес, мелохитес, молохитес. Последняя форма дожила до XVIII в., пока не была вытеснена современным написанием малахит, предложенным шведским минералогом Валлерием[1]. История малахита. С неолита вплоть до железного века, он был камнем ремесленников: краскотеров и красильщиков, стеклодувов, живописцев, плавильщиков (выплавляли медь). Иногда его использовали в качестве бесхитростных украшений и простых поделок. Самой ранней малахитовой поделке 10500 лет! Это скромная, простой овальной формы подвеска, найденная в одном из погребений неолитического могильника в долине Шанидар (Северный Ирак). В те времена в нем ценилась не красота, а польза. В античное время стали ценить в малахите редкость и красоту, неповторимость рисунка и своеобразие цвета. Малахит стал материалом художника, а создаваемые в нем формы - предметом вожделения знати. Древние греки украшали малахитом нарядные здания и залы. В Древнем Египте из малахита, добываемого на Синайском полуострове, изготовляли камеи, амулеты и украшения. Его использовали даже для подведения глаз (в виде порошка). Средневековью досталось лишь прошлое малахита, и европейская культура осваивала его через книжные традиции, питаясь отголосками былого его великолепия, легендами и преданиями, дошедшими от античного мира, и еще более смешав правду с вымыслом, сделала малахит амулетом, талисманом, наделив его особым потаенным миром, скрытым смыслом. По суеверию, распространенному в средневековой Европе, амулет в форме креста способствовал облегчению родов, так как зеленый цвет камня - символ жизни и роста. Примеры показывают, что на пестром и нетребовательном рынке средневековых амулетов малахит, недорогой камень, был достаточно популярен. Верили, что кусочек малахита, прикрепленный к детской колыбели, отгоняет злых духов; осененный этим камнем ребенок спит крепко, спокойно, без неприятных сновидений. В некоторых районах Германии малахит разделял с бирюзой репутацию камня, предохраняющего от падения с высоты (всадника с лошади, строителя с лесов и т.п.); он будто бы обладал способностью предвидеть беду - в преддверии несчастья раскалывался на куски. Боэций де Боодт в своей "Истории драгоценных камней" (1603) писал о том, что особую силу малахитовому талисману придает выгравированное на камне изображение солнца. С этим знаком малахит охранял от колдовских чар, злых духов и ядовитых тварей. Люди верили, что малахит мог сделать человека невидимым. Пьющий из малахитовой чаши оказывался способен понимать языки животных и т.д. Практический опыт средневековых рудокопов знал малахит как поисковый признак окисленных медных руд и богатых скоплений металла в медистых песчаниках.[2] Однако подлинную известность этот минерал получил после открытия крупных месторождений малахита в конце XVIII в. на Урале (ранее уральский малахит использовался только для выплавки меди). В XIX в. на Медноруднянском и Гумишевском рудниках малахит стали добывать в большом количестве (до 80 т ежегодно).XIX век стал золотым веком для малахита. Центр его культуры переместился в Россию, где он нашел себя с равным успехом в технологиях, в научном знании, в искусстве - от малых до монументальных форм. Малахит становится модным среди знати, о нем заговорили, им украшали минеральные кабинеты России и Европы. В конце XVIII в. - начале XIX в. богатыми коллекциями уральского малахита располагали многие минеральные кабинеты: лучшими - кабинет Екатерины II в Зимнем дворце, кабинеты ученых-естествоиспытателей П.С.Палласа, И.И.Лепехина, посетивших месторождения малахита на Среднем Урале. Крупнейшей коллекцией малахита, оставившей далеко позади все прочие, владел граф Н.П.Румянцев (рассказывают, что в войну 1812 года ее разыскивал Наполеон, мечтавший вывезти румянцевский малахит во Францию)... Особой достопримечательностью были малахитовые гиганты. Среди наиболее примечательных - два монолита музея Горного института в Санкт-Петербурге. Один весом 1,5 тонны (96 пудов) был передан сюда Екатериной II в 1789 году. Ей же в свою очередь его преподнесли наследники А. Ф. Турчанинова, владельцы Гумешевского рудника, как обломок монолита, весившего 2,7 тонны (170 пудов). Этот "осколочек" оценивался тогда в 100000 рублей. Другая глыба весом чуть более 0,5 тонны поступила сюда в 1829 году от владельца Кыштымского рудника на Южном Урале Л. И. Расторгуева. В конце 20-х годов XIX века при очень высоких ценах на малахит и высоком потребительском спросе, камень стал символом богатства, знаком социального отличия. За ним гонялись как императорский двор, так и высшая знать, стремящаяся, с присущим ей тщеславием, выглядеть не хуже власть предержащих. Иметь вещи из малахита становится правилом хорошего тона. Квинтэссенцией соперничества за обладание наиболее престижной формой из малахита стал перенос этого камня из сферы малых "прикладных" в колоссальные вещи дворцового назначения и архитектурно-декоративное убранство. Первым значительным явлением петербургской монументальной антологии малахита стала мозаичная отделка четырехколонного парадного зала дома П.Н.Демидова. С 1838 года императорский дом начинает соревнование с Демидовыми в размерах малахитовой роскоши. Демидовский зал послужил прототипом еще более роскошного убранства Золотой гостиной императрицы в Зимнем дворце. Облицовка малахитом пилястр, колонн, каминов дала ей название Малахитовой. Создавалась она в 1838-1839 годах по проекту А.П.Брюллова мастерами-малахитчиками Петергофской гранильной фабрики и "Английского магазина Никольс и Плинке". Этой подлинной жемчужиной Эрмитажа завершаются тридцатые годы истории русского малахита. Период этот был знаменателен тем, что малахитовое дело России за кратчайший срок обрело всемирное признание. Россия стала законодательницей мод во всем, что касалось малахита. Русские мастера изумляли мир масштабами, совершенством своих работ, глубиной художественного видения и восприятия малахита. Природные особенности малахита - обилие крупных и мелких пустот, каверн, посторонних включений, ноздреватость - заставили в работе с ним отказаться от привычных представлений о многофасадной красоте камня, позволяющей выделывать объемные вещи. Середина XIX в. - триумф малахита и вместе с тем последний яркий этап его истории. В этот период завершаются малахитовые убранства (колонны) Исаакиевского собора в Петербурге, заканчивается работа над малахитовым камином и пилястрами Большого Кремлевского дворца в Москве. 1851 год - триумфальный парад русского малахита на первой Всемирной выставке в Лондоне. С конца XIX века малахит утратил былую славу камня власть имущих. В мелких изделиях он стал доступен среднему сословию, а в монументальных изделиях выступал пусть дорогим, но все же поделочным камнем, тем самым малахит оказался низложен с аристократического рынка роскоши. С 60-х годов обработка малахита становится преимущественно делом уральского кустарного промысла. Столичные мастерские обращаются к малахиту все реже и, наконец, совсем сворачивают его обработку. А на отходах огромной добычи первой половины XIX века стала развиваться целая отрасль русского технологического малахита - производство малахитовой краски. А. Е. Ферсман пишет, что "...до революции в Екатеринбурге и Нижнем Тагиле можно было видеть крыши многих особняков, окрашенные малахитом в красивый синевато-зеленый цвет". В XX веке интерес к малахиту переместился в сферу научного исследования. С его изучением совершенствуется знание процессов возникновения медных и железомедных месторождений различного типа, формулируется ряд законов онтогении минералов, закладываются основы технологии синтеза малахита. Малахит, как и прежде, любим коллекционерами. Как поделочный камень он редок и осваивается лишь в малых формах художниками-ювелирами. В наши дни малахит - один из самых популярных ювелирных и декоративных камней. Из него делают мелкие кабинетные украшения, шкатулки или подставки для подсвечников, часов, пепельницы и небольшие фигурки. А бусы, броши, перстни, кулоны из малахита ценятся наравне с полудрагоценными камнями и пользуются большим спросом. На мировом рынке за малахит в сырье кусками массой 600-800 г платят до 20 дол./кг. Русская мозаика. Русскими умельцами был разработан особый способ изготовления изделий из малахита, называемый "русская мозаика", при котором куски малахита распиливались на тонкие пластины, и из них подбирался рисунок, наклеиваемый на металл или мрамор. Все, что сделано из малахита - от шкатулок до ваз и колонн, тщательно подобрано из тонких небольших плиток. Тысячи пудов камня пропустили руки мастеровых, прежде чем разрозненные плитки слились в великолепный единый узор, создавая впечатление монолитности изделия. В ходе работы с малахитом было выработано несколько технологических видов мозаики: Первый - простейший, когда поле выложено крупными многоугольными прямосторонними плитками, не подогнанными ни по рисунку, ни по цвету. Швы между ними откровенно обнажены, словно рама в витраже. Такая мозаика имитирует грубую брекчию. Второй тип мозаики характеризует несколько более тонкое восприятие рисунка малахита, хотя различие его с первым невелико. Все приемы здесь те же, с той лишь разницей, что одна-две стороны каждой плитки скруглены. Грубое присутствие швов в сочетании с округлыми и многоугольными формами делает мозаику похожей на более сложные брекчии, а порой и на конгломераты.Третий - самый исключительный тип малахитовой мозаики. Края плотных крупных плиток здесь обработаны на специальном приспособлении, где им придан вторящий рисунку малахита волнистый профиль. В основе четвертого типа мозаики лежит уже не столько камень, сколько мастика. Ею сплошь покрывают декорируемое поле, а затем втапливают в нее мелкие бесформенные плитки с рваными обломками или изрезанными самой природой краями. Пятый отличается от четвертого только тем, что в бесформенные плитки, втопленные в мастику, и в саму мастику врезаются или втапливаются небольшие, до 7-8 мм в диаметре, круглые кусочки малахита высокого сорта, имитируя "глазчатые" сорта камня.[3] На фоне всех этих мозаик использование малахита небольшими декоративными вставками во флорентийские мозаики и даже в объемные инкрустации кажется чем-то малозначащим, второстепенным. Между тем эти формы не менее интересны. С них начиналось освоение малахита европейскими мозаичистами (конец XVIII в.), в них были открыты возможности его выразительного языка. Скромные по объему формы малахита флорентийских мозаик, где он рассеян среди агатов, яшм, кахолонга, ляпис-лазури, свидетельствует об уникальности этого камня в палитре мастеров. В России в 18-19 вв. методом "русской мозаики" малахитом облицовывались колонны, пилястры, каминные доски, столешницы, крупные напольные вазы, часы и другие изделия в дворцовых интерьерах. В Малахитовом зале Эрмитажа хранится более 200 изделий из малахита. Колонны из малахита установлены в алтарной части Исаакиевского собора в Санкт-Петербурге. При обработке малахита стараются максимально выявить декоративность камня. Особенно ценится глазчатый малахит с тонкими концентрическими кольцами - "павлиний глаз". В крупных штуфах малахит не спутаешь ни с чем, в мелких изделиях, где не видна полосатость, он похож на многие непрозрачные зеленые камни.[4] 1. 2. Формы нахождения малахита в природе на редкость разнообразны. Хорошо образованные кристаллы крайне редки и всегда мелки, (что весьма ценятся коллекционерами), спайность их совершенная по пинакоиду. Облик кристаллов призматический, игольчатый и волокнистый; отмечаются двойники. Чаще малахит встречается в виде землистых выделений и плотных натечных образований. Внутри сложен радиально расходящимися волокнами из грубых и крупных, вплоть до очень мелких чешуек. Радиально-лучистый рисунок часто совмещен с концентрически-полосчатой (зональной) окраской дающий на полированном срезе причудливый красивый рисунок. Встречаются тонковолокнистые разновидности, сноповидные, концентрически-слоистые, полицентричные, а также псевдосталактиты. Нередко загрязнен различными примесями, что снижает его декоративные качества. И наоборот - богат включениями (дендриты марганцевых минералов, зерна и волокна хризоколлы, шатукитта, азурита, элита, брошантита, черные примазки смоляной и медной руды), придающими ему еще большую декоративность.[4] Отдельные зерна, распределенные в породе, – так называемый землистый малахит, и мелкие скопления чистого малахита использовались для выработки высококачественной зеленой краски, «малахитовой зелени» (эту краску не следует путать с «малахитовым зеленым», который является органическим красителем, а с малахитом его роднит разве что цвет). У плотного малахита цвет ярко-зелёный, голубовато-зелёный до тёмного, иногда буро-зелёного. Изменение цвета по различным зонам и слоям почковидных масс малахита создаёт на срезах и полированных плоскостях очень красивый, причудливый рисунок. В природе встречается в поверхностной зоне окисления месторождений сульфидных медных руд. Большие скопления плотного малахита очень редки и образуются путём замещения известняков сульфатными растворами меди в зоне окисления крупных месторождений меди. Плотный малахит, несмотря на его кавернозность, чрезвычайно ценный поделочный камень. Различают два основных поделочных вида камня - радиально-лучистый и плотный. Первый за сходство с некогда распространенным хлопчатобумажным бархатом - плисом - назвали плисовым. Второй за кажущуюся однородность и холодный, чуть с синевой, зеленый цвет - бирюзовым. Более декоративную его разновидность выделили как узорчатый. Благодаря небольшой твердости (твердость по шкале Мооса 3-4) малахит легко обрабатывается: быстро режется, хорошо шлифуется и полируется, в руках умелого мастера принимает самую высокую зеркальную полировку. Обработанная поверхность непрочна - постепенно тускнеет и нуждается в обновлении.[5] Природный малахит Cu2(OH)2CO3 всегда образуется там, где есть залежи медных руд, если эти руды залегают в карбонатных породах — известняках, доломитах и др. Часто это сульфидные руды, из которых наиболее распространены халькозин (другое название — халькокит) Cu2S, халькопирит CuFeS2, борнит Cu5FeS4 или 2Cu2S·CuS·FeS, ковеллин CuS. При выветривании медной руды под действием подземных вод, в которых растворены кислород и углекислый газ, медь переходит в раствор. Этот раствор, содержащий ионы меди, медленно просачивается через пористый известняк и реагирует с ним с образованием основного карбоната меди — малахита. Иногда капельки раствора, испаряясь в пустотах, образуют натеки, нечто вроде сталактитов и сталагмитов, только не кальцитовых, а малахитовых. Все стадии образования этого минерала хорошо видны на стенках огромного меднорудного карьера глубиной до 300 — 400 м в провинции Катанга (Заир). Медная руда на дне карьера очень богатая — содержит до 60% меди (в основном в виде халькозина). Халькозин — темно-серебристый минерал, но в верхней части рудного пласта все его кристаллики позеленели, а пустоты между ними заполнились сплошной зеленой массой — малахитом много карбонатов. При встрече с халькозином они окисляли серу, а медь в виде основного карбоната оседала тут же, рядом с разрушенным кристалликом халькозина. Если же поблизости была пустота в породе, малахит выделялся там в виде красивых натеков[6]. Образуется малахит и на изделиях из меди и ее сплавов – латуни, бронзы. Особенно быстро такой процесс идет в больших городах, в которых воздух содержит оксиды серы и азота. Эти кислотные агенты, совместно с кислородом, углекислым газом и влагой, способствуют коррозии меди и ее сплавов, так как на воздухе медь покрывается рыхлым слоем основных карбонатов. При этом цвет образующегося на поверхности основного карбоната меди отличается землистым оттенком. Малахиту в природе часто сопутствует синий минерал азурит — медная лазурь. Это тоже основный карбонат меди, но другого состава — 2СuСО3·Сu(ОН)2. Азурит и малахит нередко находят вместе; их полосчатые срастания называют азуромалахитом. Азурит менее устойчив и во влажном воздухе постепенно зеленеет, превращаясь в малахит. Таким образом, малахит в природе вовсе не редок. Он покрывает даже старинные бронзовые вещи, которые находят при археологических раскопках. Более того, малахит часто используют как медную руду: ведь он содержит почти 56% меди. Однако эти крошечные малахитовые зернышки не представляют интереса для искателей камней. Более или менее крупные кристаллы этого минерала попадаются очень редко. Обычно кристаллы малахита очень тонкие — от сотых до десятых долей миллиметра, а в длину имеют до 10 мм, и только изредка, в благоприятных условиях, могут образоваться огромные многотонные натеки плотного вещества, состоящего из массы как бы слипшихся кристалликов. Именно такие натеки и образуют ювелирный малахит, который встречается очень редко[4]. Характерной особенностью африканского малахита являются мелкие правильные концентрические кольца (в отличие от колец неправильной формы у уральского малахита) с более контрастным чередованием светлых и тёмных зон. 1.3. Физические свойства. Название: основный карбонат меди, малахит, медная зелень, малахитовая зелень, плисовый малахит, атласная руда, павлиний камень, (CuOH)2CO3 - довольно хрупкий минерал. Цвет: варьирует от сочного темно-зеленого до светлого бирюзово-.зеленого. Непрозрачен, в мелких кристаллах просвечивает. В плотных почковидных агрегатах окраска обычно распределяется ритмично, с чередованием темных и светлых зон. Тонкоигольчатый (плисовый) и порошковатый агрегаты окрашены равномерно.Более или менее одноцветные куски встречаются редко. Твердость 3,5 – 4 по минералогической шкале; удельный вес 3,9 - 4, г; плотность 3,75 - 3,95 1 г/см; Излом: раковистый. Хрупкость: да Блеск: матовый, бархатистый, у плисового - шелковистый. Плотные лучистые агрегаты имеют красивый шелковистый блеск. Необработанному малахиту присущ слабый стеклянный блеск, но на свежем изломе и в прожилках блеск у него часто шелковистый[7] Сингония: моноклинная. Вид кристалла: призматический, пластинчатый, игольчатый. Кристаллы имеют тенденцию к расщепленю с образованием сферокристаллов, тонковолокнистых сферолитов, сфероидолитовых дендритов[10]. Кристаллы отмечаются редко, обычно призматические с гранями (100), (110), (010), (201). Развиты двойники по (100). Чаще всего наблюдается в виде корочек, сферокристаллов, натечных почковидных агрегатов радиально-лучистого, параллельно-шестоватого и зонально-концентрического строения. В кристаллической структуре малахита добавочные анионы (OH)1- связаны с ионами Cu2+, которые окружены в одной плоскости двумя ионами (OH)1- и двумя O2+, принадлежащими карбонат-аниону (СОз)2-. Примеси: известны Zn (замещает изоморфно Cu), а также CaO, SiO2, Fe2Oз и другие. 1.4. Химические свойства. Состав малахита отвечает формуле Cu2H2CO5. Всесторонние исследование привели к более содержательной формуле: Сu2 (ОН)2(СО3). С учетом современных знаний о составе ионных кристаллов мы можем записать формулу малахита: [CuOH]22+CO32Состав малахита различные авторы выражают идентично (имея в виду ионный состав кристалла): (CuOH)2CO3 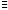 Cu2(CO3)(OH)2 Cu2(CO3)(OH)2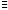 Cu2((OH)2CO3) Cu2((OH)2CO3) 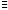 CuCO3∙Cu(OH)2 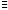 Cu2CO3(OH)2 Cu2CO3(OH)2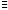 Cu2(OH)2CO3. Cu2(OH)2CO3.У Н.С.Ахметова – СuСО3•3Сu(ОН)2, у Д.И.Менделеева – СuO2H2CuCO3. Если иметь в виду кристаллическую структуру малахита, состав ионного кристалла наиболее полно и наиболее содержательно отражает такая запись: [Cu22+(OH-)2CO32-] С учетом электронно-ионных представлений формулу малахита можно представить таким образом: 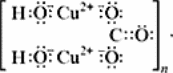 На схеме мы четко видим, что малахит – основный карбонат меди(II) (когда-то он так и назывался – основная углекислая медь). Данная запись отражает ионные взаимодействия. В реальном кристалле имеют место другие типы взаимодействий – водородная связь между гидроксильными ионами и донорно-акцепторное взаимодействие между ионом меди и кислородом гидроксила: 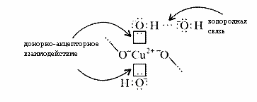 За счет этого достигается и плотная упаковка, и достаточно высокая механическая прочность, и небольшая твердость. На уровне ионно-структурных представлений химическое строение малахита (для структурных частиц – химическое строение, для твердого тела – строение ионного кристалла) можно отразить следующим образом: 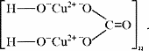 Следовательно, запись (CuOH)2CO3 – основная соль, дигидроксикарбонат меди(II) – наиболее полно отражает состав малахита. Рассмотрим реакцию разложения малахита: (CuOH)2CO3 →2CuO +H2O + CO2 В зависимости от этапа изучения химии она может быть описана: а)  б) на ионно-структурном уровне: 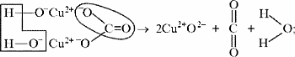 в) на электронно-ионном уровне: 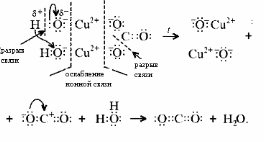 Знание свойств карбонатов и нерастворимых в воде оснований позволяет утверждать, что малахит будет растворяться в кислотах: 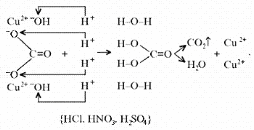 Примечание. Ион Н+ присоединяется к кислороду в составе гидроксид- и карбонат-ионов по донорно-акцепторному механизму: 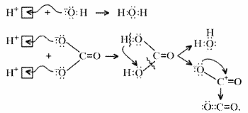 Малахит можно рассматривать как производное гидроксида меди(II), в котором часть гидроксильных ионов замещена на карбонат-ионы (таково, собственно, определение понятия «основная соль»). Кроме реакции с кислотами при определенных условиях он может реагировать с кислотными оксидами. Мысль совершенно невероятная, учитывая нерастворимость малахита в воде – главнейшее условие взаимодействия кислотных оксидов с основаниями, точнее со щелочами. Однако имеет место реакция: (CuOH)2CO3 + CO2 = CuCO3)2 + Н2О «Химические события» соответствуют такому механизму: 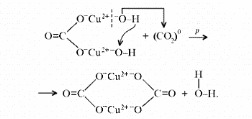 Обратим внимание на образование средней соли. Теперь считается доказанным, что карбонат меди(II) можно помещать в список солей угольной кислоты.[11] Малахит, как известно, не растворяется в воде, но может подвергаться гидролизу (из-за гидролиза, собственно, невозможно получить осадок среднего карбоната меди): 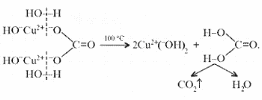 Из-за способности ионов меди образовывать комплексные ионы малахит растворяется, в частности, в карбонатах щелочных металлов: (CuOH)2CO3 + K2CO3 = K2[Cu(CO3)2] + Cu(OH)2. темно-синий Теоретическим обоснованием этому может служить запись: 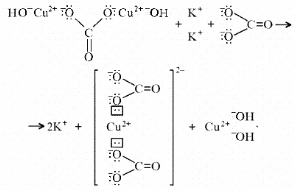 Схема генетических связей: образование и свойства малахита.
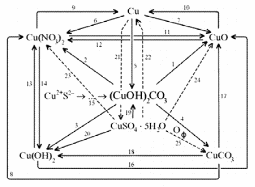
1. Разложение малахита. 2. Растворение малахита в кислотах. 3. Гидролиз малахита. 4. Реакция с углекислым газом. 5. Коррозия меди на воздухе (образование зеленого налета на медных предметах во влажном воздухе): 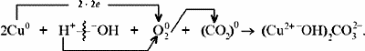 6. Растворение меди в азотной кислоте. 7. Прокаливание меди на воздухе. 8. Взаимодействие твердого тела карбоната меди(II) c крепким раствором азотной кислоты. 9. Восстановление меди из ее соли более активным металлом или в результате электролиза. 10. Восстановление меди из ее оксида водородом или другим удобным восстановителем (монооксид углерода, древесный уголь). 11. Нагревание твердого тела нитрата меди(II) до полного разложения. 12. Растворение оксида CuO в концентрированной азотной кислоте. 13. Нейтрализация основания Cu(OH)2 азотной кислотой. 14. Взаимодействие нитрата меди(II) с раствором щелочи. 15. Образование малахита в природных условиях. В самых общих чертах генезис сложных геохимических процессов можно представить так: 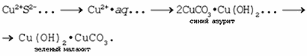 16. Нагревание твердого вещества Cu(ОН)2 (несильно, чтобы не перевести оксид CuO в оксид Cu2O) до полного разложения. 17. Нагревание CuCO3 до полного разложения на CuO и СО2. 18. Гидролиз карбоната меди(II). 19. Получение порошкообразного малахита в лабораторных условиях. Формально химизм образования дисперсного малахита можно выразить следующими уравнениями: 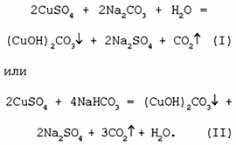 Однако это именно тот случай, когда «гладко пишутся бумаги, а кругом одни овраги». Химизм образования малахита, если рассматривать его по стадиям, не может быть однозначно представленным, здесь допускается вариативность мышления. Последовательность превращений для уравнения (I): 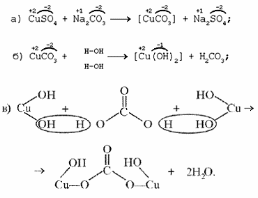 Последовательность ионных превращений для уравнения (II): 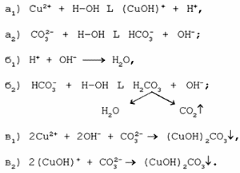 Этим и объясняется слоистая структура минерала. Концентрация ионов (СuОН)+, (FеОН)+, (ZnОН)+, Са2+, СО32-, РО43- при совместном присутствии в растворах минералов непостоянная. Поэтому испарение воды ведет к образованию своеобразного рисунка и различной величины кристаллов. 20. Взаимодействие сульфата меди(II) со щелочью аналогично п. 14. 21. Медную стружку обрабатывают концентрированной серной кислотой при несильном нагревании. Образовавшийся раствор упаривают до начала кристаллизации. 22. Восстановление меди из сульфата меди(II) аналогично п. 9. 23.К раствору сульфата меди(II), который образуется при растворении в воде медного купороса, приливают раствор нитрата бария. Над образующимся осадком сульфата бария будет находиться раствор нитрата меди, который можно или декантировать, или отделить фильтрованием. 24. Если прогревать медный купорос в фарфоровой чашке, то постепенно будет происходить не только обезвоживание кристаллогидрата, но и разложение сульфата до оксида меди, сернистого газа и кислорода. 25. Знак 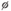 (пустое множество) обозначает, что данную реакцию осуществить невозможно. (пустое множество) обозначает, что данную реакцию осуществить невозможно.Механизм образования малахита в близком к истине приближении видится таким (исходные и включающиеся в процесс вещества взяты в рамки): 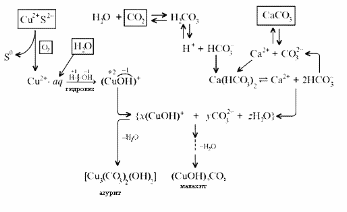 Образование малахита из азурита поддается объяснению, если учесть, что нерастворимые ионные кристаллы не абсолютно нерастворимы: 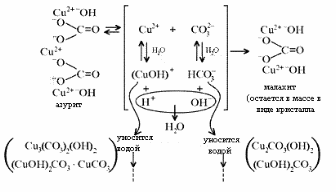 [8] [8]1. 5. Искусственный малахит. Существует несколько способов получения искусственных минералов. Один из них – это создание композитных материалов спеканием порошка природного минерала в присутствии инертного связующего при высоком давлении. При этом происходит много процессов, из которых главные – это уплотнение и перекристаллизация вещества. Этот метод получил широкое распространение в США для получения искусственной бирюзы. Так же были получены жадеит, лазурит, другие полудрагоценные камни. В нашей стране композиты получали цементированием мелких обломков природного малахита размером от 2 до 5 мм с помощью органических отвердителей (наподобие эпоксидных смол) с добавлением в них красителей соответствующего цвета и тонкого порошка того же минерала в качестве наполнителя. Рабочую массу, составленную из указанных компонентов в определенном процентном отношении, подвергали сжатию при давлениях до 1 ГПа (10000 атм.) при одновременном нагревании свыше 100° С. В результате различных физических и химических процессов происходило прочное цементирование всех компонентов в сплошную массу, которая хорошо полируется. За один рабочий цикл таким образом получают четыре пластинки со стороной 50 мм и толщиной 7 мм. Правда, их довольно легко отличить от природного малахита. Другой возможный способ – гидротермальный синтез, т.е. получение кристаллических неорганических соединений в условиях, моделирующих процессы образования минералов в земных недрах. Он основан на способности воды растворять при высоких температурах (до 500° С) и давлениях до 3000 атм. вещества, которые в обычных условиях практически нерастворимы – оксиды, силикаты, сульфиды. Ежегодно этим способом получают сотни тонн рубинов и сапфиров, с успехом синтезируют кварц и его разновидности, например, аметист. Именно этим способом был получен малахит, почти не отличающийся от природного. При этом кристаллизацию ведут в более мягких условиях – из слабощелочных растворов при температуре около 180°С и атмосферном давлении[5]. Сложность получения малахита в том, что для этого минерала главное – не химическая чистота и прозрачность, важная для таких камней как алмаз или изумруд, а его цветовые оттенки и текстура – неповторимый рисунок на поверхности отполированного образца. Эти свойства камня определяются размером, формой, и взаимной ориентацией отдельных кристалликов, из которых он состоит. Одна малахитовая «почка» образована серией концентрических слоев разной толщины – от долей миллиметра до 1,5 см разных оттенков зеленого цвета. Каждый слой состоит из множества радиальных волокон («иголочек»), плотно прилегающих друг к другу и подчас неразличимых простым глазом. От толщины волокон зависит интенсивность цвета. Например, тонкокристаллический малахит заметно светлее крупнокристаллического, поэтому внешний вид малахита, как природного, так и искусственного, зависит от скорости зарождения новых центров кристаллизации в процессе его образования. Регулировать такие процессы очень трудно; именно поэтому этот минерал долго не поддавался синтезу. Получить искусственный малахит, не уступающий природному, удалось трем группам российских исследователей – в Научно-исследовательском институте синтеза минерального сырья (город Александров Владимирской области), в Институте экспериментальной минералогии Российской Академии наук (Черноголовка Московской области) и в Петербургском государственном университете. Соответственно было разработано несколько методов синтеза малахита, позволяющих получить в искусственных условиях практически все текстурные разновидности, характерные для природного камня – полосчатые, плисовые, почковидные. Отличить искусственный малахит от природного можно было разве что методами химического анализа: в искусственном малахите не было примесей цинка, железа, кальция, фосфора, характерных для природного камня. Разработка методов искусственного получения малахита считается одним из наиболее существенных достижений в области синтеза природных аналогов драгоценных и поделочных камней. Так, в музее упомянутого института в Александрове стоит большая ваза, изготовленная из синтезированного здесь же малахита. По всем своим свойствам синтетический малахит способен заменить природный камень в ювелирном и камнерезном деле. Его можно использовать для облицовки архитектурных деталей как внутри, так и снаружи зданий. Искусственный малахит с красивым тонкослоистым рисунком производится также в Канаде, в ряде других стран. II. Практическая часть. 2.1. Получение малахита. Получение малахита по приведенному ниже методу является наиболее простым и удобным. Преимущество заключается в том, что эксперимент не требует много времени, используются доступные реагенты, причем в небольшом количестве, а так же обеспечивается высокий процент практического выхода. Для получения малахита (Cu2(OH)2CO3) необходимо: 1)Реактивы: NaHCO3 – 4,065 г. CuSO4·5H2O – 5,5 г. 2) Приборы: Фарфоровая ступка с пестиком – 1, термический стакан – 250 мл, штатив, стеклянная палочка – 2, воронка Бюхнера – 1, колба Бунзана – 1, фильтровальная бумага, пробирка, горелка. Ход работы. В фарфоровой ступке смешали 5,5 г. тонко стёртой сухой соли CuSO4 ·5H2O с гидрокарбонатом натрия 4,065 г. В стакане нагрели до кипения 100 мл. воды. Смесь высыпали небольшими порциями в кипящую воду, быстро перемешивая. При этом наблюдается вспенивание. Следующую порцию смеси вносили после прекращения вспенивания. Содержимое стакана кипятили 10-15 мин для удаления из раствора СО2. В результате реакции образуется гидроксокарбонат меди: 2CuSO4 + 4NaHCO3 = CuCО3·Cu(OH)2↓ + 2Na2SO4+3CO2↑ + H2O. (*) Осадку давали отстояться, затем промывали декантацией горячей водой, отмывая от иона SO42-; делали пробу на полноту промывания (4 раза). Основную соль сушили между листьями фильтровальной бумаги, а затем высушивали в сушильном шкафу при температуре около 40-60°С. Расчёт и материальный баланс. Массы исходных веществ: m (NaHCO3)=4,065г m (CuSO4*5Н2О)=5,5г Вычислим их количество:  (NaHCO3) = 4,065/84=0,048 моль (NaHCO3) = 4,065/84=0,048 моль (CuSO4*5Н2О) =5,5/249=0,024 моль (CuSO4*5Н2О) =5,5/249=0,024 мольПо уравнению (*) найдем количество малахита:  (малахита) =0,011 моль (малахита) =0,011 мольmтеор (малахита) =0,011 * 222=2,442 г Рассчитаем практический выход продукта: mпракт (малахита)пр=2,21 г  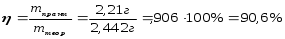 В результате мною было получено 2,21г малахита. Практический выход составил 90,6% Проведем качественные реакции на обнаружение иона меди Cu2+ . Для этого насыпем малахит в три пробирки: В первую пробирку добавим избыток раствора карбоната натрия, наблюдаем появление красивой синей окраски раствора: Cu2(OH)2CO3 + Na2CO3 = Na2[Cu(CO3)2] + Cu(OH)2↓. Во вторую прильем уксусную кислоту: (CuOН)2CO3+ 4CH3СООН = 2Cu(CH3COO)2+ CO2↑ + ЗH2O. К третьей добавим аммиак, который окрашивает при этом раствор в красивый темно-синий цвет: Cu2(OH)2CO3 + 8NH3 = [Cu(NH3)4]CO3 + [Cu(NH3)4](OH)2. К четвертой пробирке прильем концентрированный раствор HCl. Окраска станет ярко-зеленой: Сu2(ОН)2СО3 + 2HCl = 2CuCl2 + CO2↑ + H2O. Пятую пробирку нагреем над пламенем горелки. Наблюдаем выделение газа и образование черного осадка: Сu2(ОН)2СО3=2CuO↓ + CO2↑+ H2O. 2. 2. Вывод. При выполнении практической части я сократила количество используемых веществ в 2 раза по сравнению с методикой получения, так как в лаборатории находится малое количество данных реагентов. В результате опыта мной было получено 2,21г порошкообразного малахита. Практически выход продукта составил 90,6% от теоретического, что удовлетворяет поставленной цели. Потери вещества произошли во время промывания а также при высушивании на фильтровальной бумаге. Список литературы Малахит. БСЭ, т. 15, с. 276; Ферсман А.Е. "Рассказы о самоцветах" Л., Детгиз, 1952. Марченков В.И. Ювелирное дело. М.: Высшая школа, 1975, с. 37; М., 1982; Здорик Т.Б., Фельдман Л.Г. Минералы и горные породы, т. 1. М, «ABF», 1998 г.; Степин Б.Д., Аликберова Л.Ю. Книга по химии для домашнего чтения. М., Химия, 1994.; Г.Смит. Драгоценные камни. М., «Мир», 1980; http://www.velund.ru/2008/04/15/malakhit.html физ свва http://him.1september.ru/articlef.php?ID=200300705 Карякин Ю.В., Ангелов И.И. «Чистые химические вещества», Издательство «Химия», Москва, 1974 г.; Реми Г. «Курс неорганической химии» том 1. Издательство «Химия», Москва 1967 г.; Подчайнова В.Н., Медь, М., Свердловск: Металургиздат, 1991. – 249с.; |