ЮЮЮf%20(1). Курсовая работа технология изготовления и контроль качества лекарственных форм, содержащих эритромицин 33. 02. 01 Фармация
 Скачать 77.68 Kb. Скачать 77.68 Kb.
|
|
Автономная некоммерческая негосударственная профессиональная образовательная организация «Уральский медицинский колледж» КУРСОВАЯ РАБОТА Технология изготовления и контроль качества лекарственных форм, содержащих ЭРИТРОМИЦИН 33.02.01 Фармация ПМ.02 Изготовление лекарственных форм и проведение обязательных видов внутриаптечного контроляРуководитель работы _________ / Чудинова Ю.С. ___ _______ 20___ г. Автор работы обучающийся группы ФУ2-21 _________ / Портнова Ю. А. ___ _________ 20___ г. Нормоконтроль _________ / Чудинова Ю.С. ___ _________ 20___ г. Челябинск, 2022 СОДЕРЖАНИЕПМ.02 Изготовление лекарственных форм и проведение обязательных видов внутриаптечного контроля 1 ВВЕДЕНИЕ 1 ГЛАВА 1.ОБЗОР ЛИТЕРАТУРНЫХ ИСТОЧНИКОВ 2 1.1Характеристика антибактериальных препаратов 2 1.2. Классификация и свойства эритромицина 9 1.3. Характеристика мазей как лекарственной формы 12 1.4 Контроль качества лекарственной формы 18 ГЛАВА 2. ТЕХНОЛОГИЯ ИЗГОТОВЛЕНИЯ И КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ ФОРМ С ЭРИТРОМИЦИНОМ 21 2.1 Технология изготовления мази для наружного применения 21 2.2 Технология изготовления назальной мази 22 ЗАКЛЮЧЕНИЕ 24 СПИСОК ЛИТЕРАТУРЫ 25 ПРИЛОЖЕНИЕ 27 ВВЕДЕНИЕВся производственная деятельность аптеки должна быть направлена на обеспечение высококачественного изготовления лекарственных средств. Одним из важнейших факторов, определяющих качество лекарственных средств, изготовляемых в аптеке, является организация внутриаптечного контроля. Внутриаптечный контроль – это комплекс мероприятий, направленных на своевременное выявление и предупреждение ошибок, возникающих в процессе изготовления, оформления и отпуска лекарств. Лекарства аптечного производства подвергаются нескольким видам контроля в зависимости от характера лекарственной формы. Система внутриаптечного контроля качества лекарственных средств предусматривает проведение предупредительных мероприятий, приемочного, органолептического, письменного, опросного, физического, химического контроля и контроля при отпуске. Все лекарственные средства подвергаются внутриаптечному контролю: органолептическому, письменному и контролю при отпуске – обязательно, опросному и физическому – выборочно, а химическому – исходя из вида лекарственной формы. Актуальность данной темы: необходимость внутриаптечного контроля обусловлена соответствующими высокими требованиями к качеству лекарственных средств, изготовляемых в аптеках. Объект исследования – технология изготовления и контроль качества лекарственных форм. Предмет исследования – технология изготовления и контроль качества лекарственных форм, содержащих эритромицин. Цель работы – изучить технологию изготовления и контроль качества лекарственных форм, содержащих эритромицин. Задачи: 1. Изучить общую характеристику антибактериальных препаратов. 2. Рассмотреть свойства эритромицина как лекарственного вещества. 3. Произвести на практике изготовление лекарственных форм с эритромицином. 4. Провести внутриаптечный контроль изготовленных лекарственных форм. ГЛАВА 1.ОБЗОР ЛИТЕРАТУРНЫХ ИСТОЧНИКОВХарактеристика антибактериальных препаратов Антибиотики - это все лекарственные препараты, подавляющие жизнедеятельность возбудителей инфекционных заболеваний, таких, как грибки, бактерии и простейшие. Микроорганизмы синтезируют антибиотики для борьбы против других микробов. Способность некоторых микроорганизмов подавлять в окружающей их среде рост и размножение других микробов открыл Л. Пастер, который назвал это явление антибиозом. На возможность практического использования антибиоза впервые указал И.И. Мечников. Систематическим изучением явлений антибиоза занимался английский фармаколог А. Флеминг. В 1928 г. он случайно обнаружил, что в культуре золотистого стафилококка, загрязненной зеленой плесенью Penicillinum notatum, вокруг колоний грибов не происходит роста стафилококков. А. Флеминг доказал, что это явление зависит от выделения плесневыми грибами в окружающую среду какого-то вещества, которое он назвал пенициллином. В практическом направлении работы по изучению антибиотиков широко развернулись в годы Второй мировой войны, когда возникла острая необходимость в мощных противомикробных средствах для лечения и быстрейшего возвращения в строй огромного количества раненых. В эти годы были изучены методы очистки пенициллина и разработаны способы его промышленного производства. В результате проведенных исследовательских работ было выяснено, что микроорганизмы, производящие антибиотики, широко распространены в природе: продуценты антибиотиков были выявлены не только среди плесневых грибов, но и среди очень многих лучистых грибов (Streptomyceta), обитающих в почве, а также среди некоторых бактерий [7, c. 33]. Антибиотики занимают особое место в современной медицине. Они являются объектом изучения различных биологических и химических дисциплин. За последние 35 лет открыто около 100 антибиотиков с различным спектром действия, однако в клинике применяется ограниченное число препаратов. Это объясняется главным образом тем, что большинство антибиотиков не удовлетворяют требованиям практической медицины. Медицина предъявляет следующие основные требования к антибиотикам: - высокая избирательность антимикробного эффекта в дозах, нетоксичных для организма; - отсутствие или медленное развитие резистентности возбудителей к препарату в процессе его применения; - сохранение антимикробного эффекта в жидкостях организма и тканях, отсутствие или низкий уровень инактивации белками сыворотки крови, тканевыми энзимами; - хорошее всасывание, распределение и выведение препарата, обеспечивающие терапевтические концентрации в крови, тканях и жидкостях организма, которые должны быстро достигаться и поддерживаться в течение длительного периода; при этом особое значение имеет создание высоких концентраций в моче, желчи, кале, очагах поражения; - удобная лекарственная форма для различных возрастных групп и локализации процесса, обеспечивающая максимальный эффект и стабильность в обычных условиях хранения [9, c. 86]. Характер действия антибиотиков может быть бактерицидным, под которым понимается полное разрушение клетки инфекционного агента, и бактериостатическим, т.е. прекращение деления его клеток. Каждый антибиотик может подавлять ряд метаболических реакций в зависимости от его концентрации в среде, причем с увеличением концентрации антибиотика затрагивается все большее число метаболических процессов микробной клетки. Блокирование одной из реакций может привести вторично к подавлению других процессов обмена, что обусловливает множественность точек приложения антимикробного действия препаратов. На этой основе может быть построена классификация антибиотиков как специфических ингибиторов некоторых биохимических процессов, происходящих в микроорганизмах и опухолевых клетках. По механизму воздействия на микробную клетку антибиотики подразделяют на 6 отдельных классов: 1. Специфические ингибиторы синтеза клеточной стенки микроорганизмов. β-лактамные антибиотики - пенициллины и цефалоспорины. Антибиотики группы ванкомицина. 2. Антибиотики, нарушающие молекулярную организацию и функции клеточных мембран. Полимиксины. Полиены. 3. Антибиотики, подавляющие синтез белка на уровне рибосом. Хлорамфеникол. Макролиды (эритромицин, олеандомицин). Линкомицин. Фузидин. Тетрациклины. 4. Ингибиторы синтеза РНК на уровне РНК-полимеразы. Рифамицины. 5. Ингибиторы синтеза РНК на уровне ДНК-матрицы. Актиномицины. Антибиотики группы ауреоловой кислоты. 6. Ингибиторы синтеза ДНК на уровне ДНК-матрицы. Митомицин С. Антрациклины. Блеомицины. В медицине применяются 2 класса препаратов - энтерального и парентерального способа применения [6, c. 86]. Достоинства парентеральных форм антибиотиков: - возможность создания депо препарата (под кожу); - 100% биодоступность (вводится внутривенно); - быстрое создание максимальной концентрации в крови; - отсутствие существенного воздействия на микрофлору ЖКТ. Недостатки парентеральных форм антибиотиков: - болезненное введение; - техническая сложность применения. Недостатки энтеральных форм антибиотиков: - зависимость от моторики ЖКТ; - проблема точности дозирования; - отрицательное воздействие на микрофлору ЖКТ. Существует несколько энтеральных лекарственных форм антибиотиков: таблетки, сиропы, растворы, свечи, капли, аэрозоли, мази и линименты. Данные лекарственные формы имеют достоинства и недостатки (таблица 1). Таблица 1. Достоинства и недостатки различных лекарственных форм с антибиотиками
Лекарственные препараты, в состав которых входят антибиотики, представлены, как правило, инъекционными лекарственными формами, пероральными, ректальными и вагинальными. В экстемпоральной рецептуре аптек с антибиотиками готовят лекарственные формы в основном для наружного применения: глазные капли, примочки, капли для уха, носа, мази, суппозитории, порошки (присыпки). Неизменность химического состава, физического состояния и фармакологического действия антибиотиков должны сохраняться как при приготовлении лекарственных препаратов, так и во время их хранения и применения больными [5, c. 75]. Требования, предъявляемые к лекарственным формам с антибиотиками: — приготовление должно проводиться в асептических условиях. Это связано с тем, что антибактериальная активность антибиотиков снижается под влиянием микроорганизмов или их ферментов; — вид лекарственной формы должен обеспечивать стабильность антибиотика как в процессе технологии, так и при хранении; — лекарственная форма должна обеспечивать необходимую концентрацию антибиотика в макроорганизме при его минимальной дозировке. Расчеты антибактериальной активности антибиотиков. Антибактериальная активность антибиотиков выражается в единицах действия (ЕД), соответствующих определенным весовым частям химически чистого препарата, что устанавливается методом биологической стандартизации. У некоторых антибиотиков (стрептомицин, эритромицин и др.) единица действия соответствует 1 мкг химически чистого препарата в виде основания, кислоты или соли. Сложные порошки с антибиотиками находят применение в хирургической, дерматологической и стоматологической практике. Их готовят по общим правилам приготовления сложных порошков с учетом свойств входящих ингредиентов [7, c. 64]. Жидкие лекарства с антибиотиками назначают для внутреннего (растворы, суспензии, реже — эмульсии) и наружного (капли в нос, примочки, глазные капли) применения. Из лекарств для наружного применения 1/3 приходится на глазные капли. В качестве растворителей используют воду очищенную, спирт, глицерин, растительные масла. Растворы готовят по общим правилам приготовления. Особенность — соблюдение асептических условий. Необходимо избегать фильтрования растворов через обычную фильтровальную бумагу. При приготовлении мазей с антибиотиками особое внимание следует обращать на состав основы и способ введения антибиотиков. Наиболее стабильны мази, приготовленные на безводных основах. Считается, что наиболее подходящая основа для глазных мазей смесь, состоящая из вазелина — 9,0 г («Для глазных мазей») и ланолина безводного — 1,0 г. Возможны и другие сочетания: смесь из 4 частей ланолина безводного и 6 частей вазелина («Для глазных мазей»); основа состава: парафина 30,0 г, масла подсолнечного 70,0 г. Предложены также полиорганосилоксановые основы (силиконы). Пенициллин на таких основах сохраняется длительное время (до трех месяцев и более). Все основы для мазей с антибиотиками используются только после их стерилизации. Хранятся в баночках по 10,0 г. Мази с антибиотиками готовят в асептических условиях с соблюдением общих правил приготовления мазей. 1.2. Классификация и свойства эритромицина Эритромицин относится к группе макролидов. Общие свойства: - бактериостатическое действие; - сравнительно низкая токсичность; - преимущественная активность против грамположительных кокков (стрептококки, стафилококки); - высокая активность против небактериальных возбудителей (микоплазмы, хламидии, спирохеты) [8, c. 74]. Основу химической структуры антибиотиков-макролидов составляет макроциклическое лактонное кольцо с 12-17 атомами углерода в цикле. Из этой группы антибиотиков в медицинской практике наиболее широко применяют природный антибиотик эритромицин и его полусинтетический аналог азитромицин. Их можно отнести к группе родственных стрептомицину антибиотиков-аминогликозидов, так как макроциклическое лактонное кольцо -гликозидной связью соединено с аминосахарами и нейтральными сахарами. Характерно, что сахарные компоненты эритромицинов подобны сахарам, входящим в состав сердечных гликозидов. Эритронолиды по химическому строению представляют собой циклическую систему, состоящую из 13 углеродных атомов и включающую лактонные кольца (полигидроксилактоны): 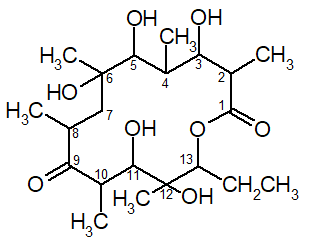 Рисунок 1. Эритронолид А От эритронолида A эритронолид B отличается отсутствием гидроксила в положении 12, а эритронолид C — только пространственным расположением некоторых функциональных групп. Эритромицин продуцируют Streptomyces erythreus или другие родственные микроорганизмы [6, c. 86]. 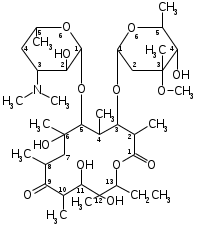 Рисунок 2. Эритромицин Эритромицин представляет собой кристаллы или порошок белого или белого с желтоватым оттенком цвета. Гигроскопичен. Удельное вращение от –71о до –78о (2%-ный раствор в абсолютном этиловом спирте). Для установления подлинности эритромицина снимают ИК-спектры, которые в области 4000-400 см–1 должны быть идентичны соответствующим ИК-спектрам ГСО. Методом ТСХ испытание на подлинность выполняют на хроматографических пластинках Сорбфил, нанося на них соответственно растворы эритромицина и ГСО. Полученные основные пятна на пластинке должны быть идентичны у испытуемых антибиотиков и ГСО. Установить наличие эритромицина A в присутствии эритромицинов B и C можно с помощью электрофореза на бумаге. Эритромицин обнаруживают также цветными реакциями. При растворении в ацетоне и концентрированной хлороводородной кислоте раствор приобретает оранжевое окрашивание, переходящее в красное, а затем в фиолетово-красное. К окрашенному раствору приливают хлороформ и перемешивают. После отстаивания хлороформный слой приобретает фиолетовый цвет. С концентрированной серной кислотой эритромицин образует красно-коричневое окрашивание, а при нагревании на водяной бане с ксантгидролом — красное. Методом ГЖХ определяют содержание примесей остаточных растворителей — в эритромицине не должно быть бутилацетата [6, c. 89]. Методом ТСХ по значению Rf в эритромицине устанавливают содержание примеси ангидроэритромицина. Методом ВЭЖХ определяют сумму эритромицинов A, B, C, используя метод внутренней нормализации. Расчёт ведут по отношению к содержанию в ГСО эритромицина A (сумма эритромицинов должна быть не менее 93%, в т. ч. эритромицинов B и C — не более 5%). Биологическую активность эритромицина и азитромицина определяют методом диффузии в агар с тест-микробом Bacillus cereus (ГФ XIV, в. 2, с. 210). Хранят эритромицин в защищённом от света месте при комнатной температуре. Эритромицин – антибиотик широкого спектра действия. Эритромицин и эритромицина фосфат применяют при различных инфекционных заболеваниях дыхательных путей, септических состояниях и гнойно-воспалительных процессах кожи и мягких тканей. Назначают внутрь по 0,25 г (4-6 раз в день) в виде таблеток или в капсулах, а эритромицина фосфат вводят в виде растворов внутривенно по 0,05, 0,1 или 0,2 г [10, c. 86]. Недостатком эритромицина является быстрота появления резистентных форм микроорганизмов. Особенности технологии изготовления лекарственных форм макролидов. Эритромицин практически нерастворим в воде, поэтому в виде растворов не применяется. Еще одним недостатком эритромицина является 90% инактивация в кислой среде желудочного сока. Поэтому порошки для внутреннего применения неэффективны. Наиболее часто в фармации изготавливают: - свечи по 0,06 и 0,125 г; - мазь 10 тыс. ЕД/г; - флаконы по 0,05; 0,1 и 0,2 г в виде порошка. 1.3. Характеристика мазей как лекарственной формыМази – мягкая лекарственная форма, предназначенная для нанесения на кожу, раны и слизистые оболочки. По типу дисперсных систем различают мази гомогенные (сплавы, растворы), гетерогенные (суспензионные, эмульсионные) и комбинированные. По консистенции мази подразделяются на собственно мази, кремы, гели, пасты, линименты [11, c. 98]. Мази – собственно мази — мягкая лекарственная форма, состоящая из основы и равномерно распределенных в ней действующих веществ. Кремы – мази мягкой консистенции, приготовленные на эмульсионной основе типа масло/вода или вода/масло, или множественные эмульсии. Гели – мази, в которых для получения основы используются гелеобразователи природного и синтетического происхождения. Обладают упругопластичной консистенцией и способны сохранять свою форму. Пасты – мази плотной консистенции суспензионного или комбинированного типа, содержание порошкообразных веществ в которых превышает 25 %. Линименты – это жидкие мази. В зависимости от назначения различают мази дерматологические, глазные, назальные, ушные, ректальные, вагинальные, уретральные и др. В зависимости от основы выделяют мази на: — гидрофобной основе; — гидрофильной основе; — эмульсионной основе; — многофазной основе [4, c. 79]. В аптеках мази готовят по магистральным прописям – ex tempore. Изготовление складывается из следующих стадий: - подготовительные работы: - введение лекарственных веществ в основу (плавление, растворение, измельчение, смешивание, эмульгирование); - оценка качества мазей; - упаковка и оформление. Подготовительные работы включают: отвешивание лекарственных веществ, основы или ее отдельных компонентов, подготовку посуды, вспомогательного материала. Расплавление компонентов основы может производиться непосредственно в ступке или выпарительной чашке. Сплавляют компоненты основы в выпарительных чашках на водяной бане или под лампой инфракрасного излучения. Сплавление начинают с тугоплавких компонентов, добавляя к расплаву компоненты в порядке снижения их температур плавления. Смешивание лекарственных веществ с основой производят в ступках. При изготовлении мазей в больших количествах применяют установку УПМ-1, миксеры различной конструкции [6, c. 98]. Небольшие количества мазей помещают в баночки из стекла или полистирола емкостью от 10,0 до 100,0 с навинчивающимися крышками из полимерных материалов. Расфасовывают с помощью наполнительной машины, применяемой для фасовки кремов и других машин-дозаторов (УФМ-2). Удобной упаковкой для мазей могут быть тубы. Они изготавливаются из алюминия определенных марок или полимерных материалов. Внутренняя поверхность металлических туб должна быть покрыта лаком, а наружная –эмалевой краской, на которую наносится маркировка. Металлические тубы могут быть различной емкости (от 2,5 до 40,0). В качестве полимерных материалов для изготовления туб используют: полиэтилен, полипропилен, поливинилхлорид и др. Носик тубы закрывают колпачком-бушоном. На заводах для наполнения туб используют тубонаполнительные машины или машины-дозаторы. Для удобства применения глазных, вагинальных, уретральных и ректальных мазей в пеналы с тубой вкладывают наконечники, изготовленные из пластмассы, которые после снятия бушона навинчивают на тубу. Хранят мази в прохладном, защищенном от света месте. Следует строго соблюдать условия хранения мазей. Неблагоприятно сказывается на качестве мазей влага, свет, перепад температуры и др. Учитывая характер распределения лекарственных веществ в основе и природу основы, мази подразделяют на две группы: гомогенные и гетерогенные [8, c. 93]. Гомогенные мази состоят из взаиморастворимых, смешивающихся ингредиентов и подразделяются на: мази-растворы, мази-сплавы, экстракционные мази. Мази-растворы образуются при растворении камфоры, ментола, фенилсалицилата и др. жирорастворимых веществ в липофильных основах – вазелине, восках, ланолине, или водорастворимых веществ – новокаина, димедрола, эфедрина гидрохлорида в гидрофильных основах (гелях МЦ, ПЭО, Na-КМЦ и др.). Концентрация лекарственного вещества не должна превышать предела его растворимости в данной основе. Примером может служить камфорная мазь 10% на гидрофобной основе состава: вазелина (54%), парафина (8%), ланолина безводного (28%). Мази-сплавы получают путем сплавления углеводородов, жиров, смол, восков и т. д. К ним относятся спермацетовая мазь, нафталанная мазь состава: нафталанской нефти (70%), парафина (18%), петролатума (12%). Экстракционные мази получают путем экстрагирования растительным маслом лекарственного растительного сырья с последующим загущением аэросилом, воском, парафином, ланолином безводным до необходимой консистенции [14, c. 97]. Гетерогенные мази подразделяются на суспензионные, эмульсионные, комбинированные. В состав суспензионных мазей входят лекарственные вещества, нерастворимые ни в основе, ни в воде. Примером таких мазей являются: мазь цинка оксида 10%, мазь метилурациловая 10%, мазь стрептоцидовая 10%, мазь серная простая 33% и др. В виде суспензий вводят водорастворимые лекарственные вещества, выписанные в количествах более 5%; вещества, разлагающиеся в присутствии воды (пенициллин и др.), а также цинка сульфат, резорцин (кроме глазных мазей). Эмульсионные мази характеризуются наличием жидкой дисперсной фазы, не растворимой в основе. В качестве дисперсной фазы могут быть как жидкости (настойки, перекись водорода, жидкость Бурова, адреналина гидрохлорид и др.), так и растворы лекарственных веществ (соли алкалоидов и др.). Такие вещества как колларгол, протаргол, растительные экстракты обязательно вводят в мази в виде водных растворов, иначе они не оказывают терапевтического действия. Примером эмульсионной мази является мазь «Календула» состава: настойки календулы 10,0, эмульсии консистентной вода / вазелин 90,0. Комбинированные мази содержат различные по своей природе лекарственные и вспомогательные вещества. При их изготовлении руководствуются принципами изготовления мазей отдельных типов [15, c. 143]. Правила введения лекарственных веществ в основу: 1. Если количество вещества, нерастворимого в основе, составляет до 5% по отношению к массе мази, то его растирают с родственной основе жидкостью (вазелиновое, растительное масло или вода). Для достижения лучшего эффекта диспергирования количество жидкости должно быть равно ½ массы лекарственного вещества (правило Дерягина). 2. Если количество вещества, нерастворимого или труднорастворимого в основе составляет более 5% по отношению к массе мази, то вещество растирают с частью расплавленной основы по правилу Дерягина, затем добавляют остатки основы. 3. Суспензионные мази, содержащие более 25% твердых лекарственных веществ называются пастами. Например, салицилово-цинковая паста состава: салициловой кислоты 2,0, цинка оксида 25,0, крахмала 25,0 и вазелина 48,0. Пасты изготавливаются по правилу (2), только основу расплавляют всю и добавляют ее в два приема. 4. Вещества, растворимые в воде, растворяют минимальном количестве воды (несколько капель), а затем частями добавляют мазевую основу, энергично перемешивая пестиком до однородного состояния. Медицинские растворы, настойки добавляют частями к готовой мази в последнюю очередь. 5. Сплавление компонентов основы в мазях-сплавах начинают с более тугоплавкого вещества, добавляя остальные вещества по мере уменьшения температуры их плавления. Полученный сплав перемешивают до полного охлаждения. 6. Вязкие пахучие (винилин, скипидар), красящие вещества (ихтиол, деготь) добавляют к готовой мази в последнюю очередь [12, c. 77]. 1.4 Контроль качества лекарственной формыВ зависимости от состава суппозиториев и свойств входящих в них лекарственных и вспомогательных веществ суппозитории могут быть изготовлены тремя способами: ручного формирования, выливания в формы или прессования. Например, в современных автоматизированных линиях производства суппозиториев упаковка одновременно служит формой для выливания. Способ разлива в формы наиболее часто используется в промышленном производстве, так как является наиболее производительным, гигиеничным и обеспечивает стандартность формы и размера свечей. Фармацевтическими факторами, в наибольшей мере влияющими на биологическую доступность суппозиториев, являются характер вспомогательных веществ и способ введения лекарственных веществ в суппозиторную основу. Так, например, системный или местный характер действия свечей полностью определяется выбором вспомогательных веществ, а степень дисперсности лекарственных веществ и способ их введения в основу определяет характер высвобождения лекарственных веществ [3, c. 98]. Контроль качества суппозиториев предусматривает: 1. Контроль упаковки, маркировки и сроков годности. 2. Контроль формы и ее соответствия пути введения. 3. Контроль средней массы и отклонений массы отдельных суппозиториев от средней массы. 4. Определение однородности. 5. Определение температуры плавления суппозиториев или времени полной деформации. 6. Определение времени растворения. 7. Определение подлинности действующих веществ, входящих в состав суппозиториев. 8. Определение специфических примесей. 9. Определение количественного содержания лекарственных веществ. 10. Определение однородности дозирования, если в ФС есть соответствующие указания. 11. Определение микробиологической чистоты суппозиториев [10, c. 85]. Фармацевтическими факторами, в наибольшей степени влияющими на биологическую доступность мягких лекарственных форм, являются характер вспомогательных веществ и способ введения лекарственных веществ в мазевую основу. Так, например, мазь димедроловая, приготовленная на вазелиновой основе, обладает поверхностным действием, а приготовленная на основе масла подсолнечного, воды очищенной и ланолина – резорбтивным эффектом. В то же время такие фармацевтические факторы, как степень дисперсности лекарственных веществ и их распределение в основе, проявляются непосредственно в процессе производства мазей. Известно, что фармакологический эффект мази в значительной степени зависит от дисперсности лекарственных веществ. Наиболее активны мази, содержащие вещества в растворенном или тонко измельченном состоянии. Контроль качества мазей предусматривает: 1. Контроль упаковки, оформления и сроков годности. 2. Контроль внешнего вида мази и запаха. 3. Определение общей массы мази. 4. Определение размера частиц лекарственных веществ в мазях. 5. Определение подлинности лекарственных веществ, входящих в состав мазей. 6. Определение рН водной вытяжки (если в ФС есть указания). 7. Определение специфических примесей. 8. Определение количественного содержания каждого из действующих веществ. 9. Определение микробиологической чистоты мази или стерильности, если в ФС будет на этот счет указание [8, c. 105]. ГЛАВА 2. ТЕХНОЛОГИЯ ИЗГОТОВЛЕНИЯ И КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ ФОРМ С ЭРИТРОМИЦИНОМ2.1 Технология изготовления мази для наружного применения Мазь эритромициновая (ФС 42-1163—78): Rp.: Erytromycini 1,111 Lanolini anhydrici 40,0 Natrii metabisulfitis 0,01 Vaselini pro oculi ad 100,0 Misce, fiat unguentum Da. Signa. Мазь для смазывания воспаленных участков кожи Мазь с эритромицином, представляющим собой порошок белого цвета без запаха, горького вкуса, малорастворим в воде, легкорастворим — в спирте, гигроскопичен. По спектру антимикробного действия близок к пенициллинам, но по сравнению с ними эритромицин лучше переносится и может применяться при аллергии к пенициллину. Эритромицин тщательно растирают с 10—12 каплями стерильного масла вазелинового. Натрия метабисульфит растворяют в нескольких каплях воды стерильной, эмульгируют охлажденным сплавом ланолина с вазелином и полученную эмульсию в несколько приемов при тщательном растирании добавляют к суспензии эритромицина. Мазь содержит эритромицина 10000 ЕД в 1,0 г мази. Наклеивают этикетку «Наружное», «Хранить в недоступном для детей месте». Срок годности 10 суток. Заполняют после изготовления ППК.
После изготовления лекарственной формы проводятся следующие методы контроля качества: 1.Письменный контроль. Проверяем правильность оформления ППК.
ППК оформлен правильно. 2. Органолептический контроль. Мазь внешне однородна, не расслаивается, имеет соответствующую консистенцию. Запах отсутствует, цвет белый. Мазь соответствует по данным параметрам. 3. Контроль при отпуске Ф.И.О. пациента и номер рецепта на этикетке, сигнатуре и квитанции соответствуют. Основная этикетка заполнена правильно. Имеется указание о способе приема. Предупредительные надписи «Хранить в недоступном для детей месте», «Хранить в прохладном месте». 4. Опросный контроль проводится путем беседы с провизором-технологом о процессе изготовления данной мази. 5. Физический контроль. Для этого взвешиваем общую массу мази. Р = 99,3 Отклонения допустимые в массе данной мази Фактическое отклонение: 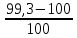 * 100% = 0,7 % * 100% = 0,7 %Мазь соответствует по массе. 6. Химический контроль. Данный вид контроля проводится выборочно для данной лекарственной формы. Вывод: лекарственная форма изготовлена удовлетворительно. 2.2 Технология изготовления назальной мази Rp: Mentholi 0,1 Zinci sulfatis 0,3 Erytromycini 0,4 Dimedroli 0,2 Lanolini 5,0 Vaselini 8,0 M. D. S. Мазь для носа. Выписана мазь комбинированного типа на дифильной (эмульсионной) основе. Ментол образует мазь-раствор, димедрол и цинка сульфат – мазь-эмульсию, эритромицин – мазь-суспензию. Применяют как противовоспалительное, антисептическое средство. В фарфоровой чашке на водяной бане готовят мазь-раствор ментола в вазелине при температуре не более 40 °C (ментол летуч) при периодическом перемешивании стеклянной палочкой. После расплавления вазелина чашку снимают с водяной бани. В ступке растирают эритромицин, добавляют 0,9 вазелинового масла (отмеряют эмпирическим каплемером) и снова диспергируют до получения однородной пульпы. Полученную пульпу с помощью скребка отодвигают на стенку ступки. В центр ступки капают 6 капель воды очищенной (0,3 мл) и растворяют димедрол и цинка сульфат. Раствор эмульгируют небольшим количеством ланолина водного. С края ступки добавляют суспензионную пульпу и смешивают с эмульсионной пульпой. Добавляют мазь-раствор, оставшуюся основу, перемешивают до однородности. Мазь помещают в банку, укупоривают, оформляют этикеткой «Наружное». «Хранить в защищенном от света месте», «Хранить в прохладном месте», «Хранить в недоступном для детей месте». Срок хранения – 10 суток. Заполняют ППК после изготовления лекарственной формы.
После изготовления лекарственной формы проводятся следующие методы контроля качества: 1.Письменный контроль. Проверяем правильность оформления ППК.
ППК оформлен правильно. 2. Органолептический контроль. Мазь внешне однородна, не расслаивается, имеет соответствующую консистенцию. Запах отсутствует, цвет белый. Мазь соответствует по данным параметрам. 3. Контроль при отпуске Ф.И.О. пациента и номер рецепта на этикетке, сигнатуре и квитанции соответствуют. Основная этикетка заполнена правильно. Имеется указание о способе приема. Предупредительные надписи «Хранить в недоступном для детей месте», «Хранить в прохладном месте». 4. Опросный контроль проводится путем беседы с провизором-технологом о процессе изготовления данной мази. 5. Физический контроль. Для этого взвешиваем общую массу мази. Р = 14,9 Отклонения допустимые в массе данной мази Фактическое отклонение: 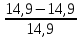 * 100% = 0 % * 100% = 0 %Мазь соответствует по массе. 6. Химический контроль. Данный вид контроля проводится выборочно для данной лекарственной формы. Вывод: лекарственная форма изготовлена удовлетворительно. ЗАКЛЮЧЕНИЕВ ходе выполнения работы изучена технология изготовления и контроль качества лекарственных форм, содержащих эритромицин. Выполнены поставленные задачи: 1. Изучена общая характеристика антибактериальных препаратов. Антибиотики - это все лекарственные препараты, подавляющие жизнедеятельность возбудителей инфекционных заболеваний, таких, как грибки, бактерии и простейшие. Антибиотики занимают особое место в современной медицине. Они являются объектом изучения различных биологических и химических дисциплин. За последние 35 лет открыто около 100 антибиотиков с различным спектром действия, однако в клинике применяется ограниченное число препаратов. Это объясняется главным образом тем, что большинство антибиотиков не удовлетворяют требованиям практической медицины. 2. Рассмотрены свойства эритромицина как лекарственного вещества. Эритромицин относится к группе макролидов. Общие свойства: - бактериостатическое действие; - сравнительно низкая токсичность; - преимущественная активность против грамположительных кокков (стрептококки, стафилококки); - высокая активность против небактериальных возбудителей (микоплазмы, хламидии, спирохеты). 3. Произведено на практике изготовление лекарственных форм с эритромицином – мази для наружного применения и назальной мази. 4. Проведен внутриаптечный контроль изготовленных лекарственных форм. Все изготовленные лекарственные формы удовлетворительного качества СПИСОК ЛИТЕРАТУРЫ1. Федеральный закон от 12 апреля 2010 г. № 61-ФЗ «Об обращении лекарственных средств». 2. Приказ Министерства здравоохранения РФ от 31 августа 2016 г. № 647н «Об утверждении Правил надлежащей аптечной практики лекарственных препаратов для медицинского применения». 3. Приказ Минздрава России от 26.10.2015 г. №751н «Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность». 4. Приказ Министерства здравоохранения РФ от 24 ноября 2021 г. № 1093н «Об утверждении Правил отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на осуществление фармацевтической деятельности, медицинскими организациями, имеющими лицензию на осуществление фармацевтической деятельности, и их обособленными подразделениями (амбулаториями, фельдшерскими и фельдшерско-акушерскими пунктами, центрами (отделениями) общей врачебной (семейной) практики), расположенными в сельских поселениях, в которых отсутствуют аптечные организации, а также Правил отпуска наркотических средств и психотропных веществ, зарегистрированных в качестве лекарственных препаратов для медицинского применения, лекарственных препаратов для медицинского применения, содержащих наркотические средства и психотропные вещества в том числе Порядка отпуска аптечными организациями иммунобиологических лекарственных препаратов». 5. Постановление Главного государственного санитарного врача РФ (ГГСВ РФ) от 24.12.2020 № 44. 6. Государственная Фармакопея XIV изд. – М.: Медицина, 2018. – 1881 с. 7. Грецкий В. М., Хоменок В. С. Руководство к практическим занятиям по технологии лекарственных форм; Медицина - Москва, 2018. - 304 c. 8. Кулешова М.И., Гусева Л.Н., Сивицкая О.К. Анализ лекарственных форм изготовляемых в аптеках. – М.: Медицина, 2019. – 247 с. 9. Логинова Н.В., Полозов Г.И. Введение в фармацевтическую химию: учеб. пособие - Мн.: БГУ, 2018. – 250 с. 10. Фармацевтическая технология: Технология лекарственных форм: учеб. для студ. высш. учеб. заведений / под ред. И. И. Краснюка, Г.В. Михайловой. – М. : ГЭОТАР-Медиа, 2021. – 656 с. 11. Фармацевтическая химия : учебник / под ред. Г. В Раменской. – М. : БИНОМ. Лаборатория знаний, 2018. – 467 с. 12. https://base.garant.ru/ (дата обращения 16.05.2022). ПРИЛОЖЕНИЕТаблица 1. Отклонения в общей массе мазей
|
