Курсовой проект по дисциплине Экологический мониторинг
 Скачать 268.93 Kb. Скачать 268.93 Kb.
|
2 Оценка экологического состояния территорий, прилегающих к источникам загрязнения окружающей среды в г. Оренбурге (на примере придорожной территории ул.Шевченко)Характеристика объекта исследования и список применяемых методикХарактеристика объекта исследования Улицы современного города представляют собой сложные инженерные сооружения. Они определяют лицо города, степень его благоустройства. Городские улицы связывают в единую транспортную сеть жилые, промышленные, административные районы и служат для движения городского транспорта и пешеходов, а также размещения зданий и других элементов оборудования и благоустройства. Проезжая часть, тротуары, полосы зеленых насаждений - все, что расположено между границами застройки, образует улицу. Современные улицы должны удовлетворять ряду требований, главным из которых является удобство и безопасность движения транспорта и пешеходов. Но, как отмечалось выше, улица любого города представляет собой протяженный источник выбросов выхлопных газов и пыли. И поэтому для оценки качества атмосферы в промышленном городе следует оценивать не только состояние автомобильного парка, но и состояние автомобильных дорог. Улица Шевченко находится в Ленинском районе города Оренбурга. Протяженность улицы составляет 5220 метра. Она ограничивается Полтавской улицей и Карагандинской улицей. Её пересекают пр-т Победы и Пролетарская улица. Здания на территории улицы преимущественно 4- и 5-этажные, а так же частные дома. По этой улице осуществляют движется большое количество общественного транспорта и личных автомобилей. Объектом исследований является участок улицы Шевченко города Оренбурга, расположенный рядом с зданием 227, в котором находится магазин «Пятерочка». Вокруг здания имеются зелёные насаждения, отгороженные бордюром от тротуаров и нешироких дорог, предназначенных для автотранспорта. На расстоянии 10 метров от исследуемого участка высажены кустарники, представляющие собой живую изгородь. Состояние бордюров и тротуаров можно охарактеризовать как хорошее. Состояние зелёных насаждений также можно охарактеризовать как хорошее. Объект исследования находится на расстоянии 20 метров от общей проезжей части и на расстоянии 5 метров от узкой дороги, предназначенной для движения автотранспортных средств. Отбор пробы проводился в 0,5 м от тротуара. Пробы атмосферных осадков отбирались летом, а пробы почвы – в сентябре.  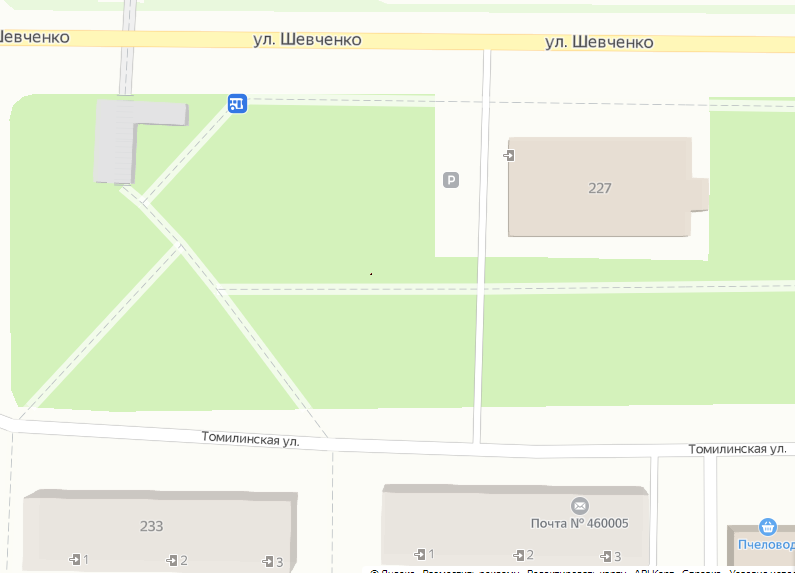 Рисунок 2.1 – Карта-схема места отбора проб на ул. 60 лет Октября 1  Условные обозначения: Условные обозначения:- место отбора проб;  - здания; - здания; - зелёные насаждения; - зелёные насаждения; - дорожное полотно. - дорожное полотно.2.1.2 Методика отбора проб почвы Ход работы: 1) отобрать пробу почвенного покрова с одной пробной площадки методом конверта. Масса объединенной пробы должна состоять из пяти точечных проб весом не менее 1 кг; 2) пробу почвенного покрова в исследовательской лаборатории рассыпают на бумаге или кальке; 3) крупные комки почвы необходимо размять пестиком; 4) выбрать включения и новообразования; 5) растереть почву пестиком в ступке; 6) просеять почву через сито с диаметром отверстий 1 мм. 2.1.3 Приготовление почвенных вытяжек. Под анализом почвы понимают совокупность операций, которые выполняют с целью определения состава, биологических, физико-механических, химических, физико-химических и агрохимических свойств почвы. Существует множество способов получения растворов веществ, которые содержатся в почве. Однако все способы делятся на две основные группы – получение почвенного раствора и вытяжки. В результате приготовления почвенного раствора получают несвязанную или слабо связанную почвенную влагу, которая содержится между частицами почвы и в почвенных капиллярах. Этот раствор является слабо насыщенным, однако его химический состав является актуальным для растительного покрова, так как она омывает корни растений и в ней идет обмен химическими веществами. В результате приготовления почвенного вытяжки из почвы вымывают связанные с ее частицами растворимые химические соединения. Выход веществ в почвенную вытяжку зависит от соотношения почвы и раствора и увеличивается: - при возрастании температуры раствора (однако до определенных пределов, так как слишком высокая температура может разрушить какие-либо вещества или перевести их в иное состояние); - при увеличении объема раствора; - при увеличении степени измельченности почвы (до определенных пределов, так как слишком мелкие пылеобразные частицы могут сделать затруднительной или невозможной экстракцию и фильтрацию раствора). Таким образом, почвенная вытяжка – экстракт, полученный после обработки почвы раствором заданного состава, действовавшим на почву определенное время при определенном соотношении, почва – раствор. Существует несколько видов почвенных вытяжек в зависимости от используемого в качестве растворителя вещества: 1) водная вытяжка – фильтрат водного раствора, полученного после взбалтывания почвы с бидистиллированной водой. В вытяжке определяют общее содержание воднорастворимых веществ (сухой остаток), содержание воднорастворимых органических веществ и различных ионов; 2) кислотная вытяжка – фильтрат от обработки почвы какой-либо кислотой, взятой в определенной концентрации и в определенном соотношении с почвой и взаимодействующей с ней заданное время. Используются для количественного определения различных химических соединений или условных их форм, различающихся растворимостью в применяемом реактиве; 3) солевая вытяжка – вытяжка, полученная в результате взаимодействия раствора соли с почвой; 4) ацетатно-аммонийная вытяжка используется для определения наличия тяжелых металлов в почве. В качестве растворителей также используются растворы щелочей или солей и неводные растворители (вытяжка щелочная, солевая, спиртобензольная и т. д.). Приготовление водной суспензии. На электронных технических весах взвешивают 10 г воздушно-сухой почвы, пропущенной через сито с диаметром отверстий 1 мм, и помещают в колбу емкостью 50 – 100 мл. В колбу с почвой приливают 25 мл дистиллированной воды, рН которой равна 6,6 – 6,8. Колбу плотно закрывают чистой каучуковой пробкой и встряхивают в течение 5 минут. После встряхивания, когда большая часть почвы осядет на дно, пробку приподнимают и дают стечь жидкости, задержавшейся между пробкой и стеклом. Снова закрывают колбу пробкой, смывают отстоявшейся жидкостью частицы почвы со стенок колбы. Если это не удастся сделать за один прием, то повторяют смывание еще раз, после чего колбу оставляют стоять 18 – 24 часа. После отстаивания пипеткой отделяют отстоявшийся раствор в колбу. Для этого в воронки помещают фильтры красная лента. Край фильтра должен располагаться на 0,5 см ниже края воронки. Струю приготовленной суспензии направляют на боковую стенку воронки таким образом, чтобы не порвать фильтр. Если в результате фильтрования получился мутный фильтрат, то его необходимо перефильтровать через фильтр синяя лента. По окончании фильтрования полученный раствор сливают в склянки и подписывают. Полученный фильтрат используют для определения величины рН водной вытяжки и концентрации химических веществ титриметрическими методами. Приготовление солевой вытяжки. На электронных технических весах взвешивают 20 г воздушно-сухой (или сырой) почвы и помещают в сухую чистую колбу емкостью 100 мл. Добавляют в колбу 50 мл 1,0 н раствора хлорида калия, закрывают чистой пробкой и энергично встряхивают в течение 5 минут. После встряхивания, когда большая часть почвы осядет на дно, пробку приподнимают и дают стечь жидкости, задержавшейся между пробкой и стеклом. Снова закрывают колбу пробкой, смывают отстоявшейся жидкостью частицы почвы со стенок колбы. Если это не удастся сделать за один прием, то повторяют смывание еще раз, после чего колбу оставляют стоять 18 – 24 часа. После отстаивания пипеткой отбирают раствор (фильтровать нельзя, так как фильтр может изменить реакцию вытяжки) и определяют концентрацию химических веществ колориметрическими методами. 2.1.4 Определение рН в почве Иономер И-160МИ необходимо включить и прогреть в течение 15 мин. Для того чтобы выключить прибор нужно нажать кнопку и удерживать ее в течение 1 – 2 с. Для проведения измерений используют электродную пару, которая состоит двух электродов: измерительного и электрода сравнения. Электроды устанавливаются на штатив и подключаются к соответствующим к гнездам преобразователя «ИЗМ.» и «СРАВН.». Прибор имеет три режима работы: - измерения; - градуировка; - контроль. После включения прибор автоматически устанавливается в режим измерений. Переход из режима градуировки и контроля в режим измерений производится нажатием кнопки ИЗМЕРЕНИЕ. Перед применением необходимо промыть электроды дистиллированной водой, и (желательно) отобранной частью исследуемого раствора. Капли на электродах удалить фильтровальной бумагой и погрузить их в исследуемый раствор. После установления стабильных показаний считать результат измерения с дисплея иономера. Время проведения измерений не превышает 3 минут с момента погружения электродной пары в исследуемую среду. При измерении pH сильнокислых и сильнощелочных растворов время установления показаний может составлять до 10 минут. Пробы водных почвенных вытяжек в пронумерованных химических стаканчиках переносят к иономеру. Исследование показателя рН проводится в нескольких параллелях. Схема работы на иономере И-160МИ следующая: 1) включить прибор в сеть; 2) Прогреть 15 минут; 3) Просушить электродную пару фильтровальной бумагой; 4) Промыть электродную пару отобранной частью исследуемого раствора; 5) Опустить электродную пару в химический стаканчик с исследуемым раствором; 6) После установления стабильных показаний считать результат измерения с дисплея прибора; 7) Соблюдать осторожность при работе со стеклянными электродами и следить, чтобы шарик стеклянного электрода не прикасался к стенкам и дну стакана. После каждого измерения промывают электродную пару в дистиллированной воде и высушивают фильтрованной бумагой. По окончании работы с прибором электроды помещают в стакан с дистиллированной водой. Анализ значений рН почвы по критериям степени химического загрязнения объектов окружающей среды позволит провести ранжирование территории по экологическому неблагополучию (таблицы 2.1-2.2). Таблица 2.1 – Критерии оценки степени химического загрязнения объектов окружающей среды
Таблица 2.2 – Классификация типов почв в зависимости от реакции водной вытяжки
2.1.5 Определение содержания карбонат- и гидрокарбонат-ионов в почве Определение карбонат-ионов. В колбу наливают 10 мл исследуемого раствора и добавляют пипеткой 5 – 6 капель раствора фенолфталеина. В случае отсутствия окрашивания раствора или при слабо розовом окрашивании считают, что карбонат-ионы в пробе отсутствуют (рН пробы меньше 8,0 – 8,2). При наличии розовой окраски содержимое склянки постепенно титруют 0,05 н раствором соляной кислоты при постоянном перемешивании до тех пор, пока окраска побледнеет до слабо розовой. Титрование выполняют в трех параллелях и берут среднее значение. Массовую концентрацию карбонат-ионов рассчитывают по формуле 2.1: 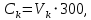 (2.1) (2.1) где Vk – объем раствора соляной кислоты, израсходованный на титрование, мг/л. Определение гидрокарбонат-ионов. В колбу наливают 10 мл исследуемого раствора и добавляют пипеткой 1 – 2 капли раствора метилового оранжевого. Содержимое склянки постепенно титруют 0,05 н раствором соляной кислоты при постоянном перемешивании до перехода оранжевой окраски в розовую. Титрование выполняют в нескольких параллелях и берут среднее значение. Массовую концентрацию гидрокарбонат-ионов рассчитывают по формуле 2.2: 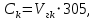 (2.2) (2.2)где Vгk – объем раствора соляной кислоты, израсходованный на титрование, мг/л. 2.1.6 Определение содержания хлорид-ионов в почве Определение содержания хлорид-ионов в почве. Вначале устанавливают титр AgNO3. Для этого в коническую колбу на 200 мл вносят 10 мл раствора NaCI и 90 мл дистиллированной воды, прибавляют 5 капель К2СrО4. Содержимое колбы титруют раствором AgNO3 до перехода лимонно-желтой окраски мутного раствора в оранжево-красную, не исчезающую в течение 15-20 с. При содержании хлоридов менее 250 мг/л берут 100 мл фильтрованной испытуемой воды. При большем содержании хлоридов берут 10-50 мл. Испытуемую воду наливают в две конические колбы, доводят до 100 мл дистиллированной водой, прибавляют 5 капель раствора К2СrО4. Раствор в одной колбе титруют AgNO3, a вторая колба используется для контроля. Содержание хлор-иона в воде рассчитывается по формуле 2.3: 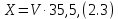 где X - содержание хлор-иона в мг/л; 35,5 - эквивалентное количество хлора, соответствующее 1 мл 0,01 н раствору AgNO3 мг; V - объем исследуемой пробы, мл. 2.1.7 Определения содержания ионов кальция и магния в почве Пипеткой на 50 мл отбирают фильтрат и переносят его в колбу для титрования, приливают 5 мл аммонийной буферной смеси, 25-30 мг хромогена черного и титруют раствором трилона Б с молярной концентрацией эквивалента 0,05 моль/л до перехода винно- красной окраски раствора в синюю. Титрование повторяют 2-3 раза и берут среднее значение. Суммарное содержание Са2+ и Mg2+ находим по формуле 2.4 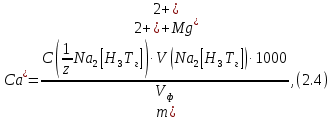 где С(1/zNа2[Н3Тг]) – концентрация раствора трилона Б, н; V(Na2[Н3Тг]) - объем рабочего раствора трилона Б, затраченного на титрование, мл; Vф – объем фильтрата, мл. Определение содержания кальция. 50 мл фильтрата переносят в колбу для титрования, приливают 2,5 мл раствора NaOH с молярной концентрацией 2 моль/л, 30-40 мг смеси мурексида с хлоридом натрия и приступают к титрованию раствором трилона Б с молярной концентрацией эквивалента 0,05 моль/л до появления сине-фиолетовой окраски, не исчезающей в течении 2-3 минут. Титрование повторяют 2-3 раза и берут среднее значение. Содержание кальция вычисляют по формуле 2.5, как и суммарное содержание Са2+ и Mg2+: 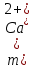 Количество магния находят по формуле 2.6: 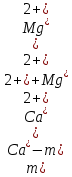 2.1.8 Определение содержания сульфид- и гидросульфид-ионов в почве Ход работы. Вследствие летучести свободного сероводорода производят два определения: ориентировочное и точное. Ориентировочное определение. В колбу вносят 20 мл анализируемого раствора и прибавляют 0,2 г кристаллического иодида калия. Полученную смесь перемешивают круговыми движениями. Далее добавляют 2 – 3 капли 0,5 %-ного раствора крахмала и титруют 0,01 н раствором йода до появления голубой окраски, которая не исчезает при энергичном встряхивании. Титрование выполняют в трех параллелях и берут среднее значение. Точное определение. В коническую колбу вносят 20 мл анализируемого раствора, 0,2 г кристаллического иодида калия, отмеряют из бюретки 0,01 н раствора йода на 1 мл больше, чем было израсходовано на ориентировочное титрование, затем добавляют 2 – 3 капли 0,5 %-го раствора крахмала, интенсивно взбалтывают и титруют избыток йода 0,01 н раствором тиосульфата натрия. Титрование выполняют в нескольких параллелях и берут среднее значение. Общее содержание соединений серы (в мг/л), окисляемых йодом, выраженное в форме сероводорода, вычисляют по формуле 2.7: 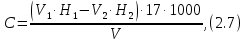 где V1 – общий объем прибавленного раствора йода, мл; H1 – нормальность раствора йода, н; V2 – объем раствора тиосульфата натрия, израсходованный на титрование избытка раствора йода, мл; H2 – нормальность раствора тиосульфата натрия, н; 17 – эквивалентный вес сероводорода, г/моль; 1000 – коэффициент перевода мл в л; V – объем исследуемой пробы, мл. 2.1.9 Определения содержания сульфат-ионов в почве Приготовление рабочего раствора сульфата натрия. Для получения раствора сульфата натрия с концентрацией 0,2 мг/мл берут навеску 0,8872 г прокаленного химически чистого (х. ч.) сульфата натрия и растворяют в 100 мл бидистиллята. Рабочий раствор сульфата натрия, содержащий 10 мкг в 1000 мл, готовят разбавлением полученного раствора в 20 раз. Приготовление раствора электролита. Берется мерная колба на 1000 мл, в нее помещается 240 г химически чистого хлорида натрия, добавляется небольшое количество бидистиллированной воды, приливается 20,5 мл концентрированной соляной кислоты и содержимое колбы доводится бидистиллятом до метки. В каждую колбу приливают 10 мл электролита и соответственно 19, 18, 16, 14, 10 мл дважды перегнанной дистиллированной воды, перемешивают круговыми вращениями колбы. Затем приливают 7,5 мл раствора хлорида бария, перемешивают, доводят объем раствора до метки и снова тщательно перемешивают. Через 5 минут измеряют оптическую плотность стандартных растворов по отношению к раствору сравнения в порядке понижения концентрации в кюветах с толщиной поглощающего слоя 50 мл. Определение сульфат-ионов в почвенной вытяжке. В коническую колбу объемом 50 мл вносят 10 мл анализируемой почвенной вытяжки и прибавляют 10 мл электролита, 7,5 мл раствора хлорида бария и доводят до метки дистилированной водой. Полученный раствор колориметрируют при длине волны 590 нм на фоне раствора сравнения в нескольких параллелях. Раствор сравнения готовят аналогично в колбе вместимостью 50 мл без сульфата натрия. Концентрацию определяют по градиуровочному графику и берут среднее значение. 2.1.10 Методика определения ионов цинка в почве Приготовление стандартных растворов для построения градуировочного графика. Для приготовления эталонов в мерные колбы на 50 мл наливают 0; 0,5; 1,0; 2,0; 3,0; 4,0 и 5,0 мл рабочего раствора хлорида цинка, в каждую из колб добавляют 5 мл ацетатного буферного раствора, затем 1 мл 20 % раствора тиосульфата натрия и 4 мл раствора дитизона; доводят объем до метки дистиллированной водой и фотометрируют. Рабочий раствор хлорида цинка, содержащий 5 мкг/мл цинка, готовят, взяв навеску хлорида цинка 10,46 мг и растворив ее в мерной колбе на 1 л дистилированной водой. Определение ионов цинка в почвенной вытяжке. В коническую колбу вносят 100 мл анализируемого раствора, приливают 5 мл ацетатного буферного раствора, перемешивают, добавляют 1 мл 20 % раствора тиосульфата натрия и 4 мл рабочего раствора дитизона в четыреххлористом углероде. Закрыть подходящими притертыми резиновыми пробками. Энергично перемешать в течение 2 – 5 минут. Окраска дитизона в зависимости от содержания ионов цинка в анализируемом растворе изменяется от зеленой до красной. Содержимое колбы переливают в делительную воронку и отделяют окрашенную органическую часть раствора, которую помещают в кювету на 10 мл и определяют оптическую плотность на фотоэлектроколориметре при длине волны 540 нм на фоне дитизона в четыреххлористом углероде в нескольких параллелях. Значение концентрации ионов цинка определяется по калибровочному графику и в результате расчета берут среднее значение. 2.1.11 Методика определения взвешенных частиц в атмосферных осадках Общие положения. Загрязнение осадков происходит как во время образования в облаке и выпадения их на земную поверхность, так и в результате сухого осаждения загрязнителей из атмосферы. Большое количество пылевых примесей в атмосфере городов нередко провоцирует заболевания дыхательных путей и нарушение работы слизистых оболочек организма человека и животных. Пыль засоряет устьица растений, нарушает процессы цветения и оплодотворения в растениях. В больших количествах пыль образует налет или даже корку на поверхности растений, чем затрудняет протекание процесса фотосинтеза. Будучи сами по себе малотоксичными пылевые частицы способны адсорбировать на своей поверхности тяжелые металлы и другие токсичные вещества. Ход работы. Произвести отбор снега (дождя) специальным пробоотборником. Если производится отбор снега, то его необходимо поместить в комнатные условия (18-20° С) до полного таяния. Собранные осадки фильтруются через широкопористый фильтр (белая лента), предварительно взвешенный на аналитических весах. Для фильтрования берутся три конические колбы, три воронки, в которые вставляются фильтры. Через каждый из них пропускается фильтрат объемом 300 мл. Если после фильтрования фильтрат получается мутным, то его фильтруют еще через узкопористый фильтр (синяя лента), вышеуказанным способом. После фильтрования фильтры высушиваются в эксикаторе и вновь взвешиваются на аналитических весах. По разности масс фильтров до и после фильтрования вычисляется масса взвешенных частиц. Методика определения рН водных объектовОбщие положения. Величина рН является мерой активной кислотности природной воды и других объектов окружающей среды, создавшейся в результате взаимодействия растворенных электролитов и газов. Определение величины рН в практике исследования природных вод, почв и растений имеет большое значение. Это величина позволяет судить о формах нахождения в объектах окружающей среды слабых кислот: угольной, кремневой, сероводородной, фосфорной, а также дает возможность судить о насыщенности объектов слабыми основаниями и служит для контроля некоторых аналитических определений. Активная кислотность почв имеет решающее значение для произрастания растений, жизнедеятельности микроорганизмов, развития и направления биохимических процессов почвы. Ход определения. Приготовление водной суспензии. 10 г воздушно-сухой почвы, пропущенной через сито диаметром в 1 мм, отвешивают на технических весах, помещают в колбу емкостью 50-10 и приливают 25 мл дистиллированной воды, рН которой равна 6,6-6,8.Колбу плотно закрывают чистой каучуковой пробкой, встряхивают 5 минут и оставляют стоять 18-24 часа, после чего сливают отстоявшийся раствор и определяют рН водной вытяжки. Приготовление солевой вытяжки. Отвешивают на технических весах 20 г воздушно-сухой (или сырой) почвы и помещают в сухую чистую колбу емкостью 100 мл. Приливают 50 мл 1,0 н раствора хлорида калия, закрывают чистой пробкой и энергично встряхивают 5 минут. Через 10-15 минут после встряхивания, когда большая часть почвы осядет на дно, пробку приподнимают и дают стечь жидкости, задержавшейся между пробкой и стеклом. Снова закрывают колбу пробкой, смывают отстоявшейся жидкостью частицы почвы со стенок колбы. Если это не удастся сделать за один прием, минут через 10 повторяют смывание еще раз, после чего колбу оставляют стоять 18-24 часа. По истечении срока отстаивания берут пипеткой часть раствора (фильтровать нельзя, так как фильтр может изменить реакцию вытяжки) и определяют рН солевой вытяжки. Пробы природной воды или вытяжек в подписанных или пронумерованных химических стаканчиках переносят к прибору. Порядок работы на приборе, следующий: 1. Включить прибор в сеть, прогреть 15 минут. 2.Опустить электроды в стаканчик с раствором. 3.Нажать кнопку рХ и «-1:19», по нижней шкале прибора определить приблизительное значение рН раствора. 4.На панели переключения пределов измерения нажать кнопку, в которую входит определенная по пункту № 3 величина. Например, 2,4, то нужно нажать кнопку «-1:4» и отсчитать показываемое значение по верхней шкале прибора. 5.Соблюдать осторожность при работе со стеклянным электродом, следить, чтобы шарик стеклянного электрода не прикасался к стенкам и дну стакана. После каждого определения вымывают электроды в дистиллированной воде и высушивают фильтрованной бумагой. По окончании работы с прибором электроды помещают в стакан с дистиллированной водой. Методика определения содержания хлорид-ионов в атмосферных осадкахОбщие положения. Высокая растворимость хлоридов объясняет широкое распространение их во всех природных водах. В проточных водоемах содержание хлоридов обычно невелико (20-ЗО мг/л). Незагрязненные грунтовые воды в местах с несолончаковой почвой обычно содержат до 30-50 мг/л хлор-иона. В водах, фильтрующихся через солончаковую почву, в 1 л могут содержаться сотни и даже тысячи миллиграммов хлоридов. Вода, содержащая хлориды в концентрации более 350 мг/л, имеет солоноватый привкус, а при концентрации хлоридов 500-1000 мг/л неблагоприятно влияет на желудочную секрецию. Содержание хлоридов является показателем загрязнения подземных и поверхностных водоисточников и сточных вод. Определение хлоридов ведется по методу Мора. Принцип метода Мора основан на осаждении хлоридов азотнокислым серебром в присутствии хромата калия К2СrО4. При наличии в растворе хлоридов AgNO3 связывается с ними, а затем образует хромат серебра оранжево-красного цвета. NaCI + AgNO3 >AgCIv+ NaNO3 2AgNO3 + K2CrO4 > Ag2CrO4v + 2KNO3 Ход работы. Вначале устанавливают титр AgNO3. Для этого в коническую колбу на 200 мл вносят 10 мл раствора NaCI и 90 мл дистиллированной воды, прибавляют 5 капель К2СгО4. Содержимое колбы титруют раствором AgNO3 до перехода лимонно-желтой окраски мутного раствора в оранжево-красную, не исчезающую в течение 15-20 с. При содержании хлоридов менее 250 мг/л берут 100 мл фильтрованной испытуемой воды. При большем содержании хлоридов берут 10-50 мл. Испытуемую воду наливают в две конические колбы, доводят до 100 мл дистиллированной водой, прибавляют 5 капель раствора К2СгО4. Раствор в одной колбе титруют AgNO3, a вторая колба используется для контроля. Содержание хлор-иона в воде рассчитывается по формуле 2.8 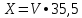 , (2.8) , (2.8)где X - содержание хлор-иона в мг/л; 35,5 - эквивалентное количество хлора, соответствующее 1 мл 0,01 н раствору AgNO3 мг; V - объем исследуемой пробы, мл. Методика определения содержания сульфидов и гидросульфидов в атмосферных осадкахОсновные положения. При действии раствора йода на связанный и свободный сероводород и соли сернистой и тиосерной кислот происходит окисление последних: S2-+I2 > 2I-+S HS-+I2>H+ + 2I- + S SОз2- + I2 > SO42 -+ 2I-+ 2Н+ 2S2Оз2-+ I2 >2I+ S4О62- Ход определения. Вследствие летучести свободного сероводорода производят два определения: ориентировочное и точное. Ориентировочное определение. В коническую колбу помещают 20 мл фильтрата атмосферных осадков, добавляют 0,2 г иодида калия и перемешивают круговыми движениями, при этом кристаллы растворяются. Затем прибавляют 2-3 капли 0,5 %-ного раствора крахмала и титруют 0,01 н раствором йода до появления голубой окраски, не исчезающей при энергичном встряхивании. Точное определение. В коническую колбу вносят 20 мл исследуемой пробы, 0,2 г иодида калия ,отмеряют из бюретки 0,01 н раствора йода на 1 мл больше, чем было израсходовано на ориентировочное титрование, затем прибавляют 2-3 капли 0,5 %-ного раствора крахмала ,тщательно взбалтывают и оттитровывают избыток йода 0,01 н раствором тиосульфата натрия. Общее содержание соединений серы X (в мг/л), окисляемых йодом, выраженное в форме сероводорода, вычисляют по формуле 2.9: 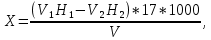 (2.9) (2.9)где V1 - объем прибавленного раствора йода, мл; H1-нормальность раствора йода, н; V2-объем раствора тиосульфата натрия, израсходованный на титрование избытка раствора йода, мл; H2-нормальность раствора тиосульфата натрия, н; 17-эквивалентный вес сероводорода, г/моль; 1000-коэффициент перевода мл в л; V- объем исследуемой пробы, мл. Методика определения содержания карбонат- и гидрокарбонат-ионов в атмосферных осадкахХод определения. Определение карбонат-иона. В колбу наливают 10 мл анализируемой воды. Добавляют пипеткой 5-6 капель раствора фенолфталеина (при отсутствии окрашивания раствора, либо при слабо розовом окрашивании считают что карбонат-ион в пробе отсутствует, рН пробы меньше 8,0-8,2). Постепенно титруют содержимое склянки раствором соляной кислоты (0,05н) до тех пор, пока окраска побледнеет до слабо розовой. Массовую концентрацию карбонат-иона рассчитывают по формуле 2.10: 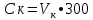 , (2.10) , (2.10)где Vк - объем раствора соляной кислоты, израсходованный на титрование, мг/л. Определение гидрокарбонат-иона. В колбу наливают 10 мл анализируемой воды. Добавляют пипеткой 1-2 капели раствора метилового оранжевого. Постипенно титруют содержимое склянки раствором соляной кислоты (0,05 н) при перемешивании до перехода желтой окраски в розовую. Массовую концентрацию гидрокарбонат-иона рассчитывают по формуле 2.11: 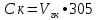 , (2.11) , (2.11)где 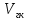 - объем раствора соляной кислоты, израсходованный на титрование, мг/л. - объем раствора соляной кислоты, израсходованный на титрование, мг/л.Методика определения содержания кальция и магния в атмосферных осадкахОбщие положения. В этой работе используется комплексонометрический метод определения Са2+ и Mg2+ при их совместном присутствии в растворе. Сущность определения сводится к тому, что в начале определяют суммарное содержание молярной концентрацией эквивалента 0,05 моль/л Mg2+, титруя фильтрат раствором трилона Б в присутствии хромогена черного. Затем находят содержание ионов Са2+, титруя фильтрат раствором трилона Б в присутствии индикатора мурексида. По разности этих двух определений находят содержание ионов Mg2+. Ход работы. Пипеткой на 50 мл отбирают фильтрат и переносят его в колбу для титрования, приливают 5 мл аммонийной буферной смеси, 25-30 мг хромогена черного и титруют раствором трилона Б с молярной концентрацией эквивалента 0,05 моль/л до перехода винно- красной окраски раствора в синюю. Титрование повторяют 2-3 раза и берут среднее значение. Содержание Са2+ и Mg2+ вместе взятых можно найти по формуле 2.12: 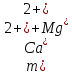 , (2.12) , (2.12) где С(1/zNа2[НзТг])- концентрация раствора трилона Б, н; V(Na2[НзТг])- объем рабочего раствора трилона Б, затраченного на титрование, мл; Уф- объем фильтрата, мл. Определение содержания кальция. 50 мл фильтрата переносят в колбу для титрования, приливают 2,5 мл раствора NaOH с молярной концентрацией 2 моль/л, 30-40 мг смеси мурексида с хлоридом натрия и приступают к титрованию раствором трилона Б с молярной концентрацией эквивалента 0,05 моль/л до появления сине-фиолетовой окраски, не исчезающей в течении 2-3 минут. Титрование повторяют 2-3 раза и берут среднее значение. Содержание кальция вычисляют по формуле, как и суммарное содержание Са2+ и Mg2+. Количество магния находят по формуле 2.13: m(Mg2+) = m(Ca2++Mg2+) - m(Ca2+), (2.13) 2.1.17 методика определения цинка в атмосферных осадках Приготовление стандартных растворов для построения градуировочного графика. Для приготовления эталонов в мерные колбы на 50 мл наливают 0; 0,5; 1,0; 2,0; 3,0; 4,0 и 5,0 мл рабочего раствора хлорида цинка, в каждую из колб добавляют 5 мл ацетатного буферного раствора, затем 1 мл 20 % раствора тиосульфата натрия и 4 мл раствора дитизона; доводят объем до метки дистиллированной водой и фотометрируют. Рабочий раствор хлорида цинка, содержащий 5 мкг/мл цинка, готовят, взяв навеску хлорида цинка 10,46 мг и растворив ее в мерной колбе на 1 л дистилированной водой. Определение ионов цинка в пробе атмосферных осадков. В коническую колбу вносят 100 мл анализируемого раствора, приливают 5 мл ацетатного буферного раствора, перемешивают, добавляют 1 мл 20 % раствора тиосульфата натрия и 4 мл рабочего раствора дитизона в четыреххлористом углероде. Закрыть подходящими притертыми резиновыми пробками. Энергично перемешать в течение 2 – 5 минут. Окраска дитизона в зависимости от содержания ионов цинка в анализируемом растворе изменяется от зеленой до красной. Содержимое колбы переливают в делительную воронку и отделяют окрашенную органическую часть раствора, которую помещают в кювету на 10 мл и определяют оптическую плотность на фотоэлектроколориметре при длине волны 540 нм на фоне дитизона в четыреххлористом углероде в нескольких параллелях. Значение концентрации ионов цинка определяется по калибровочному графику и в результате расчета берут среднее значение. 2.1.18 Математическая обработка результатов исследования Любые экспериментальные данные должны быть подвергнуты математической обработке, что позволит судить об их достоверности. Вычисляют среднее арифметическое значение экспериментальных данных Хп, полученных при анализе параллельных проб. Затем находят среднее квадратичное отклонение для n определений по формуле 2.14: 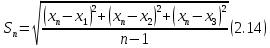 Полученную величину отклонения Sn используют для вычисления абсолютной и относительной погрешности анализа с заданной степенью надежности (a =0,95) по формуле 2.15: 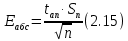 где tаn - коэффициент распределения Стьюдента, который определяют по таблице 2.3 для а =0,95 и числа определений n без промахов. Таблица 2.3 - Коэффициенты Стьюдента при a = 0,95
Относительная погрешность рассчитывается по формуле 2.16: 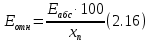 | |||||||||||||||||||||||||||||||||||||||||||||||
