гидроочистка керосина. КП ГО ЧА. Курсовой проект по дисциплине Теория и технология химических процессов органического и нефтехимического синтеза на тему Технологическое проектирование установки гидроочистки дизельной фракции мощностью 1910 тыс тгод
 Скачать 1.78 Mb. Скачать 1.78 Mb.
|
|
Таблица 2.16 – Материальный баланс однократного испарения ГСС при 340˚С и 4 МПа
Таблица 2.17 – Материальный баланс однократного испарения ГПС при 360˚С и 3,8 МПа
2.3.8.2 Расчет энтальпий паров сырья, гидроочищенного вакуумного газойля, газов реакции, СВСГ и ЦВСГ Найдем энтальпию паров нефтепродуктов при повышенном давлении. Определяем характеризующий фактор нефтепродукта как К=  , ,где Тср. мол– средняя молярная температура кипения нефтепродукта; 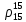 – плотность нефтепродукта. – плотность нефтепродукта.Среднюю молярную температуру кипения нефтепродукта находим по формуле: Тср.мол = tср.об. – Δt, где tср.об. – средняя объемная температура кипения нефтепродукта, °С; Δt – поправка, °С [32]. Средняя объемная температура кипения определяется по данным разгонки по ГОСТ (табл. 2.1): t ср.об. = (t 10% + t 50% + t 90%)/3, где t 10%, t 50%, t 90% - температуры отгона 10, 50 и 90 %, °С. Определяем наклон кривой разгонки по формуле tg∠ГОСТ = (t 90% - t 10%)/80. В зависимости от характеризующего фактора (К) и молярной массы (М) по графику, приведенном в Приложении 12 [27], находим псевдокритические параметры фракции: температуру Тпс.кр. и давление Рпс.кр. Находим приведенную температуру Тпр и приведенное давление Pпр по формулам  ; ;  , ,где Рн.п. – парциальное давление нефтепродукта, МПа. Для сырья: tср.об. = (228,5 + 291,0 + 341,5)/3 = 287 °С; tg∠ГОСТ = (341,5 – 228,5)/80 = 1,4; Δt = 8 °С; tср.мол. = 287 - 8 = 279 °С; 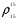 = 0,844 г/см3; = 0,844 г/см3; ; ;М = 201 кг/кмоль; Тпс.кр = 460 + 273= 733 К; Рпс.кр = 1,9 МПа. Для гидрогенизата: tср.об. = (230,0 + 278,0 + 319,0)/3 = 276 °С; tg∠ГОСТ = (319,0 – 230,0)/80 = 1,1; Δt = 7 °С; tср.мол. = 276 – 7 = 269 °С; 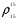 = 0,837 г/см3; = 0,837 г/см3;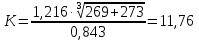 ; ;М = 192 кг/кмоль; Тпс.кр = 450 + 273 = 723 К; Рпс.кр = 1,95 МПа. Для бензина-отгона: tср.об. = (72,5 + 107,0 + 140,5)/3 = 107 °С; tg∠ГОСТ = (140,5 – 72,5)/80 = 0,85; Δt = 0 °С; tср.мол. = 107 – 0 = 107 °С; 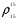 = 0,736 г/см3; = 0,736 г/см3; ; ;М = 111 кг/кмоль; Тпс.кр = 335 + 273 = 608 К; Рпс.кр = 3,15 МПа. Приведенные температуры для сырья рассчитываем при температурах 275, 350, 390, 410 и 450 °С:  ; ; ; ; ; ;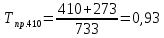 ; ; . .Энтальпию нефтяных паров сырья при атмосферном давлении можно определить по формуле Найдем энтальпию нефтяных паров сырья при атмосферном давлении. При 275 °С: 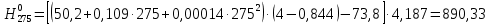 кДж/кг; кДж/кг;При 350 °С: 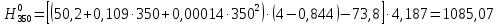 кДж/кг; кДж/кг;При 390 °С:  ; ;При 410 °С:  кДж/кг; кДж/кг;При 450 °С:  кДж/кг. кДж/кг.Приведенные температуры для гидрогенизата рассчитываем при температурах 275, 350, 390, 410 и 450˚С:    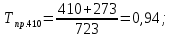 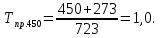 Найдем энтальпию нефтяных паров гидрогенизата при атмосферном давлении. При 275 °С:  кДж/кг; кДж/кг;При 350 °С: 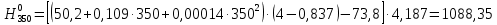 кДж/кг; кДж/кг;При 390 °С:  кДж/кг; кДж/кг;При 410 °С: 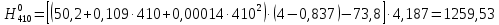 кДж/кг; кДж/кг;При 450 °С: 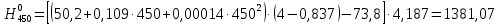 кДж/кг. кДж/кг.Приведенные температуры для бензина-отгона рассчитываем при температурах 275, 350, 390, 410 и 450˚С:   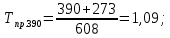  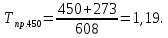 Найдем энтальпию нефтяных паров бензина-отгона при атмосферном давлении. При 275 °С:  кДж/кг; кДж/кг;При 350 °С:  кДж/кг; кДж/кг;При 390 °С: 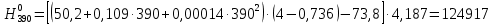 кДж/кг; кДж/кг;При 410 °С: 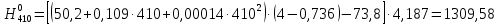 кДж/кг; кДж/кг;При 450 °С: 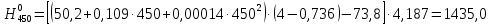 кДж/кг. кДж/кг.Далее находим энтальпию сырья при повышенном давлении по уравнению: где ΔН – поправка к энтальпии. Поправку к энтальпии нефтяных паров нефтепродуктов можно найти из формулы  . .Полученные данные для сырья, гидрогенизата и бензина-отгона сведены в таблицах 2.18-2.20 соответственно. Таблица 2.18 – Определение энтальпий паров сырья
Таблица 2.19 – Определение энтальпий паров гидрогенизата
Таблица 2.20 – Определение энтальпий паров бензина-отгона
Энтальпия жидких нефтепродуктов находится по формуле  , ,где α = 0,403·t + 0,000405·t2. Для ГСС t = 340 °С; находим α α = 0,403·340 + 0,000405·3402 = 183,84. Тогда энтальпия сырья  кДж/кг. кДж/кг.Для ГПС t = 360 °С; находим α α = 0,403·360 + 0,000405·3602 = 197,57. Тогда энтальпия гидрогенизата  кДж/кг. кДж/кг.Энтальпия газообразного сероводорода в зависимости от температуры приведена в таблице 2.21 [27]. Таблица 2.21 Энтальпия газообразного сероводорода при атмосферном давлении
Энтальпию водородсодержащих и углеводородных газов определяют, как сумму произведений энтальпий компонента на их массовую концентрацию или как произведение средней теплоемкости смеси газов на соответствующую температуру. Среднюю теплоемкость смеси газов, например ЦВСГ, можно рассчитать по формуле Ср.см.= Σ Срш· 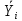 , , где Ср.см. – средняя теплоемкость смеси газов, кДж/(кг*оС); Срш – средняя теплоемкость компонентов смеси газов при соответствующих температуре и давлении, кДж/(кг*оС); 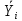 – массовая доля компонентов смеси газов. – массовая доля компонентов смеси газов.Энтальпию водорода находим по формуле: НН2= СН2·t, где СН2– теплоемкость водорода, кДж/(кг*оС); t – температура, оС. Среднюю массовую теплоемкость водорода принимаем 14,6 кДж/(К·°С) [27]. Расчет энтальпий СВСГ, ЦВСГ и УВГ представлен в таблицах 2.22-2.24. Энтальпии паров компонентов ЦВСГ, СВСГ и УВГ определили по графическим зависимостям [27]. Таблица 2.22 – Расчет энтальпии СВСГ при давлении 3,8-4,0 МПа в зависимости от температуры
Таблица 2.23 – Расчет энтальпии ЦВСГ при давлении 3,8-4,0 МПа в зависимости от температуры
Таблица 2.24 – Расчет энтальпии УВГ при давлении 3,8-4,0 МПа в зависимости от температуры
Построили зависимость полученных энтальпий сырья, гидрогенизата, бензина-отгона, сероводорода, СВСГ, ЦВСГ и УВГ при различных температурах (рис. 2.1-2.7) и определили энтальпии нефтепродуктов при фактических параметрах. 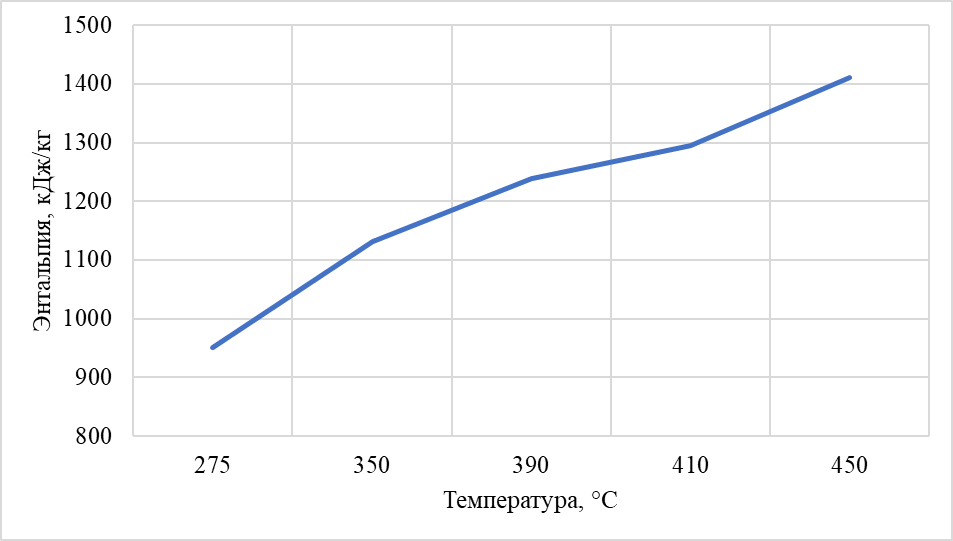 Рис. 2.1 – Энтальпия паров сырья при повышенной температуре  Рис. 2.2 – Энтальпия паров гидрогенизата при повышенной температуре  Рис. 2.3 – Энтальпия паров бензина-отгона при повышенной температуре 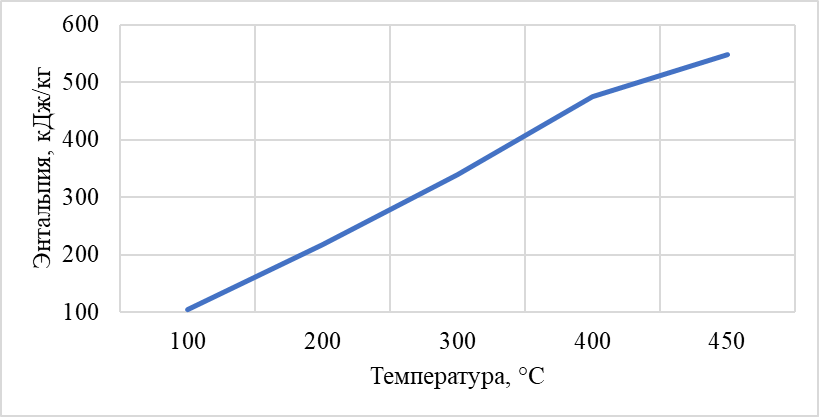 Рис. 2.4 – Энтальпия сероводорода при повышенной температуре 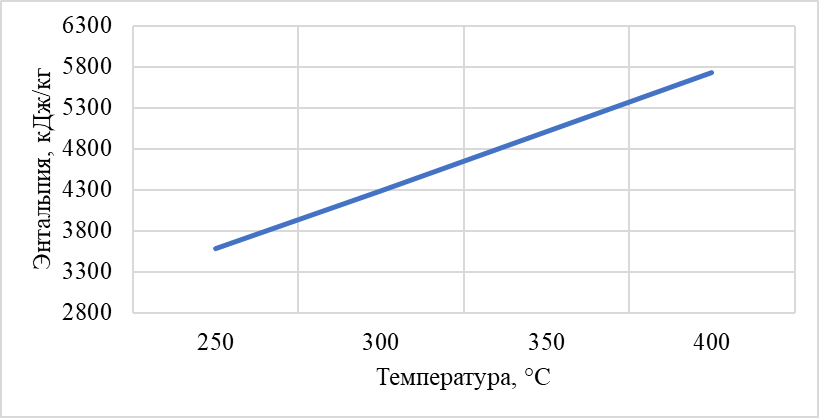 Рис. 2.5 – Энтальпия СВСГ при повышенной температуре  Рис. 2.6 – Энтальпия ЦВСГ при повышенной температуре 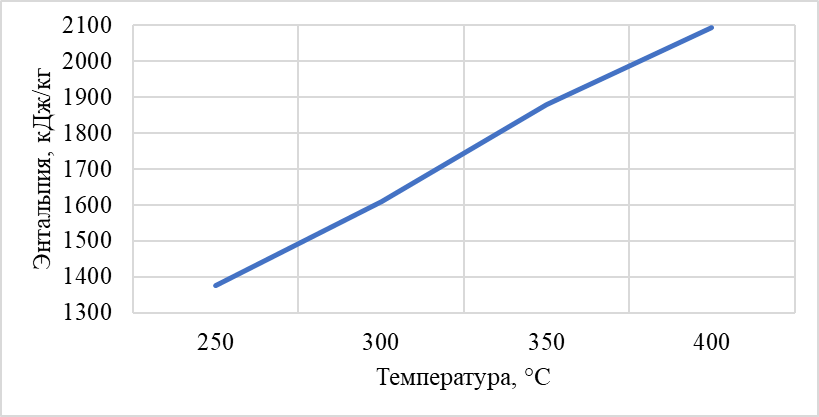 Рис. 2.7 – Энтальпия УВГ при повышенной температуре | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

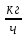
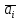
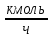
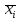

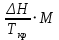 , кДж/(кмоль °С)
, кДж/(кмоль °С)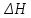 , кДж/кг
, кДж/кг