курсовой проект Бугаёвой. Курсовой проект по пахт разработать конструкцию и рассчитать конденсатор для охлаждения и конденсации газового потока состава 50 H
 Скачать 1.24 Mb. Скачать 1.24 Mb.
|
1 Аналитический обзор рассматриваемого процессаПриводится общая информация о проектируемом процессе- процессе конденсации Химизм процесса и форма зависимости скорости реакции от концентрации и температуры не зависят от конструкции аппарата. Конструктивные особенности реактора оказывают воздействие только на физические процессы в аппарате и уже через посредство этих процессов - на скорость и селективность реакции. Химическая термодинамика - раздел физической химии, изучающий процессы взаимодействия веществ методами термодинамики. Применение термодинамического подхода к химическим реакциям основано на том, что в фундаментальном уравнении Гиббса в качестве переменных можно использовать как массы или количества независимых компонентов, - если условия задачи не требуют детального рассмотрения химического равновесия, -так и массы (количества) составляющих веществ совместно с уравнениями связи, описывающими химические реакции, - когда требуется подробное описание химического равновесия. Химическая кинетика или кинетика химических реакций -раздел физической химии, изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений. Предметом химической кинетики является изучение всех факторов, влияющих на скорость как суммарного процесса, так и всех промежуточных стадий. Конденсация – это процесс, обратный процессу испарения. При конденсации молекулы пара возвращаются в жидкость. В закрытом сосуде жидкость и ее пар могут находиться в состоянии динамического равновесия, когда число молекул, вылетающих из жидкости, равно числу молекул, возвращающихся в жидкость из пара, т. е. когда скорости процессов испарения и конденсации одинаковы. Такую систему называют двухфазной. Пар, находящийся в равновесии со своей жидкостью, называют насыщенным. Число молекул, вылетающих с единицы площади поверхности жидкости за одну секунду, зависит от температуры жидкости. Число молекул, возвращающихся из пара в жидкость, зависит от концентрации молекул пара и от средней скорости их теплового движения, которая определяется температурой пара. Отсюда следует, что для данного вещества концентрация молекул пара при равновесии жидкости и ее пара определяется их равновесной температурой. Установление динамического равновесия между процессами испарения и конденсации при повышении температуры происходит при более высоких концентрациях молекул пара. Так как давление газа (пара) определяется его концентрацией и температурой, то можно сделать вывод: давление насыщенного пара p0 данного вещества зависит только от его температуры и не зависит от объема. Поэтому изотермы реальных газов на плоскости (p, V) содержат горизонтальные участки, соответствующие двухфазной системе (рис. 1). 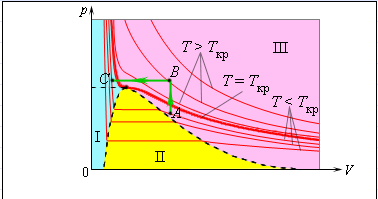 Рисунок 1 - Изотермы реального газа. Область I – жидкость, область II – двухфазная система «жидкость + насыщенный пар», область III – газообразное вещество. K – критическая точка Теория процессаОсновные физические свойства аммиака: бесцветный газ; резкий запах; хорошая растворимость в воде (на один объём воды 700 объёмов аммиака при 20°С, при 0°С – 1200); легче воздуха. Аммиак сжижается при температуре -33°С и становится твёрдым при -78°С. Критическая температура аммиака равна 132,4°С. Концентрированный раствор содержит 25 % аммиака и имеет плотность 0,91 г/см3. Жидкий аммиак растворяет неорганические и органические вещества, но не проводит электрический ток. В водных растворах аммиака содержаться его гидраты состава NH3*H2O и 2NH3·H2O, образующие эвтектики, а также незначительное количество ионизированных молекул в результате реакции: NH3+H2O  NH4+ +OH– NH4+ +OH–Жидкий аммиак растворяет щелочные и щелочно-земельные металлы, фосфор, серу, иод и многие неорганические и органические соединения. При температурах выше 1300°С аммиак диссоциирует на азот и водород: 2NH3= N2+3H2+ΔH При выборе состава смеси учитывают границы взрываемости. Метано-воздушная смесь взрывоопасна при содержании 5,3—14,9% СН4, а аммиачно-воздушная смесь — при содержании 14,0—27% NНз. Таким образом, применяемая в производстве газовая смесь, содержащая 12—13% СН4 и 11—12% NНз, в воздухе взрывобезопасна. Однако такая исходная смесь находится близко к пределам взрываемости, и для предупреждения возможного нарушения состава предусматривают автоматическое регулирование соотношения газов. Для полной безопасности к исходной смеси добавляют азот. Температурой процесса задаются конкретно для каждого производства в зависимости от вида исходного сырья (природный газ, метано-водородная фракция с установок газоразделения и др.). При нарушении состава смеси (увеличении содержания в смеси любого из компонентов) возможно увеличение температуры выше установленного предела, что приводит к оплавлению контактных сеток и остановке всего процесса. Сухой аммиак образует с воздухом взрывчатые смеси, пределы взрываемости которых зависят от температуры и при 18°С ограничены интервалом содержания аммиака в газовой смеси от 0,155 до 0,270 об. долей, как это показано на рисунке2. Эта особенность системы аммиак-воздух учитывается при производстве азотной кислоты окислением аммиака, в котором сырьем я 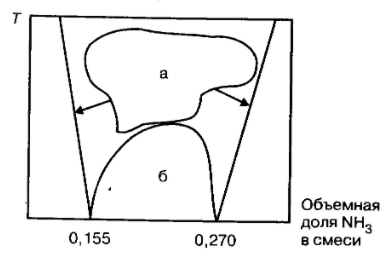 вляется аммиачно-воздушная смесь. . вляется аммиачно-воздушная смесь. .Рисунок 2 Пределы взрывоопасности аммиачно-воздушных смесей: а – пределы взрывоопасности сухой смеси, б – область взрывоопасности смеси над водными растворами аммиака Из межтрубного пространства конденсационной колонны газовая смесь поступает в змеевики аммиачного испарителя , где происходит дополнительная конденсация аммиака из газовой смеси. Смесь охлажденного циркуляционного газа и сконденсировавшегося аммиака возвращается в конденсационную колонну , в сепарационном пространстве которой из газа выделяется часть жидкого аммиака. Далее смесь поступает в колонну синтеза , а затем в скоростной водяной конденсатор (типа труба в трубе ), где охлаждается до 30—35 С. При этом часть аммиака, содержащегося в газовой смеси, конденсируется. В сепараторе , куда после водяного конденсатора поступает газовая смесь, также происходит отделение жидкого аммиака от газа. Далее газ направляется в линию всасывания циркуляционного компрессора, обеспечивающего компенсацию потерь давления в агрегате, и цикл синтеза снова повторяется. Образовавшийся аммиак выделяют из газовой смеси конденсацией. Для превращения газообразного аммиака в жидкость, т. е. для конденсации, газовую смесь охлаждают водой и испаряющимся аммиаком. В системах синтеза аммиака, работающих при давлениях 30 МПа и ниже, газовую смесь охлаждают в две стадии водой в скоростных холодильниках и испаряющимся жидким аммиаком — в аммиачных испарителях. При синтезе аммиака газовая смесь перед поступлением в аммиачный конденсатор проходит через циркуляционный насос. Газовую смесь для синтеза аммиака после водной промывки подвергают обработке аммиачным раствором муравьинокислой закиси меди (для извлечения из смеси окиси углерода), вслед за чем проводят регенерацию раствора. Необходимое условие конденсации пара — выполнение неравенства 5 > 1. Но этого условия недостаточно. Нужно также, чтобы пересыщение было больше критического значения Расчёт теплообменного аппарата включает определение необходимой поверхности теплопередачи, выбор типа аппарата и нормализованного варианта конструкции, удовлетворяющего заданным технологическим условиям оптимальным образом. Для расчётов применяется основное уравнение теплопередачи:  Q = K∆tсрF, где F – площадь поверхности теплообмена, м2 ; ∆tср – температурный напор, °С; К – коэффициент теплопередачи Вт/(м2 · °С). Уравнение теплопередачи дает количественное значение переносимой теплоты через заданную поверхность аппарата. Удельный тепловой поток выступает в качестве тепловой характеристики аппарата, показывает интенсивность теплообменника, а именно его тепловую мощность или максимальную способность к переносу теплоты: q = K∆T, где q – удельный тепловой поток, Вт/м2 ∙ °С. |
