Лабораторная работа 1 "Формы выражения результатов химического анализа пластовых вод нефтяных и газовых месторождений"
 Скачать 22.4 Kb. Скачать 22.4 Kb.
|
|
Лабораторная работа №1 "Формы выражения результатов химического анализа пластовых вод нефтяных и газовых месторождений" Задачи: 1) Рассчитать содержание ионов в весовой, эквивалентной и процент-эквивалентной формах, определить содержание шестого главного иона (Na+ + К+), , выразить химический состав воды с помощью формулы М. Г. Курлова. В таблице 5 приводятся варианты с данными для химического анализа пластовых вод (содержание пяти главных ионов представлено в г/100 г). 2) Рассчитать жесткость и минерализацию воды по пробам (табл.5). Дать характеристику вод по степени жесткости и минерализации используя классификации В. И. Вернадского, О.А. Алексина. Вариант 30.
Найдем эквивалент иона, который является частным от деления ионной массы на валентность иона.
r Na+ = (272 + 9,6 + 2,4) – (180 + 7,3) = 96,7 мг-экв Na+ = 96,7 * 23 = 2224 мг Процент - молярная (эквивалентная) форма. %-экв=(a/ Σra + Σrk)*100 %-экв %-экв (Cl– ) = (272/568) = 47,91%-экв %-экв (SO42–) = (9,6/568) = 1,69 %-экв %-экв (HCO3– )= (2,4/568) = 0,42 %-экв %-экв (Ca2+) = (180/568) = 31,69 %-экв %-экв (Mg2+) = (7,3/568) = 1,29 %-экв %-экв (Na+) = (97/568) = 17 %-экв Формула Курлова 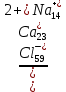 Вода хлоридная натрий-кальциевая. Жесткость воды определяется содержанием растворённых солей кальция и магния. Общая жесткость обусловлена суммарным содержанием ионов Са2+ и Mg2+ . Таблица 1.3 - Классификация О.А. Алексина по степени жесткости (1мг-экв/л равен 2,8о)
(Mg2+ + Са2+) = 0,089 + 3,605 = 3,694 мг-экв/л Немецкий градус жесткости 3,694 * 2,8 = 10,34 о По этой классификации воды принадлежат умеренной жескости. Согласно классификации В. И. Вернадского, О.А. Алексина по общей минерализации выделяют следующие воды. Пресные — с общей минерализацией до 1 г/л, Солоноватые — от 1 до 10 г/л, Соленые — от 10 до 50 г/л Рассолы — 50 до 400 и более г/л (слабые (50-100), крепкие (100-270), очень крепкие (270-350) и сверхкрепкие (> 350)). Минерализация воды определяется содержанием растворённых минеральных веществ и рассчитывается как арифметическая сумма весовых количеств всех ионов в 1л (дм3) воды 0,932 + 0,459 + 0,147 + 3,605 + 0,089 + 2,224 = | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
