Лабораторные работы по неорганической химии. лаб орг ответы 1. Лабораторная работа 1. Качественное определение углерода, водорода, хлора в органических соединениях
 Скачать 121.5 Kb. Скачать 121.5 Kb.
|
|
Раздел 1. Состав и строение органических соединений. Тема 1.1 Элементарный анализ органических соединений. Лабораторная работа №1. Качественное определение углерода, водорода, хлора в органических соединениях. Цель работы: Методом качественного анализа определить наличие углерода, водорода и хлора в органических веществах. Практическая часть: Опыт 1. Определение углерода и водорода сожжением вещества с оксидом меди (II). Химизм процесса: t0 C  10H22 + 35CuO 12CO2 + 11H2O + 35Cu 10H22 + 35CuO 12CO2 + 11H2O + 35CuНаблюдение: Выделяется газ, при пропускании которого через раствор Ca(OH)2 известковая вода мутнеет. Белые порошок CuSO4 бесцветное вещество окрашивается в голубой цвет. Чёрный порошок оксида меди окрашивается в красный цвет. Вывод: Так как при окислении органического вещества образуется CO2 и H2O, следовательно вещество содержит C и Н. Опыт 2. Определение хлора по зелёной окраске пламени ( метод Бейльштейна). Химизм процесса: 2  CHCL3 + 5CuO CuCL2 + 4CuCL + 2CO2 + H2O CHCL3 + 5CuO CuCL2 + 4CuCL + 2CO2 + H2OНаблюдение: В пламени спиртовки медная проволочка красного цвета, на воздухе покрывается чёрным налётом CuO. При внесении органического вещества на медной проволоке в пламя спиртовки оно окрашивается в зелёный цвет (проба Бейльштейна). Вывод: Соли меди CuCL и CuCL2 окрашивают пламя в зелёный цвет, сто доказывает наличие хлора в органическом веществе. Техника безопасности: При работе соблюдать технику безопасности: аккуратно работать со стеклянной посудой и нагревательными приборами. Контрольные вопросы к отчёту. Какие качественные методы применяют для определения азота и серы в органических соединениях? На чём основан количественный анализ органических соединений? Ответы к контрольным вопросам: Определение азота: органические соединения, содержащие азот сплавляют с небольшим количеством натрия, азот при этом превращается +Fe+2 +Fe+3 N   aCN A B (синее окрашивание). aCN A B (синее окрашивание).Определение серы: органические соединения, содержащие серу, сплавляют с натрием, образуется сульфид свинца. N  a2S + Pb(NO3)2 2NaNO3 + PbS a2S + Pb(NO3)2 2NaNO3 + PbS2. Количественный анализ – это анализ, основанный на сжигании органических веществ в токе кислорода в приборах, имеющих поглотительные трубки, которые поглощают продукты сгорания. Если органическое вещество содержит углерод, водород, азот и кислород, то улавливают образовавшиеся при горении CO2, H2O, при этом азот выделится в свободном виде. Раздел 2. Углеводороды. Тема 2.1 Предельные углеводороды (алканы). Лабораторная работа 2. Получение метана. Изучение его свойств. Цель работы: Получить метан в лаборатории и исследовать его отношение к бромной воде и к перманганату калия (KMnO4). Практическая часть: Опыт 1. Получение метана Химизм процесса: C  H3COONa + NaOH CH4 + Na2CO3 H3COONa + NaOH CH4 + Na2CO3 Горение метана C  H4 + 2O2 CO2 + 2H2O H4 + 2O2 CO2 + 2H2OНаблюдение: Поджигали выделяющийся газообразный метан у конца газоотводной трубки. Метан горит голубоватым несветящимся пламенем. Вывод: Нагревание натриевых солей карбоновых кислот с натриевой известью является общим лабораторным способом получения предельных углеводородов. Опыт 2. Взаимодействие метана с бромной водой и перманганатом калия (KMnO4). Наблюдение: Обесцвечивание растворов бромной воды и перманганата калия не происходит. Вывод: В обычных условиях алканы устойчивы к действию окислителей. Реакции замещения у них идут в довольно жестких условиях, к реакциям присоединения алканы не способны. Контрольные вопросы к отчёту: 1.В какие химические реакции вступают алканы? По какому механизму они протекают? 2.Как получают алканы в промышленности? Ответы к контрольным вопросам: 1.Алканы вступают в реакции замещения: галогенирование, нитрование, сульфохлорирование, сульфоокисления, окисления, крекинга, пиролиза алканов и дегидрирования. Алканы вступают в реакции по радикальному механизму, так как связи C – H малополярные, а связи C - C неполярные. 2. Промышленный способ получения алканов – крекинг – это расщепление алканов при t0 = 6000 с разрывом C-C связей. Раздел 2. Углеводороды. Тема 2.2 Непредельные углеводороды. Лабораторная работа 3. Получение этилена. Изучение его свойств. Цель работы: Получить этилен и изучить его свойства. Практическая часть: Опыт 1. Получение этилена Химизм процесса: нагрели C  2H5OH + H2SO4 (КОНЦ.) CH3 – CH2 –OSO3H + H2O 2H5OH + H2SO4 (КОНЦ.) CH3 – CH2 –OSO3H + H2O Этилсерная кислота C   H3 – CH2 – OSO3H C2H4 + H2SO4 H3 – CH2 – OSO3H C2H4 + H2SO4H2SO4, t0 C    H2 – CH2 C2H4 + H2O H2 – CH2 C2H4 + H2OH OH Наблюдение: Изменяется цвет реакционной смеси., выделяется бесцветный газ. Вывод: Реакции дегидрирования спиртов (отщепление воды) – один из способов получения алкенов. Опыт 2. Свойства этилена: горение  Химизм процесса: C2H4 + 3O2 2CO2 + 2H2O Химизм процесса: C2H4 + 3O2 2CO2 + 2H2O Наблюдение: Этилен горит ярким светящимся пламени. Вывод: Алкены, как и все углеводороды, горят с образованием углекислого газа. Опыт 3. Присоединение к этилену брома. Химизм процесса: C    2H4 + Br – Br CH2 – CH2 2H4 + Br – Br CH2 – CH2 Br Br Наблюдение: При пропускании этилена через раствор Br2 , бромная вода обесцвечивается. Вывод: Реакции присоединения галогенов к алкенам протекают легко. Опыт 3. Отношение этилена к окислителям. Химизм процесса: KMnO4 H-OH C  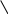 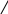  2H4 + [O] CH2 – CH2 CH2 –CH2 2H4 + [O] CH2 – CH2 CH2 –CH2   H2SO4 H2SO4 O OH OH Наблюдение: При пропускании этилена через раствор KMnO4 раствор обесцвечивается. Вывод: Алкены легко окисляются раствором KMnO4 . Изучив свойства, пришли к выводу: Алкены горят, для них характерны реакции присоединения и окисления. Техника безопасности: Лабораторную работу проводить в вытяжном шкафу. Соблюдать правила безопасной работы с сухим топливом. Контрольные вопросы к отчёту: В какие химические реакции вступают алкены? Как получают этилен в промышленности и в лаборатории? Ответы к контрольным вопросам: Алкены вступают в реакции электрофильного присоединения, легко окисляются Промышленные способы: Ni а  ) Дегидрирование алканов: CH3- CH3 C2H2 + H2 ) Дегидрирование алканов: CH3- CH3 C2H2 + H2 t0= 6000 б  ) Крекинг и пиролиз алканов: CH3- CH2 –CH3 CH2=CH2 +CH4 ) Крекинг и пиролиз алканов: CH3- CH2 –CH3 CH2=CH2 +CH4Лабораторные способы: H+ а    ) Дегидратация спиртов: CH2 – CH2 CH2=CH2 + H2O ) Дегидратация спиртов: CH2 – CH2 CH2=CH2 + H2OH OH б) дегидрогалогенирование галогенпроизводных алканов: KOH C  H3 –CH2-CH2- CH2CL CH3-CH2-CH=CH2 + HCL H3 –CH2-CH2- CH2CL CH3-CH2-CH=CH2 + HCLв) получение алканов из дигалогенпроизводных: Zn C    H3-CH2-CH-CH2 CH3-CH2-CH-CH2 +ZnCL2 H3-CH2-CH-CH2 CH3-CH2-CH-CH2 +ZnCL2CL CL Раздел 2. Углеводороды. Тема 2.3. Непредельные углеводороды. Лабораторная работа №4. Получение ацетилена, изучение его свойств. Цель работы: Получить ацетилен, исследовать его свойства. Практическая часть. Опыт 1. Карбидный метод получения ацетилена. Химизм процесса: C  aC2 +H2O C2H2 + Ca(OH)2 aC2 +H2O C2H2 + Ca(OH)2 Наблюдение: Выделяется бесцветный газ, реакция протекает очень бурно. Вывод: Карбидный способ (гидролиз карбида калия) – это один из способов получения ацетилена. Опыт 2. Взаимодействие ацетилена с бромом. Химизм процесса: I  . НC ≡ CН + Br-Br HC=CH . НC ≡ CН + Br-Br HC=CH| | Br Br Br Br | | I  . HC=CH + Br-Br CH-CH . HC=CH + Br-Br CH-CH| | | | Br Br Br Br Наблюдение: При пропускании ацетилена через бромную воду, бромная вода обесцвечивается. Вывод: Алкины легко вступают в реакции присоединения. Обесцвечивание бромной воды является качественной реакцией на кратную связь. Опыт 3. Отношение ацетилена к окислителям. Химизм процесса: OH KMnO4, H2SO4 |  C2H2 + [O] C=O → H2CO3 → CO2 + H2O C2H2 + [O] C=O → H2CO3 → CO2 + H2O| C=O | OH Наблюдение: При пропускании ацетилена через раствор KMnO4, раствор обесцвечивается. Вывод: Алкины легко окисляются раствором KMnO4. Обесцвечивание раствора KMnO4 является качественной реакцией на кратную связь. Опыт 4. Образование ацетиленидов серебра. Химизм процесса: NH3 C  2H2 + Ag2O Ag-C ≡ C –Ag +H2O 2H2 + Ag2O Ag-C ≡ C –Ag +H2OНаблюдение: При пропускании ацетилена через аммиачный раствор оксида серебра образуется осадок чёрного цвета, который при нагревании взрывается. Вывод: Атомы водорода при атомах углерода связанных тройной связью обладают высокой подвижностью, поэтому способны замещаться на атомы металлов, образуя ацетилениды металлов. Ацетилениды являются взрывчатыми веществами. Контрольные вопросы к отчёту: 1.В какие реакции вступают алкины? 2.Для каких алкинов характерны реакции замещения? Ответы к контрольным вопросам: 1.Алкины вступают в реакции электрофильного присоединения, окисления, полимеризации и замещения. 2.В реакции замещения вступают алкины с концевой тройной связью, образуя металл производные ацетилениды. Раздел 2. Углеводороды. Тема 2.3 Ароматические углеводороды. Лабораторная работа №5. Изучение свойств бензола. Цель работы: Изучить химические и физические свойства бензола. Практическая часть: Опыт 1. Растворимость бензола в различных растворителях. Химизм процесса: Наблюдение: 1 пробирка: бензол + вода – образовалось два слоя. 2 пробирка: бензол + спирт – однородная смесь (раствор) 3 пробирка: бензол + эфир – однородный раствор Вывод: Бензол в воде нерастворим, но хорошо растворяется в органических растворителях. Опыт 2. Горение бензола. Химизм процесса:  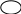 2  + 15 O2 12CO2 + 6H2O + С + 15 O2 12CO2 + 6H2O + СНаблюдение: Бензол горит ярким коптящим пламенем. Вывод: Бензол горит, образуя углекислый газ и воду. Опыт 3. Действие бромной воды на бензол: Химизм процесса: Бензол + бромная вода Наблюдение: Нижний слой (бромная вода) обесцвечивается, а верхний слой (бензол) окрашивается в коричневато-жёлтый цвет. Вывод: Бром легче растворяется в бензоле, чем в воде, и поэтому переходит в верхний бензольный слой. Присоединение брома в этих условиях не происходит. Опыт 4. Действие перманганата калия KMnO4 на бензол. Х  имизм процесса: имизм процесса:K 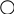 MnO4(р-р) + H2SO4(конц) + MnO4(р-р) + H2SO4(конц) + Наблюдение: Розовый раствор KMnO4 не обесцвечивается. Вывод: Бензол устойчив к действию окислителей. Опыт 5. Получение бензолсульфокислоты. Химизм процесса:  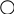  t0 t0 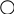 + HO-SO3H - SO3H + H2O + HO-SO3H - SO3H + H2OНаблюдение: Реакционную массу выливают в пробирку с холодной водой (10мл). Образуется прозрачный раствор. Вывод: В отличие от бензола, сульфокислота растворима в воде. Контрольные вопросы к отчёту: В какие химические реакции вступает бензол? В чём отличие химических свойств бензола от его гомологов? Ответы к контрольным вопросам: 1. Бензол вступает в реакции галогенирования, в присутствии катализатора AlCl3 . Бензол вступает в реакции электрофильного замещения. 2.Гомологи бензола легче вступают в реакции замещения и легче окисления.  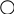  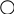 Kat AlCl3 Kat AlCl3  - CH3 + 2CL2 -CH3 + 2 HCL - CH3 + 2CL2 -CH3 + 2 HCL  CL Раздел 3. Соединения с однородными функциями. Тема 3.1 Галогенпроизводные углеводородов. Лабораторная работа № 6. Получение галогенпроизводных алканов и изучение их свойств. Цель работы: Закрепить знания по способам получения галоидных алкилов и свойства ароматических галогенпроизводных. Практическая часть: Опыт 1. Получение хлористого этила. Химизм процесса: C   2H5OH + HOSO3H C2H5-O-SO3H +H2O 2H5OH + HOSO3H C2H5-O-SO3H +H2O N  aCL + H2SO4 HCL + NaHSO4 aCL + H2SO4 HCL + NaHSO4  C  2H5-O-SO3H +HCL C2H5CL + H2SO4 2H5-O-SO3H +HCL C2H5CL + H2SO4 Наблюдение: Выделяющийся хлористый этил загорается, образуя характерное колечко, окрашенное в зелёный цвет. Вывод: Взаимодействие спиртов с галогенпроизводными – один из способов получения галоидных алкилов. Опыт 2. Прочность галогена, стоящем в бензольном кольце. Химизм процесса:    - CL + AgNO3 → Наблюдение: Появление белого осадка или мути AgCl не обнаружено. Вывод: Атом галогена сопряжён с бензольным кольцом. Сопряжение уменьшает полярность связи C-Hal и тем самым затрудняет условия для протекания реакций замещения. Опыт 3. Подвижность галогена, стоящего в боковой цепи. Химизм процесса: C  6H5-CH2CL + HOH C6H5-CH2OH + HCL 6H5-CH2CL + HOH C6H5-CH2OH + HCLH  CL + AgNO3 AgCl + HNO3 CL + AgNO3 AgCl + HNO3 Наблюдение: Выпадает белый осадок. Вывод: Атом галогена в α - положении углеродного атома боковой цепи обладает большой подвижностью. Техника безопасности: Лабораторную работу проводить в вытяжном шкафу. Контрольные вопросы к отчёту: В какие химические реакции вступают галогенпроизводные углеводородов? Какие методы получения галогенопроизводных углеводородов, Вам известны? Ответы к контрольным вопросам: Для галогенпроизводных углеводородов характерны реакции нуклеофильного замещения, дегидрирования. Способы получения: а) галогенирование алканов; б) гидрогалогенирование алкенов и алкинов; в) галогенирование алкенов и алкинов. Литература: Аверина А.В. , Снегирёва А.Я.Лабораторный практикум по органической химии – М.: В. школа, 1980г, с.41-47. Раздел 3. Соединение с однородными функциями. Тема 3.2 Гидроксильные соединения и их производные. Лабораторная работа №7. Исследование свойств одноатомных и многоатомных спиртов. Цель работы: Исследовать свойства одноатомных и многоатомных спиртов. Практическая часть: Опыт 1. Отношение спиртов к индикаторам. Химизм процесса: C6H5OH + фенолфталеин + лакмус Наблюдение: Окраска индикаторов в спирте не изменяется. Вывод: Окраска индикаторов в спиртах не изменяется, так как спирты являются не электролитами. Опыт 2. Образование и гидролиз алкоголятов. а) Химизм процесса: 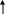 2  C2H5OH +2Na 2 CH3-CH2-ONa + H2 C2H5OH +2Na 2 CH3-CH2-ONa + H2 Наблюдение: Выделяется газ, реакция идёт бурно. Вывод: Одноатомные спирты взаимодействуют с активными металлами, с образованием алкоголятов металлов. б) Химизм процесса: C2H5ONa + H2O + Фенолфталеин .  C2H5ONa + H2O C2H5OH + NaOH C2H5ONa + H2O C2H5OH + NaOHНаблюдение: Фенолфталеин окрашивает раствор в малиновый цвет. Вывод: Алкоголяты металлов подвергаются гидролизу, с образованием спирта и основания. Опыт 3. Окисление этилового спирта. Химизм процесса: t0 C   H3-CH2OH + CuO CH3-C=O + Cu +H2O H3-CH2OH + CuO CH3-C=O + Cu +H2OH Наблюдение: В пламени спиртовки медная проволока красного цвета. На воздухе раскалённая медная проволока покрывается чёрным налётом CuO. В спиртовке медная проволока вновь приобретает красный цвет , вследствие восстановления оксида меди до Cu. Вывод: Спирты окисляются CuO, с образованием альдегидов. Опыт 4. Взаимодействие глицерина с Cu(OH)2. Химизм процесса: C  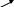 H2-OH CH2-O O-CH2 H2-OH CH2-O O-CH2   OH Cu OH Cu    н. у. н. у.C  H-OH + Cu CH-O O-CH + 2H2O H-OH + Cu CH-O O-CH + 2H2O    OH OHОсадок голубого CH2-OH цвета CH2-OH OH-CH2 Раствор ярко-синего цвета Наблюдение: Осадок растворяется, образуя раствор ярко-синего цвета. Реакция идёт в обычных условиях. Вывод: Многоатомные спирты в отличии от одноатомных взаимодействуют с оксидами и гидроксидами тяжёлых металлов. Реакция взаимодействия многоатомных спиртов с Cu(OH)2 является качественной реакцией на многоатомные спирты. Техника безопасности: Лабораторную работу проводить в вытяжном шкафу. Соблюдать правила безопасной работы с нагревательными приборами. Контрольные вопросы к отчёту: Какая реакция называется реакцией этерификации? Какими химическими реакциями можно доказать, что спирты являются амфотерными веществами? Почему кислотность глицерина выше, чем у одноатомных спиртов? Ответы к контрольным вопросам: Этерификация – это процесс образования сложных эфиров путём взаимодействия одноатомного спирта с карбоновыми и минеральными кислотами. Спирты – амфотерные соединения, взаимодействуют как кислоты (реакции с металлами), и как основания (реакции с кислотой). Предельные одноатомные спирты взаимодействуют с активными металлами с образованием солей (алкоголятов). 2  CH3-OH + 2Na 2 CH3-ONa + H2O CH3-OH + 2Na 2 CH3-ONa + H2OАлкоголят натрия Спирты не реагируют со щелочами. Спирты как основания взаимодействуют с сильными кислотами, образуя катионы аксония. C  H3-OH + HBr [CH3-O-H] + Br - H3-OH + HBr [CH3-O-H] + Br - H 3. Глицерин – трёхатомный спирт. Кислотность его больше, чем у одноатомных спиртов, так как увеличение числа гидроксильных групп усиливает кислотный характер. Литература: Аверина А.В. , Снегирёва А.Я.Лабораторный практикум по органической химии – М.: В. школа, 1980г, с.49-52. Раздел 3. Соединения с однородными функциями. Тема 3.3 Гидроксильные соединения и их производные. Лабораторная работа № 8. Исследование свойств фенолов. Цель работы: Изучить свойства фенолов. Практическая часть: Опыт 1. Растворимость фенола в воде. Химизм процесса: Фенол + вода Наблюдение: В холодной воде фенол не растворяется, образуется эмульсия. В горячей воде фенол растворяется, образуя прозрачный раствор. При охлаждении его вновь образуется муть. Вывод: При повышении температуры растворимость увеличивается. Опыт 2. Взаимодействие фенола с бромом. Химизм процесса: Фенол + бромная вода Br     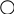  - OH + 3Br2 Br - - OH + 3HBr - OH + 3Br2 Br - - OH + 3HBr Br Наблюдение: Образуется осадок белого цвета - Трибромфенола. Вывод: Реакция замещения в бензольном кольце у фенола протекает легче, чем у бензола. Образуется трёхзамещённые фенолы в положениях 2, 4,6. В данной реакции образуется 2, 4, 6- трибромфенол. Опыт 3. Получение фенолята натрия. Химизм процесса:  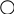  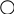  - OH + NaOH - ONa + H2O - OH + NaOH - ONa + H2OНаблюдение: Образуется полупрозрачный раствор. Вывод: Фенол взаимодействуют со щелочью, в чём проявляется ярче выраженные кислотные свойства, по сравнению со спиртами. Опыт 4. Разложение фенолята натрия соляной кислотой. Химизм процесса: C  6H5ONa +HCL C6H5OH + NaCL 6H5ONa +HCL C6H5OH + NaCLНаблюдение: Появляется мутный раствор, то есть образуется фенол. Вывод: Фенол, как слабая кислота вытесняется более сильной кислотой. Опыт 5. Взаимодействие фенола с FeCL3. Химизм процесса: Фенол (раствор) + FeCL3 (раствор) Наблюдение: Появляется фиолетовое окрашивание. Вывод: Реакция с FeCL3 является качественной реакцией на фенол. Опыт 6. Цветные реакции на многоатомные фенолы. Химизм процесса: 1 пробирка: пирокатехин + хлорид железа (III). 2 пробирка: резорцин + хлорид железа (III). 3 пробирка: гидрохинон + хлорид железа (III). 4 пробирка: пирогаллол + хлорид железа (III). Наблюдение: В первой пробирке появляется зелёное окрашивание; Во второй пробирке – фиолетовое; В третьей пробирке - зелёная окраска; В четвёртой пробирке – красная окраска. Вывод: Взаимодействие многоатомных фенолов с хлоридом железа (III) является качественными реакциями. Техника безопасности: Работу проводить в вытяжном шкафу. Литература: Аверина А.В. , Снегирёва А.Я.Лабораторный практикум по органической химии – М.: В. школа, 1980г, с58-59. |
