УП 01. Лабы по УП 01. Лабораторная работа 1 Определение меди фотоэлектроколориметрически по окраске её аммиачного комплекса
 Скачать 112.12 Kb. Скачать 112.12 Kb.
|
|
08.09.2021 ЛАБОРАТОРНАЯ РАБОТА №1 «Определение меди фотоэлектроколориметрически по окраске её аммиачного комплекса» Цель работы: определить содержание меди фотоэлектроколориметрическим методом в исследуемом растворе. Посуда и оборудование: мерные колбы (50 и 250 мл), пипетки градуированные (10 мл), бюретка (25 мл), мерный цилиндр (10 мл), спектрофотометр В -1100, груша резиновая, стакан химический. Реактивы: стандартный раствор меди (II) №1 (39,2700 г CuSO4*5H2O, добавить 50 мл H2SO4 и довести до метки в колбе на 1 л), стандартный раствор меди (II) №2 (к 100 мл раствора №1 добавить 50 мл H2SO4, довести до метки в колбе на 1 л), NH4OH (1:1), H2SO4 (2н), вода дистиллированная. Ход работы: 1). Построение градуировочного графика В мерную колбу на 250 мл поместите отмеренные 25 мл стандартного раствора меди (II) №2, содержащего 1 мг/мл меди (II). Нейтрализуйте раствором NH4OH по каплям до мути, далее прибавьте 100 мл этого же раствора, доведите до метки. Приготовьте такое же количество раствора сравнения – добавьте 100 мл раствора NH4OH, доведите до метки в колбе на 1 л. Измерьте оптическую плотность раствора аммиаката меди (II), приготовленного относительно «нулевого» раствора, поочерёдно в кюветах с толщиной поглощающего слоя 2 см. Полученные данные представьте в виде таблицы и графика зависимости оптической плотности от толщины поглощающего слоя при постоянной концентрации меди (II) и длине волны. 2). Проверка закона Бугера-Ламберта Измерьте оптическую плотность раствора аммиаката меди (II), приготовленного относительно «нулевого» раствора, поочерёдно в кюветах с толщиной поглощающего слоя 1 см, 2 см, 5 см. Полученные данные представьте в виде таблицы и графика зависимости оптической плотности от толщины поглощающего слоя при постоянной концентрации меди (II) и длине волны. 3). Проверка закона Бера и построение градуировочного графика В ряд мерных колб на 50 мл поместите точно отмеренные 2,5;5,0;7,5;10;12,5;15 мл стандартного раствора №2, содержащего 1 мг/мл меди (II). Растворы в каждой колбе нейтрализуйте раствором аммиака до появления слабой мути и прибавьте по 10 мл избытка раствора аммиака, после чего доведите растворы до метки и тщательно перемешайте. Измерьте оптические плотности полученных растворов в кюветах с толщиной поглощающего слоя 2 см и λ = 670 нм относительно «нулевого» раствора. Градуировочная прямая должна иметь угол наклона около 45°. 4). Определение содержания меди (II) в исследуемом растворе методом градуировочного графика. Получите у лаборанта Ваш вариант исследуемого раствора соли меди (II) неизвестной концентрации в мерной колбе на 50 мл. Доведите до метки этот раствор дистиллированной водой и тщательно перемешайте. Для приготовления окрашенного комплекса аммиаката меди (II), 5 мл исследуемого раствора поместите в колбу на 50 мл, нейтрализуйте раствором аммиака до появления слабой мути и прилейте еще 10 мл избытка аммиака, доведите водой до метки и тщательно перемешайте. Измерьте оптическую плотность аммиачного исследуемого раствора в кювете с толщиной поглощающего слоя 2 см и λ = 670 нм относительно «нулевого» раствора. Используя градуировочный график, найдите концентрацию меди (II), соответствующую оптической плотности, а также рассчитайте относительную погрешность определения для метода. 5). Определение содержания меди (II) в исследуемом растворе методом добавок В 2 мерные колбы ёмкостью 50 мл поместите по 5 мл исследуемого раствора. В одну из колб добавьте 1 мл стандартного раствора №2 моли меди (II), содержащего 1 мг/мл меди (II). В обе колбы прилейте по 10 мл раствора аммиака, доведите водой до метки, тщательно перемешайте и измерьте оптическую плотность в кюветах с толщиной поглощающего слоя 2 см и λ = 670 нм относительно «нулевого» раствора. Обработка результатов: 1). Построение градуировочного графика Таблица 1. Выбор длины волны
Наибольшее значение оптической плотности А пришлось на длину волны λ = 610 нм, следовательно, последующие измерения будут проводиться при этой длине волны. График 1. Зависимость А от λ 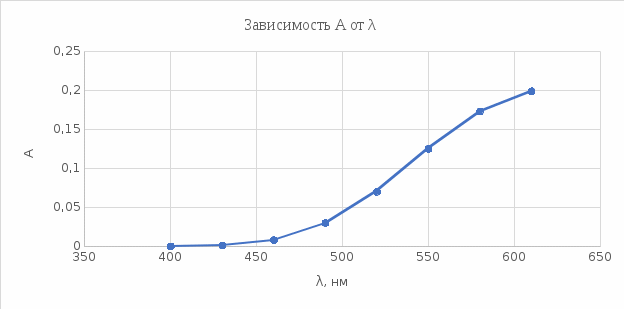 2). Проверка закона Бугера-Ламберта Таблица 2. Выбор толщины поглощающего слоя кюветы
Наибольшее значение оптической плотности пришлось на кювету с толщиной поглощающего слоя 5 см, следовательно, дальнейшие измерения будут проводиться с выбранной толщиной поглощающего слоя. 3). Проверка закона Бера и построение градуировочного графика Таблица 3. Значения оптических плотностей калибровочных растворов
График 2. Градуировочный график зависимости А от С (мг/мл). 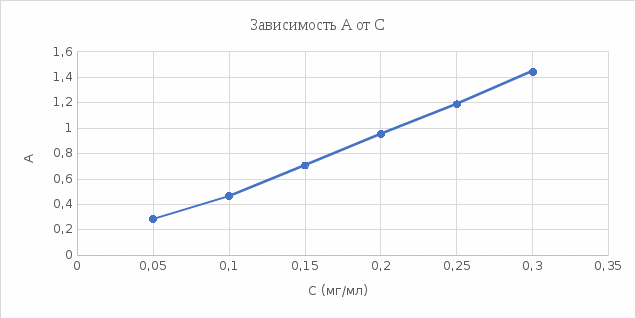 4). Определение содержания меди (II) в исследуемом растворе методом градуировочного графика. Ах (1) = 0,474 Ах (2) = 0,473 Ах (3) = 0,473 Ах ср. = 0,4733 График 3. Определение концентрации меди (II) 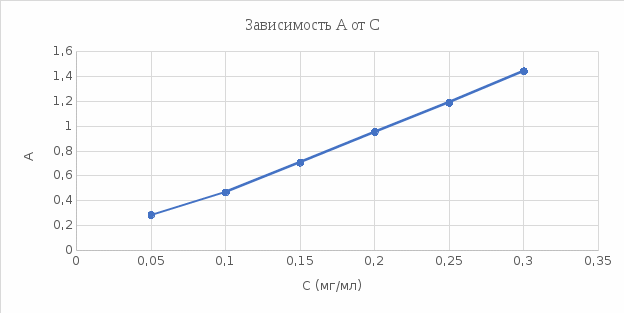 Исходя из градуировочного графика концентрация меди (II) в анализируемом растворе равна 0,1 мг/мл или 5 мг в 50 мл. Поскольку стандартный раствор разбавили в 10 раз, следовательно, 0,1 мг/мл*10 = 1 мг/мл или 1 г/л. Расчёт относительной погрешности: σ = 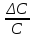 *100% *100%где: ΔС – С(истинное) – С(по графику); С – С(по графику). σ1 = 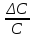 *100% = *100% = 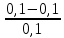 *100% = 0% *100% = 0%Исходя из рассчитанной относительной погрешности для метода градуировочного графика можно обозначить, что погрешностей нет. 5). Определение содержания меди (II) в исследуемом растворе методом добавок Таблица 4. Значения оптических плотностей для метода добавок
Расчёт концентрации меди (II): Сх = Сст* 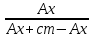 где: Сст – концентрация стандартного раствора №2; Ах – оптическая плотность разбавленного исследуемого раствора; Ах +доб. – оптическая плотность разбавленного исследуемого раствора с добавкой стандартного раствора меди (II). Сх = Сст* 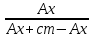 =1* =1* 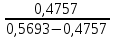 = 5,08 мг/50 мл = 1,016 мг/мл = 5,08 мг/50 мл = 1,016 мг/млПо формуле относительной погрешности из пункта 4, рассчитываем, что: σ2 = 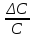 *100% = *100% = 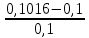 *100% = 1,6% *100% = 1,6%График 4. Зависимость А от концентрации добавки раствора меди (II) 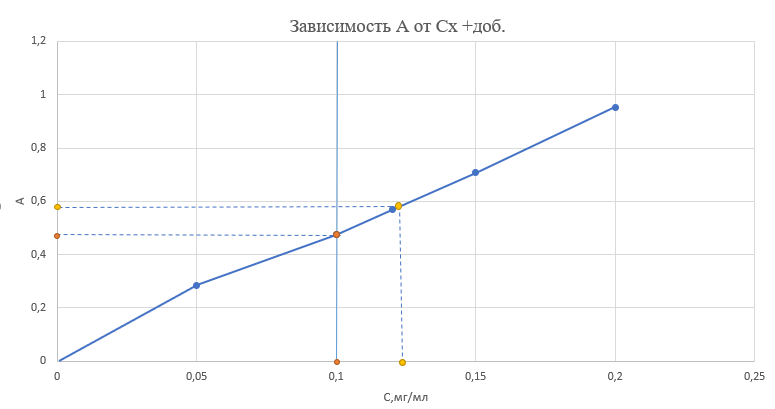 Исходя из графика 4 концентрация исследуемого раствора равна 0,1 мг/мл. Учитывая разбавление в 10 раз: 0,1*10 = 1 мг/мл меди (II) в пробе. По формуле относительной погрешности из пункта 4, рассчитываем, что: σ3 = 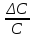 *100% = *100% = 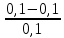 *100% = 0% *100% = 0%Относительная погрешность графического метода добавок равна нулю, значит погрешности в этом методе нет. Вывод: была определена концентрация меди (II) в исследуемом образце с помощью метода добавок, градуировочного графика, а также графического метода добавок. Концентрация меди (II) равна 1,016 мг ± 0,016 (±1,6%) для метода добавок и 1,000 мг для метода градуировочного графика и графического метода добавок. 15.09.2021 ЛАБОРАТОРНАЯ РАБОТА №2 «Фотометрический метод определения меди в воде. ГОСТ 4388-72. Вода питьевая. Методы определения ω (Cu 2+)» Цель работы: определить концентрацию меди в воде, а также овладеть навыками фотометрического метода анализа. Посуда и оборудование: спектрофотометр В-1100, кюветы (l = 5 см), пипетка градуированная (10 мл), пипетка Мора (50 мл), колбы мерные (50 и 100 мл), цилиндр мерный (10 мл), стакан химический. Реактивы: NH4OH (25%), калий-натрий виннокислый (сегнетова соль), CuSO4*5H2O, диэтилдитиокарбамат натрия (0,1%), HCl, крахмал (0,25%), H2SO4 (2н), вода дистиллированная, исследуемая вода. Подготовка к анализу: 1). Приготовление раствора 0,1%-ного диэтилдитиокарбамата натрия: 1 г диэтилдитиокарбамата натрия растворяют в небольшом количестве дистиллированной воды, фильтруют и доводят до объёма 1л. Хранят в склянке из тёмного стекла в тёмном помещении. 2). Приготовление раствора аммиака: Смешивают 25%-ный раствор с водой в соотношении 1:4 на 1 л, то есть 250 мл. 3). Приготовление раствора калия-натрия виннокислого: 50 г сегнетовой соли растворяют в 50 мл воды. 4). Приготовление основного стандартного раствора CuSO4*5H2O: 0,3930 г CuSO4*5H2O растворяют в мерной колбе на 1 л в небольшом количестве дистиллированной воды, подкисленной 1 мл H2SO4, и доводят объём до метки дистиллированной водой. 1 мл раствора – 0,1 мг Cu 2+. 5). Приготовление рабочего стандартного раствора CuSO4*5H2O: Рабочий раствор готовят разбавлением основного в 10 раз дистиллированной водой. 5 мл раствора с концентрацией меди 100 мг/л вносят в мерную колбу на 50 мл и доводят до метки. Раствор получается с концентрацией 10 мг/л Cu 2+. Применяют свежеприготовленным. Ход работы: 1). Проведение анализа: В 7 мерных колб объёмом 100 мл вносят 0,0;0,2;0,4;1,0;2,0;4,0;6,0 мл раствора с концентрацией 10 мг/л Cu 2+. Затем необходимо последовательно влить в колбы по 50 мл дистиллированной воды, 2-4 капли HCl, 2 мл сегнетовой соли, 10 мл раствора аммиака, 2 мл крахмала и 10 мл диэтилдитиокарбамата натрия. После добавления каждого реактива производят перемешивание, доводят раствор до метки дистиллированной водой и выдерживают 10 минут. Массовая концентрация меди в полученных растворах соответственно: 0,00;0,02;0,04;0,1;0,2;0,4;0,6 мг/л. Раствор, не содержащий медь, является раствором сравнения для градуировки. Растворы устойчивы в течение одного часа. 2). Выбор оптимальной длины волны: Раствор с максимальной концентрацией фотометрируют относительно раствора сравнения при длинах волн от 370 до 580 нм поочерёдно с шагом 30 нм. Выбирают длину волны, соответствующую наибольшему значению оптической плотности исследуемого раствора. 3). Градуировка прибора: Измерения проводят в соответствии с руководством по эксплуатации прибора при выбранной длине волны в кюветах с толщиной поглощающего слоя 5 см. 4). Порядок проведения измерений анализируемой пробы воды: В мерную колбу вместимостью 100 мл вносят 50 мл пробы анализируемой воды, 2-4 капли HCl, 2 мл раствора сегнетовой соли, 10 мл раствора аммиака, 2 мл раствора крахмала, 10 мл диэтилдитиокарбамата натрия. После добавления каждого реактива производят перемешивание, доводят раствор до метки дистиллированной водой и выдерживают 10 минут. По истечению 10 минут измеряют оптическую плотность отобранной пробы анализируемой воды по выбранной длине волны, используя холостую пробу в качестве раствора сравнения в кюветах с толщиной поглощающего слоя 5 см. Обработка результатов: 2). Выбор оптимальной длины волны: Таблица 5. Выбор длины волны
График 5. Выбор длины волны 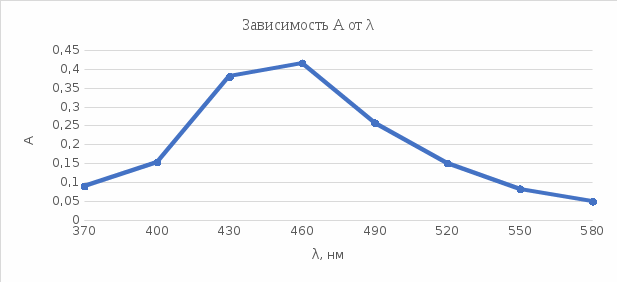 Как видно по графику, наибольшее значение оптической плотности приходится на длину волны 460 нм. Следовательно, в последующих измерениях она будет использована. Таблица 6. Оптические плотности калибровочных растворов
Таблица 7. Оптические плотности исследуемой воды
График 6. Градуировочный график. Определение концентрации меди (II) 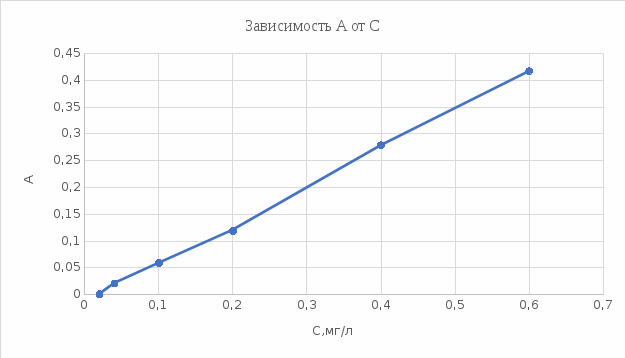 Данный график справедлив как для воды марки «Кубай», так и для технической. Исходя из графика можно понять, что концентрация меди (II) в обоих видах воды фактически равна нулю. Расчёт концентрации меди (II): ὦ (Сu2+) = 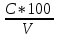 где: С – концентрация меди, найденная по градуировочному графику, мг/л; V – объём пробы, взятый для определения, мл. ὦ (Сu2+) = 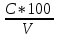 = = 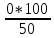 = 0% = 0%Расчёт относительной погрешности: σ = 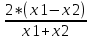 *100% *100%где: х1 – больший результат из 2 параллельных определений; х2 – меньший результат из 2 параллельных определений. σ =  = =  *100% = 0 % *100% = 0 %Вывод: была определена концентрация меди (II) в исследуемых образцах с помощью метода градуировочного графика. Концентрация меди (II) равна 0 мг, следовательно, меди в пробах отсутствует. 29.09.21 ЛАБОРАТОРНАЯ РАБОТА №3 «Спектрофотометрическое определение марганца и хрома при их совместном присутствии» Цель работы: показать возможность применения спектрофотометра для анализа двухкомпонентных смесей на примере определения перманганата калия и дихромата калия при их совместном присутствии. Посуда и оборудование: спектрофотометр В-1100, кюветы (l = 2 см), пипетка градуированная (10 мл), колбы мерные (50 мл), стакан химический. Реактивы: KMnO4 (0,0125 н), K2Cr2O7 (0,025 н), HNO3 (1:3), вода дистиллированная. Ход работы: 1). Выбор длины волны: В 2 мерные колбы на 50 мл помещают по 10 мл KMnO4 и K2Cr2O7. В обе колбы добавляют по 10 мл HNO3 и дистиллированной водой доводят до метки. Измеряют оптическую плотность обоих растворов относительно воды при разных длинах волн в кюветах с толщиной поглощающего слоя 2 см. По результатам измерений строят спектры поглощения в координатах А = f(λ). По спектрам находят значение λ1 и λ2, соответственно максимальной А для KMnO4 и K2Cr2O7. В области λ, оптическая плотность для K2Cr2O7 должна быть примерно равна нулю. 2). Построение градуировочного графика: При λ1 и λ2 строят градуировочные графики для KMnO4 (1,0;2,0;3,0;4,0;5,0 мл раствора в 50 мл). При λ2 строят график для K2Cr2O7 (1,0;2,0;3,0;4,0;5,0 мл раствора в 50 мл). Во все колбы добавляют по 10 мл HNO3 и доводят дистиллированной водой до метки. Обработка результатов: 1). Выбор длины волны: Таблица 8. Выбор длины волны для KMnO4 и K2Cr2O7
График 7. Выбор длины волны для KMnO4 и K2Cr2O7 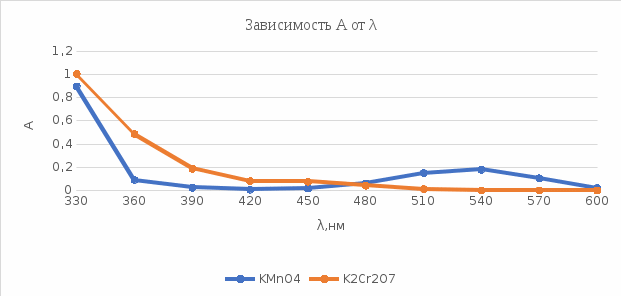 По графикам видно, что наибольшее значение оптической плотности для K2Cr2O7 приходится на длину волны 330 нм, а для KMnO4 будут использоваться длины волн в 330 и 540 нм. 2). Построение градуировочного графика: Таблица 9. Оптические плотности KMnO4
График 8. Градуировочный график. Определение марганца 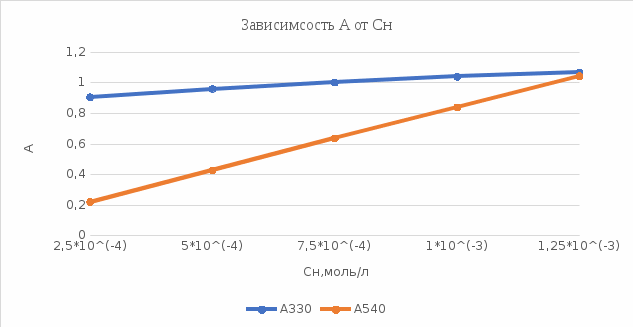 Таблица 10. Оптические плотности для K2Cr2O7
График 9. Градуировочный график. Определение хрома. 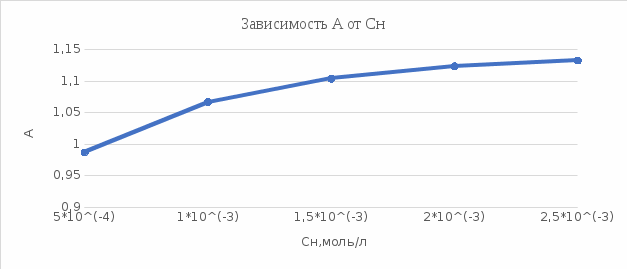 По графику нормальная концентрация марганца в пробе равна 5*10^(-4) моль/л. Вывод: показать возможность применения спектрофотометра для анализа двухкомпонентных смесей на примере определения перманганата калия и дихромата калия при их совместном присутствии. Нормальная концентрация марганца в пробе равна 5*10^(-4) моль/л. 01.10.2021 ЛАБОРАТОРНАЯ РАБОТА №4 «Определение уксусной кислоты методом потенциометрического титрования. Определение константы ионизации кислоты» Цель работы: определить содержание уксусной кислоты в анализируемом растворе и её константу ионизации. Посуда и оборудование: рН-метр, электрохимическая ячейка со стеклянным и хлорсеребряным электродами, магнитная мешалка, пипетки (5 и 10 мл), стакан химический, бюретка (25 мл), груша резиновая. Реактивы: NaOH (0,1 н), CH3COOH (анализируемый раствор), вода дистиллированная вода. Ход работы: 1). Выполнение работы: Анализируемый объём уксусной кислоты 5 мл помещаю в стакан и прибавляют немного дистиллированной воды, чтобы электроды были погружены на 1,5 – 2 см в раствор. При постоянном перемешивании раствора магнитной мешалкой измеряют изначальный рН. Далее рН измеряют каждый раз при добавлении щёлочи шагом в 0,5 мл. По резкому скачку рН определяют точку эквивалентности, строят график. Точное титрование проводят с шагом в 0,1 мл. Титрование заканчивают, когда рН фактически не меняется (3-4 точки). По экспериментальным данным строят кривую титрования – график зависимости рН от объёма титранта. 2). Определение константы ионизации: Константа ионизации Ккисл. по данным потенциометрического титрования определяется из кривой титрования графическим способом. Известно, что до точки эквивалентности в растворе содержится буферная смесь из СН3СООН и её соли СН3СООNa. Обработка результатов: Таблица 11. Значения рН при грубом титровании
Таблица 12. Значения рН при точном титровании
График 10. Определение точки эквивалентности 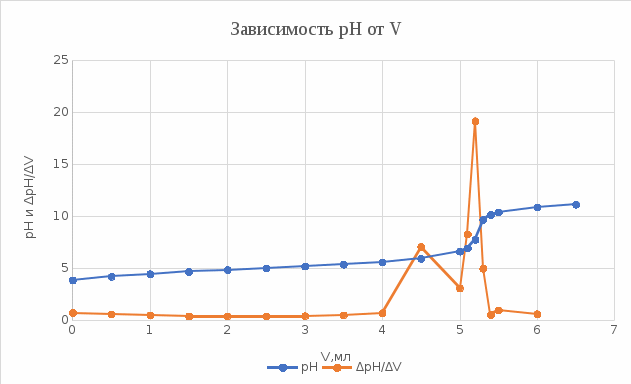 Расчёт массы уксусной кислоты: m (CH3COOH) = 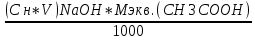 где: Сн, V – молярная концентрация эквивалента и объём тиранта в точке эквивалентности, моль/л;мл; Мэкв. (СН3СООН) – молярная масса эквивалента уксусной кислоты. m (CH3COOH) = 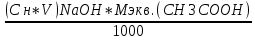 = = 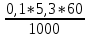 = 0,0318 г = 0,0318 гРасчёт константы ионизации: V (точки эквивалентности) = 5,3 мл V1/2 = 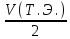 = 2,65 мл = 2,65 млОбъёму 2,65 мл соответствует рН = 4,9 рН1/2 = рКкисл. рН1/2 = 4,9 = Ккисл. Табличное значение Ккисл. для усусной кислоты = 4,76 Вывод: определено содержание уксусной кислоты в анализируемом растворе – 0,0318 г, а также Ккисл. равную 4,9. |
