Лабораторная работа №1. Лабораторная работа 1 Определение молярной массы сложного вещества Работу выполнил студент Каташев Даниил Игоревич группа 123 з
 Скачать 26.34 Kb. Скачать 26.34 Kb.
|
|
Новосибирский государственный архитектурно-строительный университет (Сибстрин) Кафедра физики и химии Лабораторная работа №1 Определение молярной массы сложного вещества Работу выполнил студент: Каташев Даниил Игоревич группа 123 з «20» декабря 2021 г Работу проверил преподаватель: Полунина Ольга Анатольевна «___»__________20__ г Новосибирск 2021 Цель работы: определение молярной массы эквивалентов неизвестной кислоты методом титрования Приборы и реактивы: раствор NaOH, 0,1 н раствор HCl, бюретки, фенолфталеин, раствор неизвестной кислоты конические колбы. Описание опыта: Молярную массу неизвестной кислоты определяют титрованием раствора данной кислоты раствором щелочи (NaOH), концентрация которого должна быть известна. Опыт 1. Установление точной концентрации раствора NaOH Титруем раствор кислоты раствором NaOH известной концентрации до устойчивой розовой окраски раствора. NaOH + HCl = NaCl + H2O. В точке эквивалентности по закону эквивалентов nэк(NaOH) = nэк(HCl) Расчет результатов опыта 1: 1. Объем раствора HCl V1 (HCl) = 10 см3 V2 (HCl) = 10 см3 2. Концентрация раствора HCl Сэк(HCl) = 0,1 моль-эк/л 3. Объем раствора NaOH, пошедший на титрование V1 = 11,2 мл V2 = 10,5 мл 4. Средний объем раствора NaOH, пошедший на титрование 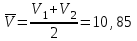 мл млРасчет Сэк(NaOH) 1.По закону эквивалентов для реакции nэк(NaOH) = nэк(HCl) 2.Выразим nэк(NaOH) и nэк(HCl) через молярные концентрации эквивалентов этих растворов и их объемы: Cэк(HCl) · V(HCl) = Cэк(NaOH) · V(NaOH) 3.Из уравнения выразим неизвестную величину Cэк(NaOH), и произведем расчет, подставляя средний объем раствора NaOH. 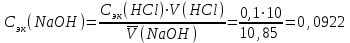 моль-экв/л моль-экв/лОпыт 2. Определение молярной массы эквивалентов неизвестной кислоты. Титруем раствор неизвестной кислоты раствором стандартизованным раствором NaOH с индикатором фенолфталеином. Расчет результатов опыт 2: 1. Масса неизвестной кислоты m(к) = 0,0441 г 2. Молярная концентрация эквивалентов раствора NaOH Сэк(NaOH) = 0,0922 моль-эк/л 3.Объем раствора NaOH, пошедший на титрование V(NaOH) = 9,5 мл Расчет Mэк неизвестной кислоты 1. Согласно закону эквивалентов nэк(NaOH) = nэк(кислоты). 2. Если известна молярная концентрация эквивалентов и объем раствора, то : nэк(А) = Cэк(А) · V(А). Зная m(кислоты), Сэк(NaOH) и V(NaOH) количество вещества эквивалентов рассчитаем, используя выражения: nэк(к) = m(к)/ Мэк(к) nэк(NaOH) = Cэк(NaOH) · V(NaOH) 3. Запишем закон эквивалентов, с учетом п.2 Cэк(NaOH) · V(NaOH) = 0,0922 ∙ 9,5∙10-3 = 8,76∙10-4 моль-экв Из уравнения выразим Мэк(кислоты), подставим соответствующие значения и рассчитаем Мэк неизвестной кислоты. V(NaOH) должен быть выражен в литрах 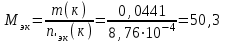 г/(моль-экв) г/(моль-экв)5. Рассчитаем Мэк приведенных кислот в таблице:
Mэк (В) = 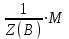 Полученное экспериментальное значение соответствует молярной массе эквивалента серной кислоты. Таким образом неизвестная кислота – сильная двухосновная серная кислота, уравнение реакции титрования: 2NaOH + H2SO4 = Na2SO4 + H2O Вывод: В ходе лабораторной работы было проведено титрование неизвестной кислоты раствором гидроксида натрия известной концентрации. Определена молярная масса эквивалента неизвестной кислоты, Мэк = 50,3 г/(моль-экв). Данная кислота – серная кислота (H2SO4) |
