Лабораторная работа по химии. Лабораторная работа №1 (Химия). Лабораторная работа 1. Определение скорости химических процессов. Цель работы
 Скачать 1.67 Mb. Скачать 1.67 Mb.
|
|
Лабораторная работа №1. Определение скорости химических процессов. Цель работы: 1) Познакомится с закономерностями протекания химических процессов; 2) Научиться экспериментально определять скорость химической реакции; 3) Определить влияние концентрации исходных веществ на скорость химической реакции; 4) Использовать закон действующих масс для расчета скорости химических процессов. Опыт 1. Определение скорости химической реакции. В качестве изучаемой реакции выбрана реакция взаимодействия тиосульфата натрия с серной кислотой. Уравнение химической реакции имеет следующий вид: Таблица 1. Время протекания и скорость химической реакции
 Г 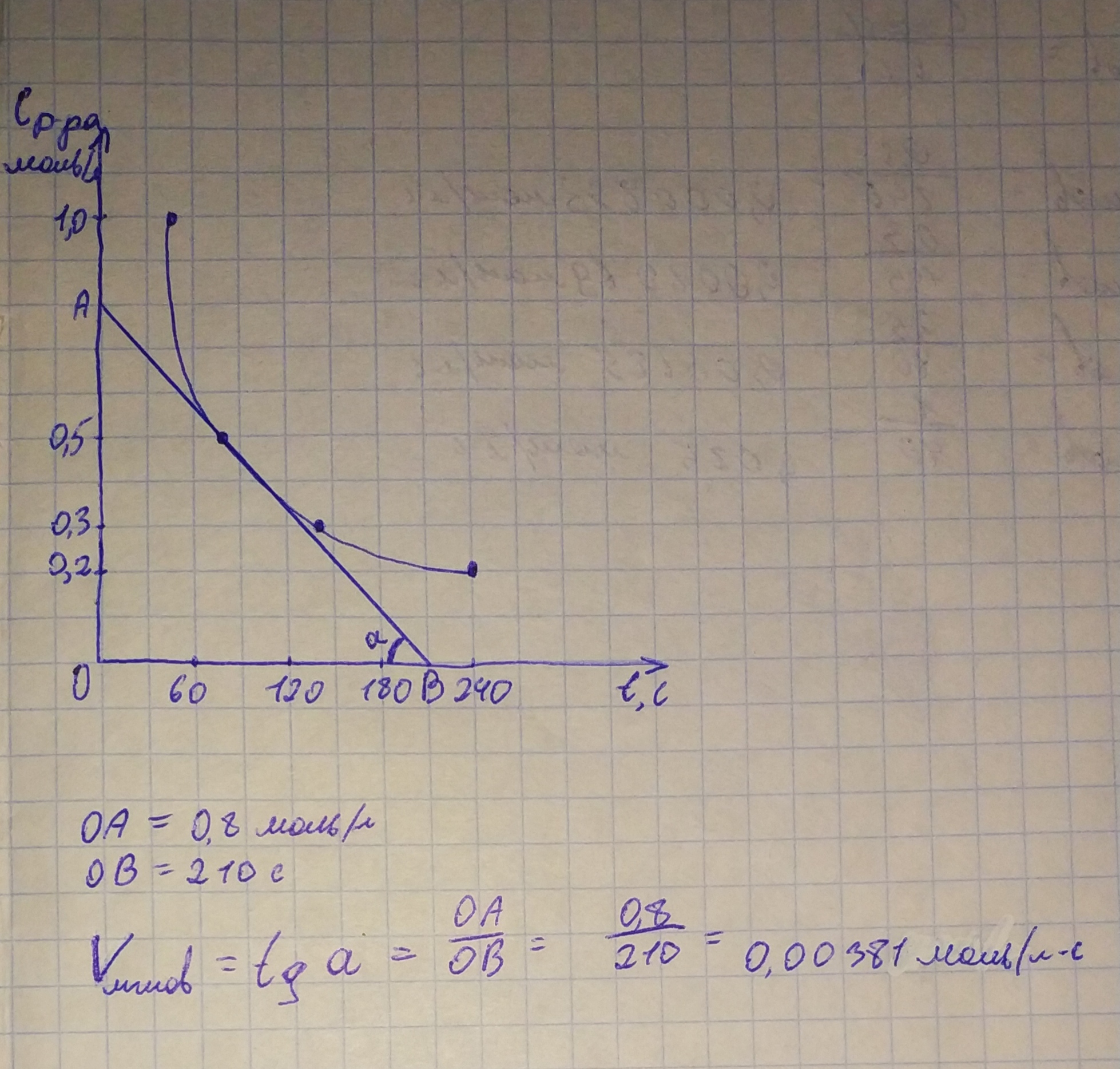 рафик зависимости времени реакции от концентрации раствора, на котором представлена касательная, угол наклона, точки пересечения с осями координат. рафик зависимости времени реакции от концентрации раствора, на котором представлена касательная, угол наклона, точки пересечения с осями координат.Выражение закона действующих масс для реакции 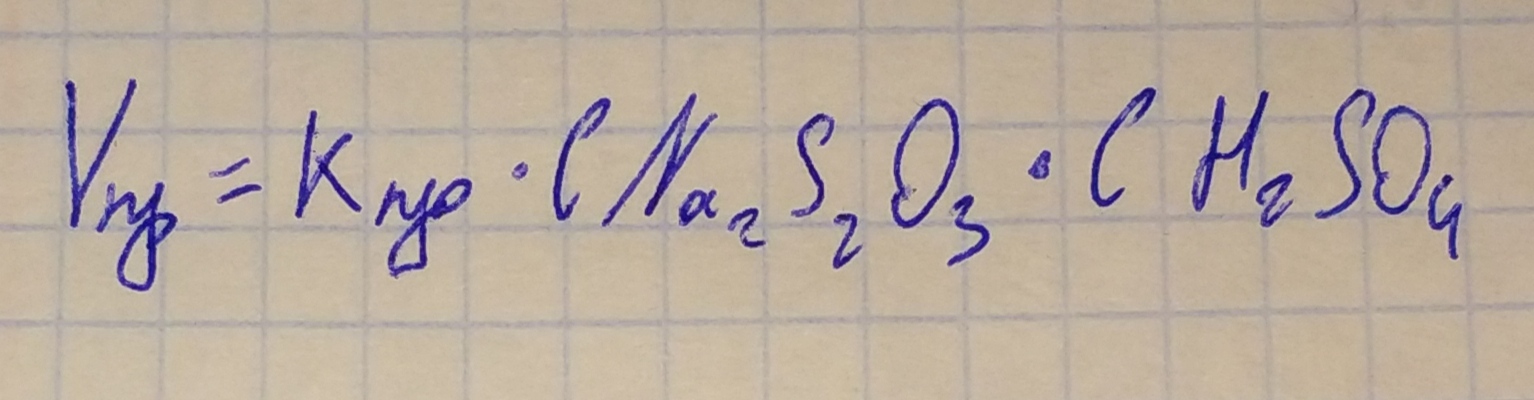 Вывод: Я научился экспериментально определять скорость химической реакции на практике, а также определять влияние концентрации вещества на скорость химической реакции. Савенков Никита Сергевич, 14.11.22 года Вопросы для самоконтроля и повторения Ответ на 1 вопрос Скорость химической реакции показывает, как быстро происходит та или иная реакция. Взаимодействие происходит при столкновении частиц в пространстве. При этом реакция происходит не при каждом столкновении, а только когда частица обладают соответствующей энергией. Скорость реакции – количество элементарных соударений взаимодействующих частиц, заканчивающихся химическим превращением, за единицу времени. Определение скорости химической реакции связано с условиями ее проведения. Если реакция гомогенная – т.е. продукты и реагенты находятся в одной фазе – то скорость химической реакции определяется, как изменение концентрации вещества в единицу времени: υ = ΔC / Δt Если реагенты, или продукты находятся в разных фазах, и столкновение частиц происходит только на границе раздела фаз, то реакция называется гетерогенной, и скорость ее определяется изменением количества вещества в единицу времени на единицу реакционной поверхности: υ = Δν / (S·Δt) Факторы, влияющие на скорость химической реакции: температура, концентрация, давление, катализатор, площадь соприкосновения реагирующих веществ, природа реагирующих веществ. От давления напрямую зависит концентрация газов. При повышении давления повышается концентрация газов. Математическое выражение этой зависимости (для идеального газа) — уравнение Менделеева-Клапейрона: pV = νRT Таким образом, если среди реагентов есть газообразное вещество, то при повышении давления скорость химической реакции увеличивается, при понижении давления — уменьшается. Например. Изменения скорость реакции сплавления извести с оксидом кремния: CaCO3 + SiO2 ↔ CaSiO3 + CO2↑ При сплавлении извести с оксидом кремния, скорость реакции не изменится, т.к. среди реагентов нет газов, а карбонат кальция – твердая соль, нерастворимая в воде, оксид кремния – твердое вещество. Газом будет продукт – углекислый газ. Но продукты не влияют на скорость прямой реакции. Ответ на 2 вопрос Гомогенная система — однородная система, химический состав и физические свойства которой во всех частях одинаковы или меняются непрерывно, без скачков (между частями системы нет поверхностей раздела). В гомогенной системе из двух и более химических компонентов каждый компонент распределен в массе другого в виде молекул, атомов, ионов. Составные части гомогенной системы нельзя отделить друг от друга механическим путем. В гомогенных смесях составные части нельзя обнаружить ни визуально, ни с помощью оптических приборов, поскольку вещества находятся в раздробленном состоянии на макроуровне. Гомогенными смесями являются смеси любых газов и истинные растворы, а также смеси некоторых жидкостей и твердых веществ, например сплавы. Гетерогенная система — неоднородная система, состоящая из однородных частей (фаз), разделенных поверхностью раздела. Однородные части (фазы) могут отличаться друг от друга по составу и свойствам. Число веществ (компонентов), термодинамических фаз и степеней свободы связаны правилом фаз. Примерами гетерогенных систем могут служить: жидкость — насыщенный пар; насыщенный раствор с осадком; многие сплавы. Твердый катализатор в токе газа или жидкости тоже гетерогенная система (гетерогенный катализ). Ответ на 4 вопрос Изменив концентрацию реагирующих веществ, также можно изменить число эффективных соударений. Понятие концентрации, как правило, используется для газов и жидкостей, т.к. в газах и жидкостях частицы быстро двигаются и активно перемешиваются. Чем больше концентрация реагирующих веществ (жидкостей, газов), тем больше число эффективных соударений, и тем выше скорость химической реакции. Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их коэффициентам в уравнении химической реакции. Для химической реакции вида: aA + bB = cC + dD закон действующих масс записывается так: здесь v — скорость химической реакции, CA и CB — концентрации веществ А и В, соответственно, моль/л k – коэффициент пропорциональности, константа скорости реакции. Например, для реакции образования аммиака: N2 + 3H2 ↔ 2NH3 закон действующих масс выглядит так: Константа скорости реакции k показывает, с какой скоростью будут реагировать вещества, если их концентрации равны 1 моль/л, или их произведение равно 1. Константа скорости химической реакции зависит от температуры и не зависит от концентрации реагирующих веществ. В законе действующих масс не учитываются концентрации твердых веществ, т.к. они реагируют, как правило, на поверхности, и количество реагирующих частиц на единицу поверхности при этом не меняется. Ответ на 5 вопрос Химическое равновесие – состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Конста́нта равнове́сия - величина, определяющая для данной химической реакции соотношение между термодинамическими активностями исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Ответ на 6 вопрос При воздействии внешних факторов, таких как изменение температуры, давления или концентрации исходных веществ или продуктов, равновесие системы может быть нарушено. Однако после прекращения этого воздействия система через некоторое время перейдет в новое состояние равновесия. Такое переход системы из одного равновесия в другое называется смещением химического равновесия. Для того чтобы уметь определять, каким образом сдвигается химическое равновесие при том или ином типе воздействия, удобно пользоваться прицепом Ле Шателье: Если на систему в состоянии равновесия оказать какое-либо внешнее воздействие, то направление смещение химического равновесия будет совпадать с направлением той реакции, которая ослабляет эффект от оказанного воздействия. |
