Лабораторная №1. Лабораторная работа 1 Основные классы неорганических соединений Кафедра офх группа ргмбп201
 Скачать 36.33 Kb. Скачать 36.33 Kb.
|
|
Лабораторная работа №1 «Основные классы неорганических соединений» Выполнил: Кафедра ОФХ Группа: РГМбп-20-1 Проверила: Жихарева И.Г. 10.02.2021 Цель работы: Экспериментально изучить химические свойства сложных веществ – оксидов, оснований, кислот и солей. Наблюдения и химические уравнения занести в приведенную ниже таблицу. Оборудование: Капельницы, штатив, стеклянная палочка, плитка для нагрева реактивов.
КОНТРОЛЬНЫЕ ВОПРОСЫ Назовите следующие оксиды и укажите степень окисления элемента, образующего оксид: Al2O3, SO3, Cr2O3, P2O5, Cl2O7. Ответ: Al2O3 - оксид алюминия (Al +3) SO3 - оксид серы VI (S +6) Cr2O3 - оксид хрома III (Cr +3) P2O5 - оксид фосфора V (P +5) Cl2O7 - оксид хлора VII (Cl +7) 2, 3. Охарактеризуйте химические свойства: а) основного оксида, б) кислотного оксида, в) амфотерного оксида. Ответ: а) Основные оксиды взаимодействуют с водой с образованием оснований. Условие протекания реакции: должны образовываться растворимые основания! Na2O + H2O → 2NaOH CaO + H2O → Ca(OH)2 Al2O3 + H2O → реакция не протекает, так как должен образовываться Al(OH)3, который нерастворим. 2. Взаимодействие с кислотами с образованием соли и воды: CaO + H2SO4 → CaSO4 + H2O. 3. Взаимодействие с кислотными оксидами с образованием соли: СaO + SiO2 → CaSiO3 4. Взаимодействие с амфотерными оксидами: СaO + Al2O3 → Сa(AlO2)2 б) Химические свойства кислотных оксидов: 1. Взаимодействие с водой с образованием кислоты: Условия протекания реакции: должна образовываться растворимая кислота. P2O5 + 3H2O → 2H3PO4 2. Взаимодействие со щелочами с образованием соли и воды: Условия протекания реакции: с кислотным оксидом взаимодействует именно щелочь, то есть растворимое основание. SO3 + 2NaOH → Na2SO4 + H2O 3. Взаимодействие с основными оксидами с образованием солей: SO3 + Na2O → Na2SO4 в) Химические свойства амфотерных оксидов: 1. C водой не взаимодействуют. 2. Взаимодействие с кислотными оксидами с образованием солей при сплавлении (основные свойства): ZnO + SiO2 → ZnSiO3 3. Взаимодействие с кислотами с образованием соли и воды (основные свойства): ZnO + H2SO4 → ZnSO4 + H2O 4. Взаимодействие с растворами и расплавами щелочей с образованием соли и воды (кислотные свойства): Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4] Al2O3 + 2NaOH → 2NaAlO2 + H2O 5. Взаимодействие с основными оксидами (кислотные свойства): Al2O3 + CaO → Ca(AlO2)2 4. Какие из приведенных оксидов СО2, СаО, Fe2O3, SiO2 Al2O3 способны к солеобразованию с кислотами? Напишите уравнения их взаимодействия с азотной кислотой. С кислотами реагируют только CaO, Fe2O3, Al2O3. 2HNO3+CaO=Ca(NO3)2+H2O 6HNO3+Fe2O3=2Fe(NO3)3+3H2O 6HNO3+Al2O3=2Al(NO3)3+3H2O 5. Какие из указанных гидроксидов могут образовать основные соли: а) Cu(OH)2; б) LiOH; в) Al(OH)3; г) Ba(OH)2; д) NaOH. Приведите реакции получения из них основных солей. а) Cu(OH)2; 2Cu(OH)2 + H2SO4 → (CuOH)2SO4 + 2H2O в) Al(OH)3; Al(OH)3 + HCl → Al(OH)2Cl + H2O г) Ba(OH)2; 2Ba(OH)2 + H2S → (BaOH)2S + 2H2O 6. Выберите правильное название соединения (СuOH)2CO3: а) гидрокарбонат меди, б) карбонат гидроксомеди (II), в) карбонат дигидроксомеди (II) Ответ: в) карбонат дигидроксомеди (II) 7. Как получить среднюю соль из хлорида гидроксомагния? MgOHCl + HCl → MgCl2 + H2O 8. Составьте формулы средних и кислых солей калия и кальция, образованных: а) угольной кислотой, б) мышьяковистой кислотой. a) средняя - K2CO3; средняя - CaCO3; кислая - KHCO3 ; кислая - Ca(HCO3)2 б) средняя - K3AsO3 средняя - Ca3(AsO3)2 кислые - K2HAsO3 и KH2AsO3 ; кислые - CaHAsO3 и Ca(H2AsO3)2 9. Напишите уравнения реакций получения оксидов нагреванием следующих веществ: Fe(OH)3, Cu(OH)2, Н2 SiO3, Ca3(PO4)2. Определите характер полученных оксидов. Назовите их. 10. Напишите уравнения реакций превращения в средние соли следующих кислых солей: а) дигидрофосфат кальция; б) гидросульфит кальция; в) гидросиликат магния; г) гидросульфат алюминия. а) Ca(H2PO4)2 + = 2Ca(OH)2(концентрат) = Ca3(PO4)↓ + 4H2O б) Ca(HSO3)2 = Ca(OH)2(концентрат) → 2CaSO3 + 2H2O в) Mg(HSiO3)2 + 2NaOH → Na2SiO3 + MgSiO3 + 2H2O г) Al(HSO4)3 + Al(OH)3 → Al2(SO4)3 + 3H2O 12. Составить молекулярные уравнения реакций, с помощью которых можно осуществить следующие циклы превращений: а) Al Al2(SO4)3 Al(OH)3 AlOHCl2 AlCl3; б) SO2 H2SO3 NaHSO3 Na2SO3; в) CaCO3 CaO Ca(OH)2 CaOHNO3 Ca(NO3)2; г) KOH K3PO4 H3PO4 AlPO4; д) Al2O3 AlCl3 Al2(SO4)3 Al(OH)3; е) SO3 H2SO4 K2SO4 BaSO4; ж) ZnO ZnCl2 Zn(OH)2 Na2[Zn(OH)4]. Ответ: а) Al - Al2(SO4)3 - Al(OH)3 - AlOHCl2 - AlCl3; 1) 2Al+3H2SO4(разб) → Al2(SO4)3+3Н2 2) Al2(SO4)3+3NaOH → 3Na2SO4+2Al(OH)3(осадок) 3) Al(OH)3 + 2НCl → AlOHCl2 + 2H2O 4) AlOHCl2 + HCl → AlCl3 + H2O б) SO2 - H2SO3 - NaHSO3 - Na2SO3; 1) SO2 + H2O → H2SO3 2) H2SO3+NaOH → NaHSO3+H2O 3) 2NaHSO3 → Na2SO3 + H2O + SO2 в) CaCO3 - CaO - Ca(OH)2 - CaOHNO3 - Ca(NO3)2; 1) CaCO3 → CaO+CO2 2) CaO+H2O → Ca(OH)2 3) Ca(OH)2 +Ca(NO3)2 → 2CaOHNO3 4) CaOHNO3 + HNO3 → Ca(NO3)2 + H2O г) KOH - K3PO4 - H3PO4 - AlPO4; 1) 3KOH+H3PO4 → K3PO4+3H2O 2) K3PO4+3H2O -→ H3PO4+3KOH 3) H3PO4+AL(OH)3 → ALPO4+3H2O Д) Al2O3 - AlCl3 - Al2(SO4)3 - Al(OH)3; 1) Al2O3 + 6HCl → 2AlCl3 + 3H2O 2) 2AlCl3 + 3H2SO4 → Al2(SO4)3 + 6HCl 3) Al2(SO4)3 + 6NaOH → 2Al(OH)3 + 3Na2SO4 Е) SO3 - H2SO4 - K2SO4 - BaSO4 1) SO3 + H2O → H2SO4 2) H2SO4 + 2KOH → K2SO4 + 2H2O 3) K2SO4 + BaCl2 → BaSO4 + 2KCl Ж) ZnO - ZnCl2 - Zn(OH)2 - Na2[Zn(OH)4]. 1) ZnO + 2HCl → ZnCl2 + H2O 2) ZnCl2 + 2NaOH → Zn(OH)2 + 2NaCl 3) Zn(OH)2 + 2NaOH → Na2[Zn(OH)4] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

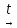 CuSO4 + H2O
CuSO4 + H2O