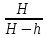Лабораторные работы 1 и 2 по физике. Лабораторная работа № 1. Лабораторная работа 1 по дисциплине Физика Определение отношения удельных теплоемкостей воздуха методом адиабатического расширения
 Скачать 36.3 Kb. Скачать 36.3 Kb.
|
Лабораторная работа № 1 по дисциплине «Физика» Определение отношения удельных теплоемкостей воздуха методом адиабатического расширения (тема)
Москва 2020 Цель работы – изучение процессов идеального газа и определение на основании свойств этих процессов отношения теплоемкостей при постоянном давлении и при постоянном объеме для воздуха. Задание – выполнить заданные процессы над воздухом, рассчитать отношение теплоемкостей и погрешность измерений. Теоретическое обоснование Теплоемкостью С (Т) какого-либо тела называется величина, равная отношения количеству тепла dQ, полученного телом и вызвавшего повышение его температуры на dT, к величине dT, то есть С (Т) = dQ / dT. Теплоемкость единицы массы вещества называется удельной теплоемкостью, теплоемкость одного моля вещества – молярной теплоемкостью. Количество теплоты, поглощенной телом при изменении его состояния, зависит не только от начального и конечного состояний, но и от способа, которым был осуществлен переход между ними. Поэтому теплоемкость зависит от способа нагрева тела. Согласно первому закону термодинамики, в случае нагревания при постоянном давлении p = const часть теплоты идет на совершение работы при расширении газа, а часть – на увеличение его внутренней энергии, тогда как в случае нагревания при постоянном объеме v = const вся теплота расходуется на увеличение внутренней энергии. Поэтому Ср всегда больше Сv. В связи с этим Сp Cv. Для идеального газа разность молярных теплоемкостей: Сp - Cv = R (1) где R – универсальная газовая постоянная, Cv и Сp постоянный объем и давление. Теоретическое вычисление теплоемкости идеальных газов методами классической статики сводиться к вычислению средней энергии теплового движения молекул. Закон равнораспределения энергии молекул по степеням свободы приводит к следующему выражению для молярной теплоемкости Cv идеального газа: Cv = iR/2 (2) где i = iпост + iвр + 2iкол поступательные, вращательные и колебательные степени свободы молекул газа. Из (1) и (2) отношение теплоемкостей можно предоставить в виде 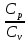 . .Это отношение теплоемкостей входит в уравнения, описывающие адиабатические процессы идеальных газов. Такие процессы широко применяются на практике, например, в тепловых двигателях. Ход работы
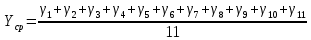 = (1,3453 + 1,3943 + 1,3732 + 1,3952 + 1,3620 + 1,3805 + 1,4117 + 1,3333 + 1,4326 + 1,3179 + 1,3070) / 11 = 1,3684 = (1,3453 + 1,3943 + 1,3732 + 1,3952 + 1,3620 + 1,3805 + 1,4117 + 1,3333 + 1,4326 + 1,3179 + 1,3070) / 11 = 1,3684γсл = αn.p 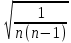 (γ1)2 (γ1)2γсл = 1,1 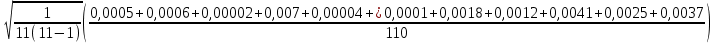 = 0,0129 = 0,0129γ = 1,3684 0,0129 γ = (1,3684 0,0129) Вывод Удалось экспериментальным путем изучить процессы идеального газа и определения свойств этих процессов отношения теплоемкостей при постоянном давлении и объеме воздуха. Экспериментальное значение близка к теоретическому, значит опыты проведены успешно. |