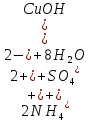|
|
Электролиты. Лабораторная работа 2 Исследование реакций в растворах электролитов студент гр. Рги21 Федоров Н. В
Федеральное государственное бюджетное образовательное учреждение высшего образования «Санкт-Петербургский горный университет» 
Кафедра общей химии
ОТЧЕТ
ЛАБОРАТОРНАЯ РАБОТА №2
«Исследование реакций в растворах электролитов»
Выполнил: студент гр. РГИ-21 /Федоров Н.В./
(номер группы) (подпись) (Ф.И.О.)
Оценка:
Дата:
Проверил
руководитель работы: доцент /Згонник П.В./
(должность) (подпись) (Ф.И.О.)
Санкт-Петербург
2021
Общие теоретические свойства:
Электролитическая диссоциация – процесс распада молекул электролитов на ионы под действием полярных молекул растворителя.
Степень диссоциации – способность электрона распадаться на ионы характеризуемые степенью диссоциации
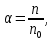
где 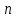 – число продиссоциированых молей – число продиссоциированых молей
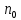 - исходное число молей электролита. - исходное число молей электролита.
Константа диссоциации
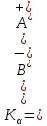
где 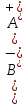 – концентрации ионов и молекул электролита в растворе, моль/л или моль/кг – концентрации ионов и молекул электролита в растворе, моль/л или моль/кг
Цель работы:
Ознакомиться с практическими выводами теории электролитической диссоциации, с реакциями в растворах электролитов и научиться составлять их уравнения.
Ход работы:
Опыт 1. Образование малорастворимых оснований. В одну пробирку налить 3-5 капель раствора соли железа (III), в другую – столько же раствора соли меди (II), в третью – раствора соли никеля (II). В каждую пробирку добавить по несколько капель щелочи до выпадения осадков. Осадки сохранить до следующего опыта.
Опыт 2. Растворение малорастворимых оснований. К полученным в предыдущем опыте осадкам добавить по несколько капель раствора соляной кислоты концентрацией 15% до их полного растворения.
Опыт 3. Образование малорастворимых солей.
А. в две пробирки налить по 3-5 капель раствора нитрата свинца (II) и прибавить в одну пробирку несколько капель йодида калия, в другую – хлорида бария.
Б. в одну пробирку налить 3-5 капель раствора сульфата натрия, в другую – столько же раствора сульфата хрома (III). В каждую пробирку добавить несколько капель раствора хлорида бария до выпадения осадков.
Опыт 4. Изучение свойств амфотерных гидроксидов
А. в две пробирки внести по пять капель раствора соли цинка и несколько капель раствора гидроксида натрия до образования осадка гидроксида цинка. Растворить полученные осадки в одной пробирке в растворе соляной кислоты, в другой – в избытке раствора гидроксида натрия.
Б. в две пробирки внести по пять капель раствора соли алюминия и несколько капель раствора гидроксида натрия до образования осадка гидроксида алюминия. Растворить полученные осадки в одной пробирке в растворе соляной кислоты, в другой – в избытке раствора гидроксида натрия.
В. в две пробирки внести по пять капель раствора сульфата хрома (III) и несколько капель раствора гидроксида натрия до образования осадка гидроксида хрома (III). Растворить полученные осадки в одной пробирке в растворе соляной кислоты, в другой – в избытке раствора гидроксида натрия.
Опыт 5. Образование малодислоцированных соединений. В пробирку внести 3-5 капель раствора хлорида аммония и добавить несколько капель раствора гидроксида натрия.
Опыт 6. Образование комплексов. В пробирку налить 5-7 капель раствора карбоната натрия, в другую – столько же раствора сульфида натрия. В обе пробирки добавьте по несколько капель серной кислоты.
Опыт 7. Образование газов. Внесите в одну пробирку 3-5 капель раствора карбоната натрия, в другую - столько же раствора сульфида натрия. В обе пробирки добавьте по несколько капель серной кислоты. Обратите внимание на выделение газов и их запах.
Уравнения реакций в молекулярной и ионной форме, результаты проведения реакций:
Опыт 1
FeCl3 + 3NaOH = 3NaCl + Fe(OH)3 - образовался бурый гелеобразный осадок
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2 - образовался синий гелеобразный осадок
NiSO4 + 2NaOH = Na2SO4 + Ni(OH)2 - образовался светло-зелёный гелеобразный осадок
Опыт 2
Fe(OH)3 + 3HCl = FeCl3 + 3H2O - осадок растворился, раствор светло-желтого цвета
Cu(OH)2 + 2HCl = CuCl2 + 2H2O - раствор светло-голубого цвета
Ni(OH)2 + 2HCl = NiCl2 + 2H2O - раствор бледно-зелёного цвета
Опыт 3
А. Pb(NO3)2 + 2KI = 2KNO3 + PbI2 – порошкообразный желтый осадок
Pb(NO3)2 + BaCl2 = Ba(NO3)2 + PbCl2 – белый мелкокристаллический осадок
Б. Na2SO4 + BaCl2 = BaSO4 + 2NaCl – мелкодисперсный осадок белого цвета
Cr2(SO4)3 + 3BaCl2 = 3BaSO4 + 2CrCl3 – мелкодисперсный осадок белого цвета в сероватом растворе
Опыт 4
А. ZnSO4 + 2NaOH = Zn(OH)2 + Na2SO4 – белый гелеобразный осадок
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O – осадок растворился, раствор стал бесцветным
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4] – осадок растворился, раствор стал бесцветным
Б. Al2(SO4)3 + 6NaOH = 2Al(OH)3 + 3Na2SO4 – гелеобразный белый осадок
2Al(OH)3 + 3HCl = AlCl3 + 3H2O – осадок растворился, раствор стал бесцветным
2Al(OH)3 + 3NaOH = Na3[Al(OH)6] – осадок растворился, раствор стал бесцветным
В. Cr2(SO4)3 + 6NaOH = 2Cr(OH)3 + 3NaSO4 –осадок зеленого цвета.
Cr(OH)3 + 3HCl = CrCl3 + 3H2O – осадок растворился, раствор стал серо-зелёным
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6] – осадок растворился, раствор тёмно-зелёный
Опыт 5
NH4Cl + NaOH = NH3 + H2O + NaCl – выделяется газ амиак с резким запахом
Опыт 6
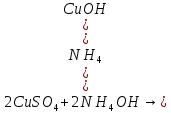 – выпал бело-голубой осадок – выпал бело-голубой осадок
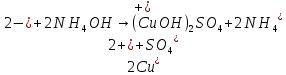
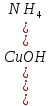 - осадок растворился, образовался раствор тёмно-синего цвета - осадок растворился, образовался раствор тёмно-синего цвета
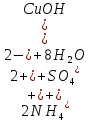
Опыт 7
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2 – выделяется газ
Na2S + H2SO4 = Na2SO4 + H2S – выделяется газ с запахом тухлых яиц
Вывод:
В ходе работы я ознакомился с практическими выводами теории электролитов и научился составлять их уравнения. |
|
|
 Скачать 39.63 Kb.
Скачать 39.63 Kb.

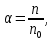
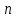 – число продиссоциированых молей
– число продиссоциированых молей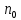 - исходное число молей электролита.
- исходное число молей электролита.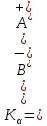
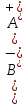 – концентрации ионов и молекул электролита в растворе, моль/л или моль/кг
– концентрации ионов и молекул электролита в растворе, моль/л или моль/кг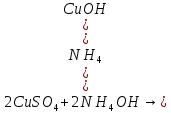 – выпал бело-голубой осадок
– выпал бело-голубой осадок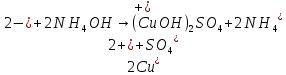
 - осадок растворился, образовался раствор тёмно-синего цвета
- осадок растворился, образовался раствор тёмно-синего цвета