химия. 5 лаб ГД-22вв Омаров М.Б.. Задание 5 недели
 Скачать 481.48 Kb. Скачать 481.48 Kb.
|
|
Задание 5 недели В трех сосудах находятся неизвестные растворы трех солей. При взаимодействии раствора в первом сосуде с раствором нитрата бария образуется нерастворимый в воде и кислотах белый осадок. При добавлении растворов нитрата серебра к растворам, содержащимся в других сосудах, также выпадают осадки белого цвета. Соль, содержащаяся во втором сосуде, окрашивает пламя горелки в фиолетовый цвет. При нагревании соли, содержащейся в первом сосуде, с гидроксидом натрия выделяется газ с резким запахом. При взаимодействии раствора из третьего сосуда с хроматом натрия образуется желтый осадок. Определите неизвестные вещества. Аргументируйте ответ уравнениями соответствующих реакций. Имеется сернистый газ в количестве, которым можно восстановить 104,8 г дихромата натрия, подкисленного серной кислотой. Какая соль и в каком количестве образуется при пропускании такого же количества сернистого газа через 300 г 6,8%-ного по массе водного раствора аммиака? 28,4 г оксида фосфора (V) растворили в 400 мл 3,9%-ного по массе раствора NaOH, имеющего плотность p=1,02 г/см3. Рассчитайте долю (в мас. %) соли в полученном растворе. В раствор нитрата серебра погрузили медную деталь. Через некоторое время деталь вынули из раствора, промыли, высушили и взвесили. Оказалось, что масса ее увеличилась на 3,04 г. Определите массу серебра, отложившегося на медной детали. К 50 г 20%-ного раствора хлорида калия прибавлено 15 г 8%-ного раствора нитрата серебра. Рассчитайте состав и концентрацию полученного раствора. В первом находится сульфат аммония (NH₄)₂SO₄, т. к. выпадением белого, нерастворимого осадка отвечает сульфат-ион, а при нагревании со щелочью выделяется аммиак. (NH₄)₂SO₄ + Ba(NO₃)₂ → BaSO₄↓ + 2NH₄NO₃ (NH₄)₂SO₄ + 2NaOH → Na₂SO₄ + 2NH₃↑ + 2H₂O В 2-м и 3-м сосудах содержатся хлориды, поскольку именно они с нитратом серебра дают белый осадок. Т. к соль из 2-го сосуда окрашивает пламя в фиолетовый цвет, она является калийной. Так что во 2-й пробирке находится KCl: KCl + AgNO₃ → AgCl↓ + KNO₃ В 3-м сосуде, по всей видимости, был хлорид бария BaCl₂. С хроматом натрия образуется желтый осадок BaCrO₄ BaCl₂ + 2AgNO₃ → 2AgCl↓ + Ba(NO₃)₂ BaCl₂ + Na₂CrO₄ → BaCrO₄↓ + 2NaCl 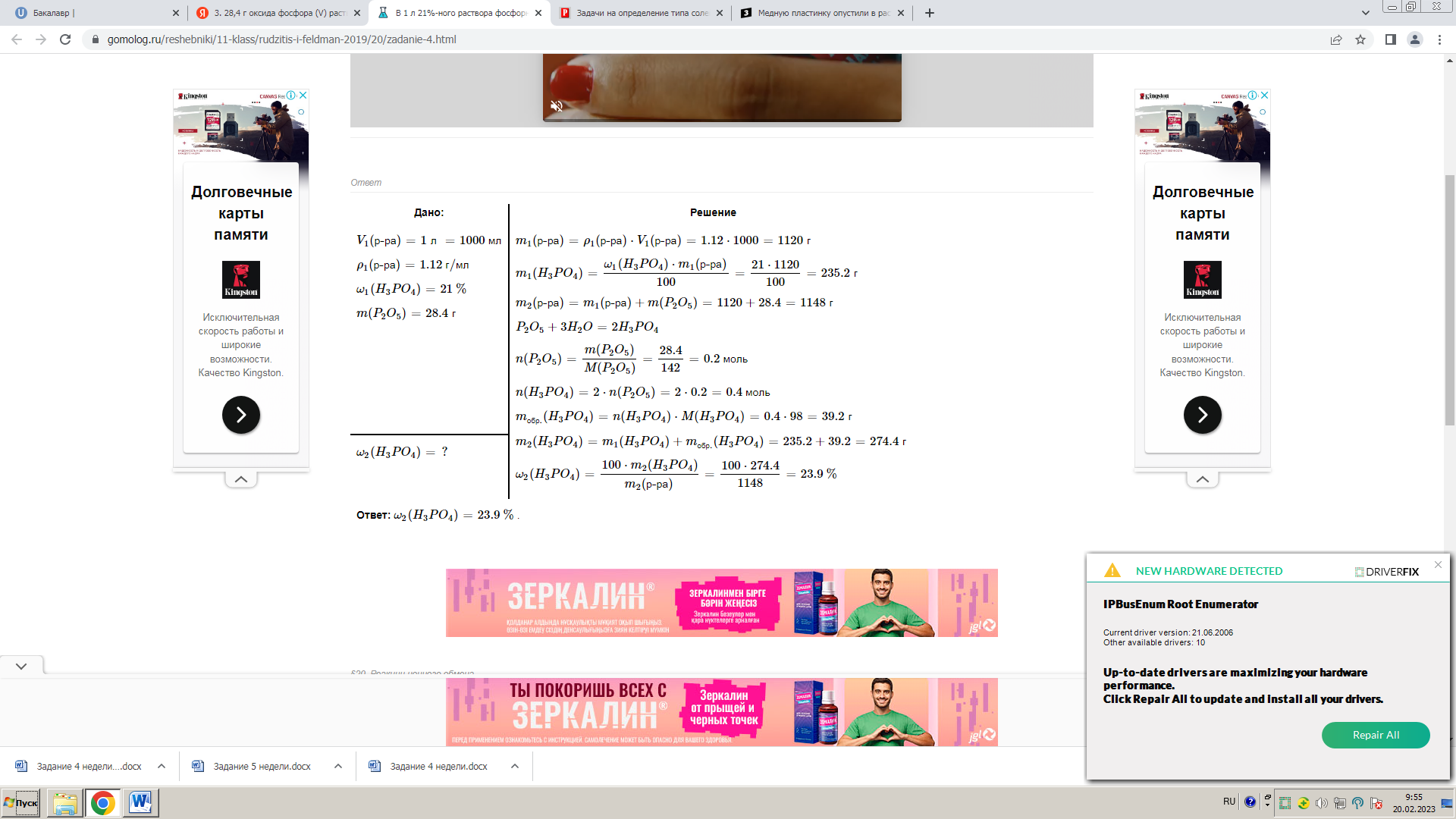 4. Δ m=3,04 г М(Cu)=64 г/моль М (Аg)=107г/моль Cu + 2AgNO3= Cu (NO3)2+ 2Ag 64 г………………………………….107*2 г 64 г Cu дает увеличение массы на (107*2-64=)150 г х г---------------------------------------3,04 г х=1,297 г Cu прореагировало n (Cu )= m/М=1,297/64=0,0203 моль n (Ag)=2* n (Cu )=0,0203*2=0,0406 моль m (Ag)= n (Ag)* М=0,0406*107=4,34 г m(Cu )=1,297 г, m (Ag)=4,34 г 5. KCl + AgNO3 = KNO3 + AgCl (осадок) m (KCl) = 50 г * 0,2 = 10 г n (KCl) = 10 г: 74,5 г/моль = 0,13 моль m (AgNO3) = 15 г * 0,08 = 1,2 г n (AgNO3) = 1,2 г: 170 г/моль = 0,007 моль KCl в избытке n (AgCl) = n (AgNO3) = 0.007 моль m (AgCl) = 0.007 моль * 143,5 г/моль = 1,0045 г |
