Лаб №2 (орг.хим) 1курс. Лабораторная работа 2 Насыщенные углеводороды (алканы) Цель работы
 Скачать 35.82 Kb. Скачать 35.82 Kb.
|
|
Лабораторная работа №2 Насыщенные углеводороды (алканы) Цель работы: а) освоить лабораторный метод получения метана и изучить его физико-химические свойства; б) ознакомить с основными химическими реакциями жидких алканов. Алканы называются ациклические насыщенные углеводороды общей формулы СnH2n+2, содержащие в молекуле только ординарные или σ(сигма) – связи. Они представляют собой подвижные молекулярные структуры, в которых происходит вращение вокруг простых углерод-углеродных связей, в результате чего реализуются разнообразные конформации, наиболее устойчивыми из которых являются анти- или заторможенные. При обычных условиях первые четыре члена гомологического ряда алканов – газы без запаха; С5-С15 – жидкости с характерным бензиновым запахом; высшие алканы – твердые вещества без запаха. Относительная плотность всех алканов меньше единицы. Промышленными источниками алканов служат природный газ, нефть и продукты её переработки (крекинг, пиролиз и риформинг). Синтетические методы получения алканов используются главным образом в лабораторных целях. Алканы отличаются низкой реакционной способностью вследствие высокой прочности σ-связей (-C-C- и С-Н) и очень низкой их полярности и поляризуемости. В силу этого связи в алканах не проявляют склонности к гетеролитическому разрыву и весьма устойчивы к действию электрофильных и нуклефильных реагентов. В обычных условиях на алканы не действуют концентрированные кислоты, щелочи, сильные окислители (КМnO4, K2Cr2O7 и др.), щелочные металлы и др. В тоже время неполярные связи алканов способны расщепляться гомолитически при взаимодействии со свободными радикалами, которые образуются при участии пероксидов, УФ-облучения, термического, радиационного и др. процессов. Реакции замещения водорода в алканах носят цепной характер, протекают по радикальному механизму (SR) и включают следующие стадии: зарождение цепи (стадия инициирования): реагент Х2 Х : Х 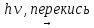 2Х· 2Х·рост или продолжение цепи: R:H + Х˙→ HХ + R˙ R˙ + Х:Х → R-Х + Х˙ обрыв цепи (стадия терминации): R˙+ R˙→ R-R; R˙+Х˙→ R-Х; Х˙+Х˙→ Х2 2.1. Получение метана и изучение его физико-химических свойств. Реактивы: смесь для получения метана - безводный ацетат натрия и прокаленная натронная известь (1:2), сильно разбавленный раствор КМnO4, 5-процентный раствор карбоната натрия, бромная вода (насыщенная). 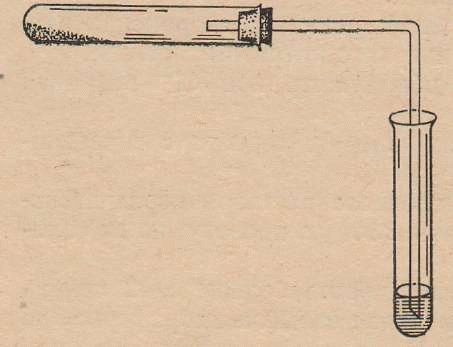 Оборудование: газоотводная трубка, к которой присоединена каучуковая трубка длиной 10-12 см со стеклянным наконечником, крышка от тигля. Оборудование: газоотводная трубка, к которой присоединена каучуковая трубка длиной 10-12 см со стеклянным наконечником, крышка от тигля.Рис: Прибор для получения метана Опыт 1. Получение и горение метана. В сухую пробирку насыпают смесь для получения метана (высота слоя около 4 см). Размещают смесь так, чтобы образующийся метан мог свободно выходить из пробирки, закрывают пробирку пробкой с газоотводной трубкой и закрепляют ее в штативе с небольшим наклоном в сторону пробки (см. рис.). В штатив ставят две пробирки: одну пробирку со смесью 3 мл разбавленного раствора перманганата калия и 1 мл 5-процентного раствора карбоната натрия и вторую пробирку с 3 мл бромной воды. Прогревают сначала всю пробирку, затем сильно нагревают ту ее часть, где находится смесь, начиная от дна пробирки, а затем, передвигая горелку дальше, чтобы могли реагировать новые порции смеси. Сначала из пробирки вытесняют воздух, затем начинается выделение метана. Метан поджигают у конца газоотводной трубки, он горит голубоватым, несветящимся пламенем. Вносят в пламя горящего метана фарфоровую крышку от тигля. Почему на крышке не образуется черного пятна сажи? Напишите уравнения реакций получения метана (из ацетата натрия и гидроксида натрия) и горения метана. Опыт 2. Отношение метана к бромной воде и к водному раствору перманганата калия. Вводят газоотводную трубку в пробирку с бромной водой и пропускают в течение 1 мин метан. Исчезает ли окраска бромной воды? Затем пропускают метан через раствор перманганата калия. Что вы наблюдаете? Сделайте вывод об отношении метана к бромной воде и к водному раствору перманганата калия (при комнатной температуре). 2.2. Исследование химических свойств жидких алканов. Реактивы: жидкие насыщенные углеводороды, 5-процентный раствор Na2CO3, 1-процентный раствор KMnO4, концентрированная серная кислота, концентрированная азотная кислота, 5-процентный раствор брома в четыреххлористом углероде, 25-процентный раствор аммиака. Оборудование: синяя лакмусовая бумага, фарфоровая чашка. Опыт 1. Отношение алканов к водному раствору перманганата калия. В пробирку наливают 1 мл насыщенных углеводородов, 1 мл 5-процентного раствора Na2CO3, затем по каплям при встряхивании добавляют раствор KMnO4. Изменяется ли фиолетовая окраска перманганата калия? Сделайте вывод об отношении алканов к водному раствору перманганата калия. Опыт 2. Отношение алканов к концентрированной серной кислоте. В сухую пробирку наливают 1 мл насыщенных углеводородов и 1 мл концентрированной серной кислоты. Содержимое пробирки взбалтывают в течение 2-3 мин. Происходят ли какие изменения? Разогревается ли смесь? Сделайте вывод на основании опыта. Опыт 3. Отношение насыщенных углеводородов к концентрированной азотной кислоте. К 1 мл насыщенных углеводородов (в сухой пробирке) добавляют 1 мл концентрированной азотной кислоты, смесь встряхивают в течении 2-3 мин. Сделайте вывод об отношении алканов к концентрированной азотной кислоте при комнатной температуре. Опыт 4. Бромирование алканов (тяга!). В сухую пробирку наливают 1 мл насыщенных углеводородов и добавляют несколько капель 5-процентного раствора брома в четыреххлористом углероде. Содержимое пробирки перемешивают на холоде. (Исчезает ли окраска брома?) Затем смесь нагревают в водяной бане. Окраска брома постепенно исчезает, одновременно образуется газообразный бромоводород. Его обнаруживают, во-первых, по изменению цвета влажной синей лакмусовой бумаги, внесенной пинцетом в верхнюю часть пробирки; во-вторых, по образованию тумана, который получается при внесении стеклянной палочки, смоченной в 25-процентном растворе аммиака, в пары, выделяющиеся из пробирки. Напишите уравнение реакции. По какому механизму осуществляется взаимодействие алканов с бромом? Напишите уравнение реакции и рассмотрите её механизм на примере бромирования 2-метилпентана (получение монобромпроизводного). Опыт 5. Горение жидких алканов (тяга!). В фарфоровую чашку наливают 1 мл жидких алканов и поджигают их. Объясните, почему в отличие от метана жидкие алканы горят коптящим пламенем. Вычислите процентное содержание углерода и водорода в метане, в гексане. Напишите уравнения реакций горения пентана, гексана, октана. ЛИТЕРАТУРА Васильева, Н.В. и др. Практические работы по органической химии: учебное пособие / Н.В. Васильева, Н.Б. Куплетская, Т.А. Смолина. – М.: Просвещение, 1978. – С. 64-66. Органическая химия: Учеб. Для вузов/ В.Л. Белобородов, С.Э. Зурабян, А.П. Лузин, Н.А. Тюкавкина; под ред. Н.А. Тюкавкиной. – М.: Дрофа, 2003. – Кн. 1.– С. 157-167. Вопросы для самоконтроля Предложите лабораторные методы получения алканов. Объясните причину химической устойчивости алканов. Какой тип гибридизации характерен для атомов углерода в алканах? Понятие о конформационных изомерах. Приведите примеры реакций радикального замещения в ряду алканов (галогенирование, окисление, нитрование, сульфохлорирование). Какие продукты образуются? Напишите уравнения и механизм указанных реакций. |
