Лабораторная работа 24. Группа токсикологически важных веществ, изолируемых экстракцией и сорбцией. Пестициды Цель работы
 Скачать 45.43 Kb. Скачать 45.43 Kb.
|
|
Лабораторная работа № 24. Группа токсикологически важных веществ, изолируемых экстракцией и сорбцией. Пестициды Цель работы: Изучить вопросы токсичности, применения, метаболизма, изолирования и обнаружения пестицидов Ход выполнения лабораторной работыФосфорсодержащие соединения (ФОС) Предварительные исследования 1. Холинэстеразная проба В предварительно приготовленном слое агар-агара в чашке Петри прорезают две лунки с помощью стеклянной трубочки. В первую лунку (исследуемая проба) вносят по каплям индикатор, сыворотку, содержащую холинэстеразу, исследуемый раствор, содержащий ФОС, через 10 минут - раствор ацетилхолина. Во вторую лунку (контрольная проба) в тех же количествах вносят индикатор, сыворотку, раствор ацетилхолина. Чашку Петри закрывают и термостатируют при 37 - 40°С 30 минут. Изменение окраски индикатора наблюдается в пробе, не содержащей ФОС. 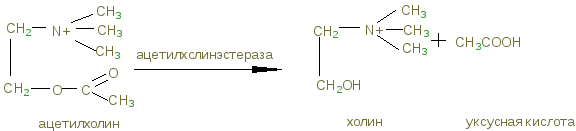 2. Обнаружение фосфора в фосфорорганических соединениях Сухой остаток, полученный после минерализации действием смеси азотной и серной кислот, растворяют в 2 - 5 мл воды и исследуют на наличие фосфора. 3. Реакция с молибденовой жидкостью 1 - 2 мл раствора молибдата аммония в азотной кислоте нагревают (не до кипения), к нему по каплям добавляют 0,5 мл испытуемого раствора, при наличии фосфора образуется желтый осадок аммонийной соли фосфорно-молибденовой кислоты. 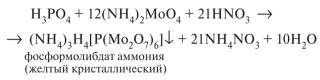 4. Реакция образования молибденовой сини При добавлении к раствору, полученному по 3, нескольких капель насыщенного водного раствора хлорида бензидина, 10% раствора гидроксида аммония до щелочной реакции образуется синее окрашивание. 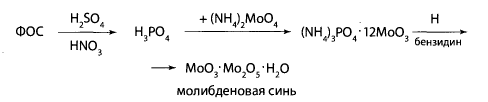 3. ТСХ - скрининг. В скрининге используют системы растворителей: для хлорофоса – ацетон – н - гексан (1:1); для метафоса и карбофоса – ацетон – н - гексан (1:2). Детектирование: Пластину обрабатывают смесью 2% водного раствора резорцина и 10% раствора натрия карбоната (2:3), термостатируют при 100°С 5 - 10 мин. Наблюдают пятна оранжевого цвета - хлорофос. Пластину обрабатывают смесью бромтимолового синего и нитрата серебра, термостатируют при 60°С 20 мин, охлаждают и обрабатывают 10% раствором уксусной кислоты. Наблюдают пятна лилового цвета - метафос и карбофос. Подтверждающие исследования на хлорофос 1. Реакция с резорцином. В пробирку вносят 1 мл исследуемого раствора и 2 капли 1% раствора резорцина в 1% растворе натрия гидроксида. Через 10 мин появляется розовая окраска, а через 15 - 30 мин наблюдается желто-зеленая флуоресценция. Через 4 - 6 часов розовая окраска переходит в оранжевую, затем в желтую. 2. Реакция с ацетоном. В пробирку вносят 0,5 мл раствора исследуемого соединения в этиловом спирте, 1 мл ацетона и 0,5 мл 0,5 н. спиртового раствора натрия гидроксида. Через 5 - 15 мин появляется розовая окраска, переходящая в оранжевую. Контрольные вопросы к защитеОпишите способы изолирования пестицидов из тканей органов и био логических жидкостей. Из биологических объектов тиофос, трихлорметафос-3, карбофос извлекают органическими растворителями. Для очистки полученных извлечений используют методы: вымораживание липидов при низких температурах, реэкстракцию, иногда рекомендуется колоночная хроматография. Карбофос, трихлорметафос-3, тиофос. К 100 г измельченного биологического материала добавляют воду до кашицы, 100 мл хлороформа (или бензола) и смесь оставляют на 4 ч при периодическом перемешивании. Затем органический растворитель сливают и настаивают объект с растворителем еще 2 раза (по 50 мл) в течение 2 ч при взбалтывании. Экстракты объединяют, фильтруют и выпаривают досуха. Остаток растворяют в 10 мл хлороформа и исследуют. Для извлечения трихлорметафоса-3 используют также ацетон, хлороформ или их смесь. Хлорофос. 100 г измельченного биологического материала заливают 150 мл воды очищенной, подкисляют серной кислотой до рН=2-2,5 и оставляют на 2 ч. Затем извлечение процеживают через марлю. К объекту еще 2 раза добавляют воду очищенную (каждый раз по 75 мл) и настаивают по часу. Полученные извлечения объединяют, центрифугируют и экстрагируют 30 мл хлороформа 4 раза. Хлороформные экстракты объединяют, выпаривают до сухого остатка, который растворяют в 5 мл воды очищенной, раствор фильтруют и анализируют. Дайте характеристику этапов предварительного исследования экстракта на наличие пестицидов. 3. Дайте характеристику этапов подтверждающего исследования экс тракта на наличие пестицидов. 4. Объясните принцип холинэстеразной пробы. Холинэстеразная проба. В основе реакции – способность фосфорсодержащих органических соединений снижать активность ацетилхолинэстеразы. Она является общей для фосфорорганических ядохимикатов. Ацетилхолин в присутствии ацетилхолинэстеразы способен разлагаться с образованием уксусной кислоты. Этот процесс можно зафиксировать, если к смеси добавить индикатор бромфеноловый синий. 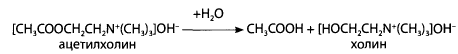 При появлении в растворе уксусной кислоты окраска индикатора меняется от синей до желтой. Если в растворе присутствует фосфорорганическое соединение, являющееся ингибитором ацетилхолинэстеразы, то разложение ацетилхолина до уксусной кислоты не происходит и окраска бромтимолового синего не меняется. Для проведения испытания в фарфоровую чашку вносят индикатор, каплю исследуемого раствора (извлечения из объекта) и каплю раствора холинэстеразы (или плазмы крови, содержащей этот фермент). Через 10 мин добавляют каплю раствора ацетилхолина. Если окраска раствора меняется на желтую, делают вывод о необнаружении в объекте фосфорорганических ядохимикатов. Пробе придается судебно-химическое значение при отрицательном результате из-за ее не- специфичности, так как некоторые другие соединения (например, севин, эзерин) могут также подавлять активность ацетилхолинэстеразы, хотя и не содержат в своей молекуле фосфор. 5. Реакции, подтверждающие наличие фосфорорганических соединений (метафос, карбофос, хлорофос) в экстракте. Холинэстеразная проба В предварительно приготовленном слое агар-агара в чашке Петри прорезают две лунки с помощью стеклянной трубочки. В первую лунку (исследуемая проба) вносят по каплям индикатор, сыворотку, содержащую холинэстеразу, исследуемый раствор, содержащий ФОС, через 10 минут - раствор ацетилхолина. Во вторую лунку (контрольная проба) в тех же количествах вносят индикатор, сыворотку, раствор ацетилхолина. Чашку Петри закрывают и термостатируют при 37 - 40°С 30 минут. Изменение окраски индикатора наблюдается в пробе, не содержащей ФОС. 6. Перечислите реакции, позволяющие обнаружить пестициды группы хлорорганических производных (гептахлор, гексахлорциклогексан) в экстракте. Образование фиолетово-сиреневого пятна на фильтровальной бумаге, обработанной реактивом – смеси диэтаноламина и 2 н раствора калия гидроксида с метанолом в соотношении 1:1. Метод считают специфичным для гептахлора. 7. Реакции, подтверждающие наличие производных карбаминовой кислоты (севина) в экстракте. Обнаружение севина. Севин гидролизуют до 1-нафтола и проводят реакции с 4-аминофеназоном, хлоридом меди и бромидом калия, с хлоридом железа(Ш), с нитритом натрия. Для обнаружения севина используют также хроматографию в тонком слое сорбента и микрокристаллоскопические реакции. Реакция с 4-аминофеназоном. В пробирку вносят 1 мл спиртового раствора, полученного после изолирования, и 0,5 мл аммиачной буферной смеси (растворяют 10 г хлорида аммония в 50 мл 25% раствора аммиака). Пробирку нагревают на водяной бане при температуре 55-60°С (с воздушным холодильником) в течение 15 мин. После охлаждения добавляют три капли 0,5% водного раствора 4-аминофеназона и 6 капель 10% водного раствора гексацианоферрата(Ш) калия – появляется оранжево-красное окрашивание Реакция с хлоридом меди и бромидом калия. В пробирку вносят 1 мл спиртового раствора полученного после изолирования, 0,4 мл 0,5 М раствора гидроксида натрия и нагревают на водяной бане в течение 10 мин при 55°С (с воздушным холодильником). После охлаждения добавляют 0,5 М хлороводородную кислоту до рН=5-6 и 1 мл свежеприготовленной смеси, содержащей 0,1 г хлорида меди(П), 4 г бромида натрия и 5,9 мл воды очищенной. При нагревании смеси до 60°С раствор окрашивается в красно-фиолетовый цвет. При взбалтывании с хлороформом окрашенное соединение переходит в слой хлороформа. Реакция с хлоридом железа(Ш). При добавлении к спиртовому раствору капли 1% раствора хлорида железа(ПГ) появляется розовое окрашивание. Реакция с нитритом натрия. При добавлении к спиртовому раствору 0,5% раствора нитрита натрия и разбавленной серной кислоты образуется желтое окрашивание, которое переходит в оранжевое при добавлении гидроксида натрия. Реакция с пикриновой кислотой. На предметное стекло наносят 1 каплю исследуемого раствора и испаряют досуха. К остатку добавляют 1 каплю раствора пикриновой кислоты. Через 10-15 мин появляются темно-желтые кристаллы, собранные в пучки. При малом содержании севина кристаллы образуются очень медленно (рис. 98). Реакция перекристаллизации. Из спиртового раствора севин кристаллизуется (рис. 99) при испарении растворителя в виде характерных сростков кристаллов (крестов и дендритов). |
