технология. Лабораторная работа 3
 Скачать 3.13 Mb. Скачать 3.13 Mb.
|
 Лабораторная работа №3 Целью данной работы является проведение процесса пиролиза при заданных условиях (температура, соотношение Н2О: сырье, время контакта), составление материального баланса. Пиролиз углеводородного сырья проводят на лабораторной установке с трубчатым реактором при атмосферном давлении. Обогрев трубки реактора, в отличии от промышленности осуществляется не за счет сгорания газов, а с помощью электрических нагревателей в цилиндрических печах. Все результаты заносят в таблицу 11: Таблица 11 – Исходные данные
Порядок выполнения расчетов Рассчитывают суммарный объем паров сырья и воды после испарения в зоне реакции Qп по формуле (11):  где Vр – объем зоны реакции, мл; τ - условное время контакта, c. 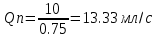 Общее количество бензина и водяного пара, подаваемое в реактор за 1 час, N∑ (моль/час) по формуле 12: 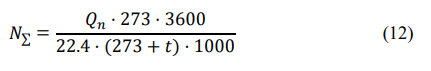 где t – заданная температура процесса, °С; 273 – перевод температуры в абсолютное значение, К; 3600 – коэффициент перевода секунд в часы, с/час; 22,4 – молярный объём идеального газа, л/моль; 1000 – коэффициент для перевода миллилитров в литры, мл/л. 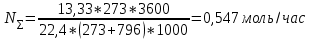 Далее рассчитывают в г/час массовые скорости подачи воды 𝑚 расчв и сырья 𝑚 расчб по формулам (13) и (14) соответсвенно: 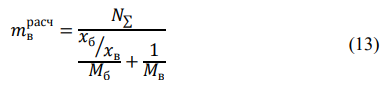 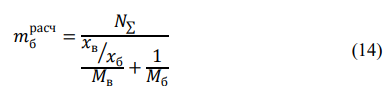 где, N∑ – общее количество бензина и водяного пара, моль/час; 𝑥в⁄𝑥б– заданное массовое соотношение сырье/вода, г/г; Mв – молярная масса воды, г/моль; Mб – молярная масса бензина, г/моль. 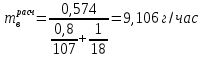 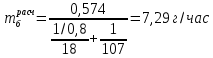 Далее пересчитывают массовые расходы в объемные в мл/час по формуле (15): 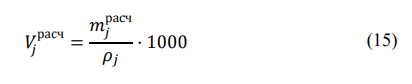 где, 𝑚расч 𝑗 - массовые скорости подачи воды или сырья, г/час; 𝜌𝑗 – плотность воды или сырья, г/л; 1000 – коэффициент для перевода литров в миллилитры, мл/л. 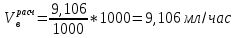 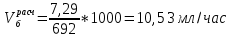 После получения результатов анализа состава пробы пирогаза составляют материальный баланс процесса по форме, приведенной в таблице 12. Для этого, рассчитывают массы поданного прямогонного бензина mб и воды mв по формулам (16) и (17): 𝑚б = где Hб- hб– объем израсходованного прямогонного бензина, мл; ρб– заданная плотность прямогонного бензина, г/л; 1 000 – перевод миллилитров в литры, мл/л; 𝑚в = где Hв– hв– объем израсходованной воды, мл; ρв – плотность воды, принимается равной 1 000 г/л; 1 000 – перевод миллилитров в литры, мл/л. До начала эксперимента в цилиндрах было по 80 мл прямогонного бензина и воды, а после окончания стало 73,6 и 74,1 соответственно. Тогда массы бензина и воды составят: 𝑚б = 6,4/1000*692 = 4,4 г 𝑚в = 5,9/1000*1000 = 5,9 г Затем, рассчитывают массу полученного пирогаза: Для газовой смеси определяют объем каждого составляющего ее компонента Vi по формуле (18): 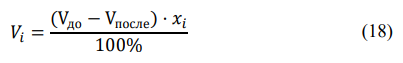 где (Vдо - Vпосле) – общий объем газа, л; xi - объемная доля i-го компонента (из хроматограммы), % об. Определяют массу каждого компонента смеси mi по формуле (19): 𝑚𝑖 = V𝑖 · 𝜌𝑖 (19) где ρi – плотность i-го компонента, г/л (из таблицы 13). Таблица 13 – Плотности газов при стандартных условиях
Этилен С2Н4 1,1733 Азот N2 1,16490
Результаты переносят в таблицу 14. Для объема пирогаза 1,137 л, при содержании в нем 28,58 % этилена: 𝑉С2𝐻4 =(1,137 · 28,58)/100= 0,325 л 𝑚С2𝐻4 = 0,325 · 1,1733 = 0,381 г Таблица 14 – Пример определения массы пирогаза
Далее по разности статей прихода и расхода определяют кокс и потери и рассчитывают массовые проценты. Таким образом, материальный баланс рассматриваемого выше примера будет иметь следующий вид (см. таблицу 15). Таблица 15 – Пример материального баланса
Вывод: в ходе работы провели процесс пиролиза при заданных условиях (температура, соотношение Н2О: сырье, время контакта), составление материального баланса. Масса подсмольной воды составила 4,7 гр, масса смолы пиролиза 1,7 гр. |
