Лабораторная работа 3
 Скачать 60.22 Kb. Скачать 60.22 Kb.
|
Лабораторная работа 3Определение дихромат- и перманганат-ионов в растворе при их совместном присутствии Цель работы: фотометрическое определение концентрации двух компонентов при наличии в спектре поглощения участка, в котором поглощает лишь один из компонентов. Определение дихромат- и перманганат-ионов в растворе при их совместном присутствии основано на различии спектров поглощения определяемых компонентов и использовании закона аддитивности оптической плотности. При длине волны 550 нм, соответствующей максимуму поглощения перманганат-ионов, светопоглощением дихромат-ионов можно пренебречь. При длине волны 430 нм, соответствующей максимуму поглощения дихромат-ионов, свет поглощают оба иона; оптическая плотность растворов при этой длине волны определяется концентрацией обоих компонентов. Перед определением строят градуировочные графики для перманганата калия при 430 и 550 нм и для дихромата калия при 430 нм. Затем измеряют оптическую плотность Аλ2 исследуемого раствора при 550 нм и по графику сразу определяют концентрацию пеманганат-ионов. Зная концентрацию перманганат-ионов можно рассчитать вклад этих ионов в оптическую плотность анализируемого раствора при 430 нм и используя закон аддитивности оптической плотности рассчитать оптическую плотность А2 раствора дихромат-ионов при данной длине волны и, следовательно, концентрацию дихромат-ионов. Измеряют оптическую плотность Аλ1 анализируемой смеси при длине волны 430 нм, равную сумме оптических плотностей компонентов при данной длине волны: Аλ1 = А1 + А2, где А1 и А2 – соответственно оптические плотности за счет поглощения дихроматом- и перманганатом калия, находящихся в смеси. Значение А2 определяют по прямой 2 (рис.6), зная концентрацию перманганат-ионов в исследуемой смеси, которая найдена по прямой 1 (рис.6). По разности находят А1 = Аλ1 - А2. По значению А1 и прямой 3 (рис.6) определяют концентрацию дихромат-ионов в анализируемой смеси. 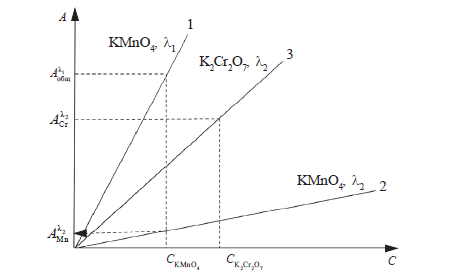 Рис.6. Градуировочные графики для определения перманганат- и дихромат-ионов при их совместном присутствии: 1 – кривая для определения перманганат-иона при 550 нм; 2 – кривая для определения перманганат-иона при 430 нм; 3 – кривая для определения дихромат- иона при 430 нм. Реактивы и оборудование: Стандартный раствор дихромата калия, C(K2Cr2O7) =0,1 мг/мл; стандартный раствор пермангана калия , C(KMnO4) = 0,1 мг/мл Колбы мерные (50 мл; бюретка (25 мл); цилиндр мерный (10 мл). Фотоэлектроколориметр КФК-2; кюветы (l = 10 мм). Выполнение работы 1. Приготовление эталонных растворов В пять мерных колб на 50 мл помещают из бюретки 1,0; 2,0; 3,0; 4,0; 5,0 мл стандартного раствора KMnO4. Для приготовления эталонных растворов K2Cr2O7 в колбы на 50 мл берут соответственно 2,0; 4,0; 6,0; 8,0; 10,0 мл стандартного раствора. Содержимое каждой колбы доводят дистиллированной водой до метки и тщательно перемешивают. 2. Построение калибровочных кривых Оптическую плотность эталонных растворов измеряют в кюветах с толщиной поглощающего слоя 10 мм, используя в качестве раствора сравнения дистиллированную воду. Оптическую плотность растворов дихромата калия измеряют при λ = 430 нм, оптическую плотность растворов перманганата калия - последовательно с двумя светофильтрами с максимумом светопропускания при 430 и 550 нм. Рассчитанные значения концентраций эталонных растворов и измеренные оптические плотности этих растворов заносят в таблицу: Характеристики эталонных растворов KMnO4 и K2Cr2O
По полученным данным строят градуировочные графики 1, 2, 3 (рис.6). Для этого по оси абсцисс откладывают молярные концентрации определяемых ионов в эталонных растворах, а по оси ординат – соответствующие значения оптических плотностей. 3. Определение содержания дихромат- и перманганат-ионов в анализируемом растворе В мерную колбочку на 50 мл получают контрольную задачу, содержащую смесь дихромата калия и перманганата калия, разбавляют водой до метки, тщательно перемешивают и измеряют оптическую плотность раствора при 550 и 430 нм в кюветах с толщиной слоя 10 мм. Каждое измерение проводят не менее 2-3 раз и записывают среднее значение оптической плотности анализируемого раствора при соответствующих длинах волн. В качестве раствора сравнения используют дистиллированную воду. По полученным данным и прямым 1-3 (рис.6) находят содержание дихромат- и перманганат-ионов в растворе. Рассчитывают массу определяемых компонентов, используя следующие формулы: m(MnO4-) = T(MnO4-) ∙ Vколбы; m(Cr2O72-) = T(Cr2O72-) ∙ Vколбы. Полученный результат сравнивают с данными, имеющимися у преподавателя. Вычисляют абсолютную и относительную ошибку определения. Лабораторная работа 4Фотометрическое определение железа (III) методом добавок Цель работы: освоить порядок фотометрического определения концентрации в растворе методом добавок. Метод добавок применяется для анализа растворов с низкой концентрацией определяемого компонента и при определении веществ в присутствии примесей, которые могут влиять на поглощение исследуемого раствора. Сульфосалициловая кислота (2-окси-5-сульфобензойная) образует с ионами железа (III) ряд комплексных соединений, строение которых зависит от рН раствора. При рН = 8-11 преобладает трисульфосалицилат железа [Fe(SSal)3]3- желтого цвета, максимум светопоглощения лежит в области 400-430 нм. Сульфосалицилатный метод можно применять для определения железа (III) в присутствии таких анионов как фосфаты, хлориды, фториды, которые мешают определению железа роданидным методом. Катионы Al3+, Cu2+, Pb2+, образующие с сульфосалициловой кислотой комплексные соединения, затрудняют определение железа (III). Поэтому для определения Fe3+ в форме трисульфосалицилата используют метод добавок, позволяющий исключить влияние других катионов на результат анализа. В настоящей работе определение железа (III) проводится графическим вариантом метода добавок, который заключается в следующем: к нескольким аликвотным частям анализируемого раствора добавляют различные (кратные) количества стандартного раствора определяемого вещества и, приготовив окрашенные растворы, измеряют их оптические плотности. Затем строят график в координатах: оптическая плотность – концентрация добавок (рис. 4). Отрезок, отсекаемый прямой на оси абсцисс, указывает величину концентрации анализируемого раствора. Одним из достоинств метода добавок является возможность повышения величины оптической плотности фотометрируемой системы за счет внесения добавки. Реактивы и оборудование: Стандартный раствор соли железа (III): 0,864 г железо-аммонийных квасцов растворяют в дистиллированной воде, предварительно подкисленной 5 мл концентрированной серной кислоты, и доводят объем раствора до 1 л. Концентрация полученного раствора 0,1 мг/мл. Рабочий раствор готовят в день проведения анализа разбавлением основного раствора в 4 раза. Сульфосалициловая кислота, 10 % раствор; аммиак, 12,5 % раствор. Мерные колбы (50 мл); градуированная пипетка (5 мл) 4. Фотоэлектроколориметр КФК-2; кюветы (l = 20 мм). Выполнение работы 1. Определение железа (III) в растворе В три мерные колбы вместимостью 50 мл получают раствор задачи. Во вторую колбу приливают 2,5 мл стандартного раствора, в третью – 5,0 мл стандартного раствора железа (III). Затем в каждую из трех колб добавляют по 5,0 мл раствора аммиака и по 5,0 мл сульфосалициловой кислоты. Объем раствора доводят до метки и тщательно перемешивают. В четвертую колбу помещают по 5,0 мл раствора аммиака и сульфосалициловой кислоты и разбавляют водой до метки (раствор сравнения). С помощью фотоэлектроколориметра производят измерение оптической плотности первых трех растворов относительно четвертого в кювете с толщиной поглощающего слоя 2 см при длине волны 430 нм. По полученным данным строят график зависимости оптической плотности от концентрации добавок и находят концентрацию железа (III) в анализируемом растворе. Масса железа (III) в исследуемом растворе равна: m ( Fe3+), мг = T( Fe3+) · V колбы . Полученный результат сравнивают с данными, имеющимися у преподавателя. Вычисляют абсолютную и относительную ошибку определения. Лабораторная работа 5Фотометрическое определение никеля методомдифференциальной фотоколориметрииЦель работы: закрепить навыки работы на фотоэлектроколориметре КФК-2. Определить содержание никеля (II) в растворе методом дифференциальной фотоколориметрии. При сравнительно больших концентраций окрашенных растворов светопоглощение их достаточно велико и становится невозможным компенсирование световых потоков, прошедших через фотометрируемый и «холостой» растворы. В данном случае используют дифференциальный вариант фотометрического метода, при котором сравниваются световые потоки, прошедшие через фотометрируемый раствор и раствор определяемого вещества с концентрацией C0 близкой к концентрации исследуемого раствора. В основе определения лежит реакция образования в щелочной среде окрашенного в малиново-красный цвет внутрикомплексного соединения никеля с диметилглиоксимом (реактивом Чугаева). Комплекс, образующийся в щелочной среде, характеризуется интенсивной полосой поглощения с λmax = 470 нм и εmax = 1,3 ∙ 104. Соотношение Ni : H2D в комплексе равно 1:3. В качестве окислителя применяется персульфат аммония или иод. Для аналитических целей в качестве окислителя лучше использовать иод, так как получающееся в его присутствии комплексное соединение более устойчиво во времени. Определению никеля, описанной фотометрической реакцией, мешают примеси Fe3+ и Al3+. Их чаще всего маскируют тартратами или цитратами. Реактивы и оборудование: 1. Стандартный раствор никеля (II), 0,1 мг/мл; иод, C(I2) = 0,05 моль/л; диметилглиоксим (H2D), 1%-ный раствор в 20% растворе NaOH. 2. Мерные колбы (50 мл) – 6 штук; градуированные пипетки (1 мл, 10 мл). 3. Фотоэлектроколориметр КФК-2; кюветы (l = 10 мм) Выполнение работы 1. Построение градуировочного графика В пять мерных колб объемом 50 мл вносят 20 мл дистиллированной воды, 0,5; 1,0; 2,0; 4,0; 5,0 мл стандартного раствора соли никеля соответственно, 5,0 мл раствора иода, 5,0 мл раствора диметилглиоксима. Содержимое колб разбавляют водой до метки. Через 10 мин. растворы фотометрируют при λ = 470 нм в кювете с толщиной слоя 10 мм.Раствором сравнения служит раствор C0 = 0,004 мг/мл. Результаты представляют в виде таблицы. Измерение оптической плотности стандартных растворов
По результатам измерений строят градуировочный график в координатах оптическая плотность – концентрация никеля (II). Примечание. Если оптическая плотность раствора сравнения больше, чем оптическая плотность измеренного раствора, следует измерить оптическую плотность раствора сравнения относительно измеренного и полученное значение брать со знаком «минус». 2. Определение никеля в исследуемом растворе В мерную колбу емкостью 50 мл получают аликвоту исследуемого раствора, разбавляют водой примерно до 20 мл и затем проводят те же операции и в той же последовательности, что и при приготовлении растворов, используемых для построения градуировочного графика. Спустя 10 мин. после приготовления, раствор фотометрируют относительно раствора C0(Ni2+) = 0,004 мг/мл. Содержание никеля находят по градуировочному графику. Массу никеля в исследуемом растворе вычисляют по формуле: m (Ni2+), мг = T(Ni2+) ·Vколбы . Полученный результат сравнивают с данными, имеющимися у преподавателя. Вычисляют абсолютную и относительную ошибки. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
