МЕТОД МАРГОШЕСА. Лабораторная работа 4 Влияние иммобилизации гидролитических ферментов на эффективность ферментативного гидролиза низко и высокомолекулярных субстратов
 Скачать 284.5 Kb. Скачать 284.5 Kb.
|
|
Лабораторная работа №4 Влияние иммобилизации гидролитических ферментов на эффективность ферментативного гидролиза низко- и высокомолекулярных субстратов. Ход работы: Приготовление растворов ферментов. Приготовить по 20 мл растворов комплексного амилолитического ферментного препарата и лактазы в концентрациях, заданных руководителем практикума. Иммобилизация ферментов Иммобилизацию каждого ферментного препарата (отдельно) проводить в геле альгината кальция. Для этого осторожно смешать равные объёмы альгината натрия (4 %-ный раствор) и раствор фермента (по 5 мл). С высоты около 20 см капать смесь из шприца в избыток 0,2 М раствора CaCl2 (избыток, т.е. объем превышает общий объем смеси в 10 раз). Оставить частицы в растворе хлорида кальция на 20 минут для застывания. Приготовление растворов субстратов. Приготовить растворы крахмала и лактозы с концентрацией 0,2 % (по 500 мл). Для этого отмерить массу крахмала в стеклянном стаканчике на 50 мл и растворить в части холодной воды, отмеренной для приготовления раствора. Остальную воду довести до кипения на плитке и при постоянном перемешивании и кипении влить в нее содержимое стаканчика. После этого охладить получившийся раствор крахмала до комнатной температуры. Лактозу готовят растворением навески лактозы в холодной воде. Осахаривание субстратов. Провести частичное осахаривание крахмала в двух колбах: с использованием раствора фермента и иммобилизованного ферментного препарата. Продолжительность процесса – 1,5 часа. Объем раствора крахмала на осахаривание – 200 мл (+ 20 мл фосфатного 0,1 M буфера рН 6,8). Температура процесса – 30-35 °С. Объем раствора фермента, вносимого на осахаривание равен объемам, использованным для приготовления иммобилизованного препарата. Процесс вести при периодическом перемешивании. Осахаривание лактозы вести аналогичным образом свободным и иммобилизованными препаратами. Определение степени гидролиза субстратов и сравнение эффективности иммобилизованных и не иммобилизованных ферментных препаратов. Каждые 15 минут (включая нулевую точку – сразу в начале процесса) осахаривания из растворов отбирают аликвоту в 1 мл, центрифугируют ее при 10 000 об/мин в течение 1 минуты, определяют в ней содержание глюкозы на глюкозиметре (глюкозооксидазным методом).  где 𝐶𝑖 − концентрация глюкозы, ммоль/л; 1000 – коэф. пересчета ммоль в моль; 𝑀 − молекулярная масса глюкозы, 180 г/моль; 𝑉 − объема раствора, в котором происходит гидролиз субстрата, 225 мл (при каждом измерении уменьшается на 1 мл). Активность фермента: 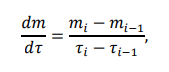 где 𝑚𝑖 − масса глюкозы в момент времени 𝜏𝑖 . Удельная активность рассчитана как масса образовавшейся глюкозы в единицу времени одним мл раствора фермента. Таблица 2 – расчет удельной активности фермента амилазы  График 1 – зависимость концентрации глюкозы в растворе крахмала от времени гидролиза. 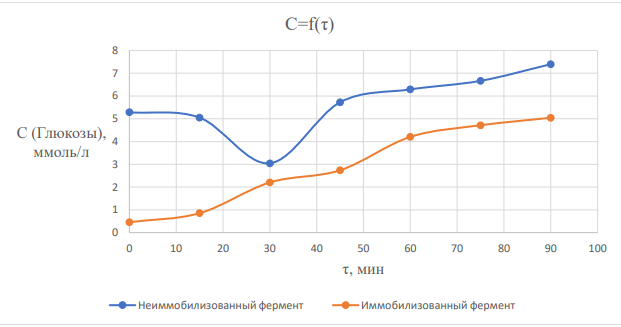 На графике 1 видно, что зависимость концентрации глюкозы в растворе от времени гидролиза крахмала под действием амилазы является линейной (Для неиммобилизованного фермента точки 2 и 3 выпадают, ими можно пренебречь) Активность амилазы Если не учитывать точки 2 и 3, то в среднем за одну минуту образуется 0,0011 г глюкозы при воздействии неиммобилизованной амилазы. Активность иммобилизованной амилазы будет равна 0,0020 г/мин. Удельная активность амилазы Удельная активность, рассчитанная на объем раствора фермента (5 мл): 0,00023 г глюкозы образуется за минуту одним мл раствора неиммобилизованного фермента. Удельная активность иммобилизованной амилазы будет равна 0,00040 г/(мин*мл)  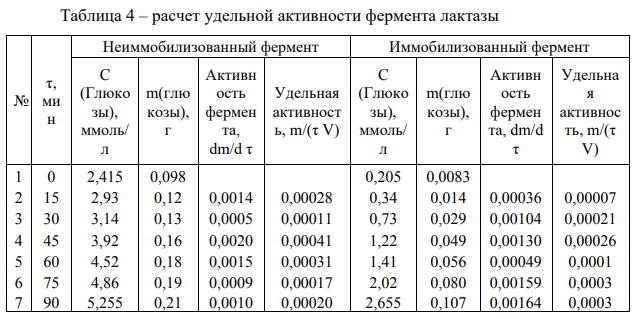 На графике 2 видно, что зависимость концентрации глюкозы в растворе от времени гидролиза лактозы под действием лактазы является линейной. Активность лактазы В среднем за одну минуту образуется 0,0012 г глюкозы при воздействии неиммобилизованной лакатзы. Активность иммобилизованной лактазы будет равна 0,0011 г/мин. График 2 – зависимость концентрации глюкозы в растворе лактозы от времени гидролиза. 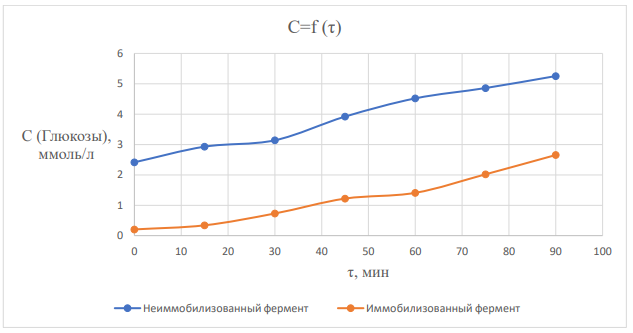 Удельная активность лактазы Удельная активность, рассчитанная на объем раствора фермента (5мл): 0,000243 г глюкозы образуется за минуту одним мл раствора неиммобилизованного фермента. Удельная активность иммобилизованной лактозы будет равна 0,000214 г/(мин*мл). Вывод: в лабораторной работе была определена активность иммобилизованных и неиммобизованных ферментов лактазы и амилазы. Иммобилизация ферментов в геле в случае лактазы, приводила к уменьшению активности, а в случае амилазы, активность увеличилась. При этом удельная активность лактазы оказалась больше, чем для амилазы, так как матрица геля создает препятствия для диффузии субстрата к ферменту, снижая каталитическую эффективность иммобилизованного препарата. Поэтому высокомолекулярный крахмал в меньшей степени подвергался гидролизу, чем лактоза, которая является дисахаридом. Лабораторная работа №5 Применение химического метода иммобилизации ферментов на полимерных носителях Ход работы: Активация целлюлозы глутаровым диальдегидом В колбу на 250мл отбирают навеску целлюлозы с точностью до 0,0002 г, равную 0,5 г (на а.с.м.) и заливают её 125 мл 2 % глутаровым диальдегидом. Периодически перемешивая, пробу оставляют на 60 мин. После целлюлозу тщательно промывают дистиллированной водой иотделяют остаток с помощью центрифугирования. 2. Иммобилизация фермента на целлюлозе Иммобилизацию бета-галактозидазы проводят на подготовленные целлюлозные носители (активированный и неактивированный образцы целлюлозы). Отбирают навеску носителя определенной массы (0,1 г с точностью до 0,0002 г), помещают в пробирки на 1,5 мл. Далее готовят раствор нативного фермента заданной концентрации (2 мг/мл), имеющего значение рН 6,86 (на 0,1 М фосфатном буфере). Соотношение массы пропиточного раствора фермента и массы носителя составляет 10:1. После добавления фермента в пробирки содержимое оставляют на 60 минут, периодически (каждые 15 минут) перемешивая на вортексе. 3. Определение активности иммобилизованных препаратов По прошествии указанного времени при помощи центрифуги отделяют целлюлозную матрицу от жидкой фракции, трижды промывают матрицу буфером. Содержимое пробирки буфером переносится в 1 мл 0,5 % раствора лактозы и определяется удельная активность иммобилизованного фермента в процессе 20- минутного гидролиза (замеры уровня продукта гидролиза – глюкозы проводится каждые 10 минут: 10, 20 минут на глюкозиметре). Таблица 1 – результаты измерений содержания глюкозы в растворе с неактивированным носителем и активности фермента  где 𝐶𝑖 − концентрация глюкозы, ммоль/л; 1000 – коэф. пересчета ммоль в моль; 𝑀 − молекулярная масса глюкозы, 180 г/моль; 𝑉 − объема раствора, в котором происходит гидролиз субстрата, 1 мл Активность фермента: 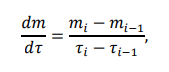 где 𝑚𝑖 − масса глюкозы в момент времени 𝜏𝑖 . График 1 – зависимость концентрации глюкозы в растворе с неактивированной целлюлозой от времени гидролиза. 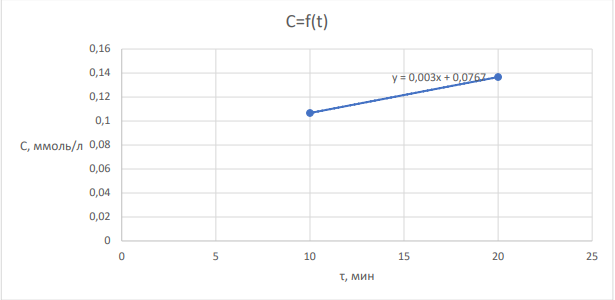 Таблица 2 – результаты измерений содержания глюкозы в растворе с активированным носителем и активности фермента  График 2 – зависимость концентрации глюкозы в растворе с активированной целлюлозой от времени гидролиза.  По полученным данным активности ферментов и построенным графикам можно увидеть, что фермент, иммобилизованный на активированной целлюлозе, проявляет большую активность, чем на неактивированном носителе (активности ферментов 1,02*10-6 и 5,4*10-7 г/мин соответственно) Целлюлоза с привитыми группировками глутарового альдегида в большей степени иммобилизует на себе фермент. Вывод: в лабороаторной работе было проведено определение активностей иммобилизованных ферментов на активированной глутаровым альдегидом целлюлозе и на неактивированной целлюлозе. В случае активированной целлюлозы активность оказалась выше. Это объясняется тем, целлюлоза имеет много гидроксильных групп, и это позволяет модифицировать её, замещая эти группы. Заместителем является глутаровый альдегид. C=O-группы глутарового альдегида обеспечивают механизм химической иммобилизации фермента. Глутаровый диальдегид способствует образованию ковалентной связи фермента с носителем. |
