Лаб.раб. №6. Комплексные соединения. Лабораторная работа 6 Изучение комплексных соединений
 Скачать 24.18 Kb. Скачать 24.18 Kb.
|
|
Лабораторная работа №6 Изучение комплексных соединений Цель работы - выработать навыки работы с комплексными соединениями, изучить их важнейшие химические свойства и закрепить знания основных положений координационной теории. 1. Теоретическое введение Комплексными соединениями называются молекулярные соединения, в узлах кристаллической решетки которых находятся комплексные частицы, способные к самостоятельному существованию в растворе. В центре комплексного соединения находится атом металла в нулевой или положительной степени окисления, соединенный с несколькими молекулами или ионами. Центральный атом, вокруг которого координируются другие частицы, называется комплексообразователем. В качестве комплексообразователя чаще всего выступают ионы или атомы d- и f-элементов, реже – p-элементов, очень редко s-элементов. Частицы, координированные вокруг комплексообразователя, называются лигандами. Лигандами могут быть отрицательно заряженные ионы (Сl-, СN-, ОН- и т. п.) или нейтральные молекулы (H2О, NН3, СО и т. п.). Между комплексообразователем и лигандами реализуется ковалентная химическая связь по донорно-акцепторному механизму. Комплексообразователь и лиганды образуют внутреннюю сферу, а остальные ионы составляют внешнюю сферу комплексного соединения. Число лигандов, удерживаемых комплексообразователем, называется координационным числом. Координационное число равно числу связей, которые образует комплексообразователь с лигандами. Согласно эмпирическому правилу, координационное число равно удвоенной степени окисления атома комплексообразователя. В растворах комплексные соединения диссоциируют ступенчато. Диссоциация комплексного соединения на внешнюю и внутреннюю сферы протекает полностью. Например: [Cu(NH3)4](OH)2 = [Cu(NH3)4]2+ + 2OH-. Комплексные ионы в водном растворе также диссоциируют, но очень незначительно: [Cu(NH3)4]2+ ⇄ Cu2+ + 4NH3. Описывающая этот обратимый процесс константа диссоциации носит название константы нестойкости комплексной частицы Кн. 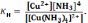 Комплексные соединения могут вступать как в обменные, так и в окислительно-восстановительные реакции. Комплексные частицы содержатся и в кристаллической решетке двойных солей. При растворении двойных солей в воде они полностью распадаются на образующие их ионы. Понятие константы нестойкости для них теряет смысл. 2. Приборы и реактивы В работе используют пробирки, спиртовку. Реактивы: соль Мора, гексацианоферрат (III) калия (красная кровяная соль), лакмусовая бумага красная, бензол, олово гранулированное, растворы соляной кислоты (2 М), едкого натра (2 М), аммиака (25%-ный), иодида калия (0,5 М), нитрата ртути (II) (0,25 М), сульфата меди (II) (0,25 М), хлорида бария (0,25 М), сульфата никеля (0,25 М), роданида аммония (6 М), нитрата или сульфата кобальта (0,25 М), оксалата аммония (0,25 М), сульфида натрия (0,25 М), гексацианоферрата (II) калия (0,125 М). 3. Порядок проведения эксперимента. Указания по технике безопасности Опыт 1. Катионные комплексы 3.1.1. В две пробирки поместите по 5 капель раствора сульфата меди (II). Добавьте в одну пробирку 2 капли раствора хлорида бария. Наблюдайте выпадение белого осадка сульфата бария. Во вторую пробирку внесите кусочек гранулированного олова и наблюдайте выделение на его поверхности красноватого налета меди. 3.1.2. Поместите в чистую пробирку 8 - 10 капель раствора сульфата меди (II) и по каплям добавьте 25%-ный раствор аммиака. Наблюдайте растворение выпавшего сначала осадка сульфата гидроксомеди (II) и изменение цвета раствора при образовании комплексного соединения меди. Полученный раствор разлейте в две пробирки и проведите те же два опыта, которые были проделаны с раствором медного купороса. Отметьте, выпадает ли осадок при добавлении хлорида бария и выделяется ли медь на грануле олова. 3.1.3. Внесите в пробирку 3 - 4 капли раствора сульфата никеля, добавьте такой же объем раствора едкого натра. Наблюдайте выпадение осадка гидроксида никеля. К осадку добавьте 5 - 6 капель 25%-ного раствора аммиака. Наблюдайте растворение осадка. Сравните цвета исходного раствора соли никеля и полученного комплексного гидроксида. Составьте электронные формулы катионов - комплексообразователей в полученных комплексных соединениях, а также схему электронной конфигурации их последних электронных подуровней. Укажите, к какому электронному семейству относятся данные элементы. Опыт 2. Анионные комплексы 3.2.1. Внесите в пробирку 3 - 4 капли раствора нитрата ртути (II) и добавьте раствор роданида аммония. Наблюдайте выпадение осадка роданида ртути (II) и затем растворение его за счет образования тетрароданомеркурата (II) аммония. 3.2.2. В другую пробирку внесите 4 - 5 капель раствора нитрата или сульфата кобальта и добавьте такой же объем полученного раствора тетрароданомеркурата (II) аммония. Отметьте цвет образующегося осадка тетрароданомеркурата (II) кобальта. Для полученного анионного комплекса определите заряд комплексной частицы, степень окисления комплексообразователя и его координационное число. На примере данного комплекса сформулируйте правило, определяющее связь между двумя последними величинами. Опыт 3. Комплексные соединения в окислительно-восстановительных реакциях 3.3.1. В пробирку внесите 4-5 капель раствора иодида калия, 4 - 6 капель раствора соляной кислоты и 4 - 5 капель бензола, используемого в качестве экстрагента. 3.3.2. Добавьте один микрошпатель кристаллов гексацианоферрата (III) калия и перемешайте раствор встряхиванием. По изменению окраски слоя органического растворителя убедитесь в выделении свободного йода. Рассчитайте молярную массу эквивалента окислителя в данной реакции. Опыт 4. Прочность комплексных ионов 3.4.1. В две пробирки с раствором сульфата меди (II) добавьте: в одну раствор оксалата аммония, в другую – раствор сульфида натрия (ТЯГА!). Отметьте цвета выпавших осадков. 3.4.2. В двух других пробирках получите сульфат тетраамминмеди (II), добавив к 3 - 4 каплям раствора сульфата меди (II) раствор аммиака до растворения выпадающего вначале осадка основной соли меди. 3.4.3. Испытайте действие растворов оксалата и сульфида натрия на полученный раствор комплексной соли меди. Отметьте, после прибавления какого реактива выпадает осадок. На присутствие каких ионов в растворе комплексной соли указывает появление этого осадка? Определите, какая соль меди (II): оксалат или сульфид - является более труднорастворимой. Укажите предельное значение коэффициента Вант-Гоффа в растворе сульфата тетраамминмеди (II), если не принимать во внимание диссоциацию комплексного иона на составляющие его частицы. Опыт 5. Двойные соли 3.5.1. Приготовьте в пробирке раствор соли Мора (NH4)2SO4.FeSO4.6H2O: заполните пробирку на одну треть дистиллированной водой и растворите в ней 2 - 3 микрошпателя соли. Разлейте полученный раствор в три пробирки. 3.5.2. В одну пробирку добавьте 2 - 3 капли раствора сульфида натрия (ТЯГА!), в другую - столько же хлорида бария. Наблюдайте выпадение осадков в обеих пробирках, отметьте их цвет. 3.5.3. В третью пробирку добавьте 5 - 6 капель раствора едкого натра и осторожно нагрейте ее в пламени спиртовки. Подержите над пробиркой красную лакмусовую бумажку, смоченную водой. По изменению окраски лакмуса определите, какой газ выделяется из пробирки. Укажите, на присутствие каких ионов в растворе двойной соли указывают проведенные реакции. 3.5.4. Проверьте действием раствора сульфида натрия (ТЯГА!), обнаруживаются ли ионы Fе2+ в растворе гексацианоферрата (II) калия. Наблюдается ли выпадение осадка сульфида железа (II)? Чем отличается электролитическая диссоциация двойной соли от диссоциации соли, содержащей устойчивый комплексный ион? Составьте уравнения реакций, которые описывают диссоциацию в водном растворе соли Мора и гексацианоферрата (II) калия. Укажите, для какого из этих процессов неприменимо понятие константы нестойкости. Ответ мотивируйте. 4. Обработка результатов эксперимента См. лабораторную работу 5. 5. Требования к отчету Наряду с выполнением общих требований к отчету, изложенных во Введении, необходимо для всех полученных Вами комплексных частиц составить уравнения диссоциации и выражения для констант нестойкости. Приведите их численные значения, воспользовавшись Приложением 3. 6. Контрольные вопросы 1. Составьте координационную формулу и напишите выражение для константы нестойкости октациановольфрамата (IV) натрия. 2. Известно, что из раствора комплексной соли СrСl3 . 6NH3 нитрат серебра осаждает весь хлор, а из раствора СrС13 . 5NН3 только 2/3 хлора. Напишите координационные формулы этих солей и составьте уравнения их диссоциации. Напишите выражения для констант нестойкости. 4. Объясните, какой комплексообразователь должен давать более прочные комплексы: а) Са2+ или Zn2+; б) Ni2+ или Mg2+. 5. Составьте уравнения реакции взаимодействия: а) гексароданоферрата (III) калия с избытком фторида натрия (происходит внутрисферное замещение лигандов); б) тетрахлорокупрата (II) калия с сульфидом калия (комплекс разрушается). 6. На раствор сульфата железа (III) подействовали избытком раствора цианида калия. Составьте уравнение протекающей реакции, назовите образовавшееся комплексное соединение. |
