Лабораторная работа 6 Качественные реакции катионов v аналитической группы и анализ их смеси
 Скачать 183.5 Kb. Скачать 183.5 Kb.
|
|
Качественные реакции катионов V аналитической группы и анализ их смеси Задания. 1. Проделайте опыты, характеризующие свойства катионов V группы, и заполните таблицу. 2. Экспериментально определите катионы V аналитической группы, содержащиеся в контрольной смеси 3. Заполните схему анализа.  Соблюдайте правила техники безопасности! Ход анализа Проведение качественных реакций на катионы V группы Групповым реагентом, также как и в IV группе являются щелочи (NaOH, KOH), только катионы пятой группы образуют со щелочами нерастворимые в избытке реагента гидроксиды. Однако, под действием минеральных кислот (азотной, соляной и серной), образовавшиеся гидроксиды легко растворяются. Опыт 1. В 5 пробирок налейте по 3 капли солей железа (II) и (III), висмута, марганца и магния и в каждую прилейте по 3 капли раствора щелочи (NaOH). Наблюдайте образование осадков разных цветов (запишите цвет осадков в таблицу). Затем прилейте избыток гидроксида натрия (еще 5-6 капель) и пронаблюдайте, растворяется ли осадок? После этого прилейте в каждую пробирку по 10 капель азотной кислоты, растворяются ли образованные гидроксиды в данных условиях. (Запишите полученные результаты): ______________________________________________________________________________________________________ Примечание: Свежеосажденный осадок Fе(OH)2 имеет белый цвет. Однако на воздухе в результате частичного окисления кислородом осадок приобретает грязно-зеленый цвет: 4Fе(OH)2 + 2Н2О + O2 = ↓4Fe(OH)3 Белый осадок Mn(OH)2 на воздухе буреет (желтеет) вследствие перехода Mn2+ в Mn4+, при этом образуется MnO(OH)2 или H2MnO3 (марганцоватистая кислота). Качественные реакции на ион Fe2+. Опыт 2. Реакция с раствором аммиака. В пробирку поместите 2-3 капли раствора соли железа (II) добавьте 4-5 капель 10-процентного раствора хлорида или сульфата аммония, а затем 2-3 капли раствора аммиака. Проверьте, образуется ли осадок. Условия проведения опыта: 1. Реакцию надо проводить при рН = 12-13. 2. Присутствие солей аммония препятствует выпадению осадка. 3. Кислород воздуха вызывает изменение окраски вследствие частичного окисления ионов Fe2 +. Опыт 3. Взаимодействие с гексацианоферратом (III) калия (Феррицианидом калия K3[Fe(CN)6] Налейте в пробирку 2-3 капли раствора соли железа (II), добавьте 4-5 капель дистиллированной воды и 2 капли раствора феррицианида калия. Образуется синий осадок турнбулевой сини, который не растворяется в кислотах: [Fe(CN)6]3- + Fe2+ → Fe3[Fe(CN)6]2 Условия проведения опыта: 1. Реакция дает хорошие результаты при рН ˂ 3. 2. Свободная щелочь вызывает разложение турнбулевой сини. 3. Ионы Fe3+ и др. не мешают проведению реакции. Опыт 4. Взаимодействие с диметилглиоксимом (реактив Чугаева)1 На предметное стекло поместите каплю анализируемого раствора, добавьте каплю реактива Чугаева и каплю водного аммиака, раствор окрашивается в карминово-красный цвет. Условия проведения опыта: 1. Реакцию проводят при рН > 7 (в аммиачной среде). 2. Обнаружению ионов Fe2+ мешают ионы Mn2+, Ni2+ и др. Опыт 5. Окисление катиона Fe2+ в катион Fe3+. Возьмите 3-4 капли раствора соли двухвалентного железа и прибавьте 3 капли 2 н. раствора серной кислоты и 2-3 капли раствора азотной кислоты, смесь нагрейте до исчезновения бурых паров: 6FeSО4 +3H2SО4 + 2HNО3 = 3Fe2(SO4)3 + 2NO↑ + 4H2О 3Fe2+ + 4H+ + NO3- = 3Fe3+ + NO↑ + 2H2О Условия проведения опыта: 1. Реакцию проводят при рН < 7. 2. Для окисления берут раствор 32%-ой азотной кислоты. 3. Реакция протекает лучше при нагревании. Качественные реакции на ион Fe3+. Растворы солей трехвалентного железа имеют желтую или красно-бурую окраску. Опыт 6. Реакция с раствором аммиака. Возьмите 3-4 капли раствора соли железа (III), добавьте 2-3 капли раствора аммиака, наблюдайте образование красно-бурого осадка Fe(OH)3. Гидроксид железа (III) не будет растворяться в солях аммония, растворим в азотной кислоте. Опыт 7. Взаимодействие с гексацианоферратом (III) калия (Феррицианидом калия K3[Fe(CN)6] Возьмите в пробирку 2-3 капли раствора соли железа (III), добавьте 3-4 капли дистиллированной воды, 1-2 капли соляной кислоты и 2 капли раствора ферроцианида калия. Образуется синий осадок или окрашивание. Реакцию можно проводить капельным методом на фильтровальной бумаге или предметном стекле. (Проведите реакцию в обоих вариантах) Условия выполнения опыта: 1.Реакцию проводят при рН < 3. 2. Свободные щелочи разлагают берлинскую лазурь. 3. Железо (II) и другие катионы не мешают открытию катионов. 4. Избыток K4[Fe(CN)6] не желателен, так как может вызывать образование растворимой формы берлинской лазури. Опыт 8. Взаимодействие с роданидом аммония (NH4CNS) В пробирку налейте 2-3 капли раствора соли железа (III), прибавьте 2 капли раствора роданида калия. Наблюдайте окрашивание раствора в кроваво-красный цвет. Условия проведения опыта: 1. Реакцию следует проводить при рН < 3. 2. Для полноты протекания реакции необходимо использовать конц. растворы NH4CNS или KCNS. 3. Наличие ионов Fe2+ не мешает реакции. Качественные реакции на ион Mn2+. Растворы солей марганца имеют бледно-розовую окраску, а разбавленные растворы бесцветны. Опыт 9. Реакция с раствором аммиака. Налейте в пробирку 2-3 капли раствора соли марганца, добавьте 3 капли раствора аммиака. Получается белый осадок, растворимый в минеральных кислотах и избытке аммиака (особенно в присутствии солей аммония). Условия проведения опыта: 1. Реакцию надо проводить при рН = 9-10. 2. Наличие ионов NH4+ способствует растворению осадка. Опыт 10. Окисление катиона Mn2+ в анион MnO4- Эта реакция имеет очень большое значение для обнаружения катиона Mn2+, так как позволяет открывать его в присутствии катионов всех аналитических групп. а) Окисление двуокисью свинца PbO2. Возьмите в пробирку лопаточкой немного двуокиси свинца PbO2, добавьте туда 5-7 капель азотной кислоты и нагрейте. Затем дайте постоять 2-4 мин. Если окраска раствора будет малиновой, то двуокись свинца PbO2 содержит следы марганца и для опыта непригодна. Если же окраска отсутствует, то прибавьте каплю разбавленного в десять раз раствора Mn2+, перемешайте и нагрейте. Катионы Mn2+ окисляются в марганцевую кислоту, имеющую характерный малиновый цвет: 2Mn(NO3)2 + 5PbO2 + 6HNО3 = 2НМnO4 + + 5Pb(NO3)2+ 2Н2О 2Mn2+ + 5РЬО2 + 4Н+ = 2МnО4- + 5Pb2+ + 2Н2О Условия проведения опыта: 1. Реакция должна проводиться при рН < 2. 2. Хлорид марганца брать нельзя. 3. Анионы-восстановители мешают открытию ионов Mn2+, поэтому их следует предварительно удалить. 4. Умеренное нагревание способствует проведению реакции. б) Окисление персульфатом аммония (NH4)2S2О8 в присутствии нитрата серебра AgNO3 (катализатор). Возьмите лопаточкой немного персульфата аммония и поместите в пробирку, прибавьте 8 капель 2 н. раствора азотной кислоты, 2 капли раствора нитрата серебра AgNO3 и нагрейте. Затем окуните палочку в разбавленный раствор Mn2+, внесите палочку в приготовленный раствор и перемешайте. Если окраска слабая, то можно еще прибавить исследуемого раствора. Если же, наоборот, выпадает бурый осадок MnO(OH)2, то, следовательно, концентрация катиона Mn2+ слишком велика. В этом случае опыт необходимо повторить, разбавив испытуемый на катион Mn2+ раствор водой (1 капля раствора и 4 капли воды). 2MnSО4 + 5(NH4)2S2O8 + 8Н2О = 2НМnO4 + 5(NH4)2SO4 + 7H2SO4 2Mn2+ + 5S2O82- + 8Н2O = 2MnO4- + 10SO4 + 16Н+ Условия проведения опыта: 1. Реакцию проводят при рН < 2. 2. Реакция протекает в присутствии катализатора ионов Ag+. 3. Концентрация соли марганца должна быть минимальной. 4. Восстановители Cl-, Br-, I- мешают проведению реакции (хлорид марганца брать нельзя). 5. Нагревание способствует протеканию реакции. в) Окисление пероксидом водорода в щелочной среде. Налейте в пробирку 1-3 капли раствора соли марганца и прилейте 1-3 капли раствора гидроксида натрия.Образуется белфй осадок гидроксида марганца, буреющий на воздухе. Прилейте к осадку несколько капель перекиси водорода и наблюдайте образование черно-бурого осадка H2MnO3. Условия проведения опыта: 1. Реакцию проводят при рН =9-10. 2. Осаждать нужно щелочами 3. Никакие катионы не мешают этой реакции за исключением иона Со2+ Качественные реакции на ион Bi3+. Опыт 11. Гидролиз Возьмите раствор соли висмута и сильно разбавьте водой. При этом выпадает белый осадок основной соли. BiCl3 + 2Н2О= Bi(OH)2Cl + 2НС1 Образовавшаяся основная соль неустойчива, выделяет молекулу воды, образуя новую основную соль: Условия проведения опыта: 1. Реакция гидролиза лучше протекаете BiCl3, так как BiOCl менее растворим, чем BiONO3. 2. Если используется Bi(NO3)3, то необходимо к раствору добавить 2-3 капли NH4Cl. 3. Соли сурьмы мешают проведению реакции. 4. BiOCl не растворяется в винной кислоте (в отличие от SbOCl). Опыт 12. Взаимодействие с иодидом калия (KI)/ Возьмите 3-5 капель раствора соли висмута и прибавьте 1-2 капли раствора иодида калия. При этом образуется черный осадок BiI3.При избытке иодида калия осадок растворяется образуя комплексную соль висмута оранжевого цвета. Качественные реакции на ион Mg2+. Опыт 13. Реакция с раствором аммиака. Возьмите 2 пробирки и налейте в каждую 4 капли раствора соли магния, затем в 1-ую пробирку прибавьте 4 капли насыщенного раствора хлорида аммония NH4Cl. Потом в обе пробирки прилейте раствор аммиака.В первой вой пробирке осадка образовываться не будет, т.к. он растворяеся в присутствии хлорида аммония. Во второй пробирке образуется белый осадок. Опыт 14. Реакция с гидрофосфатом натрия Na2HPO4. Возьмите 3-4 капли раствора соли магния и смешайте с 4-6 каплями 2 н. раствора соляной кислоты и 3-5 каплями раствора гидрофосфата натрия Na2HPO4. После этого прибавляйте к раствору по одной капле 2 н. раствор аммиака, перемешивая раствор после каждой капли. Вначале аммиак нейтрализует прибавленную кислоту, причем образуется NH4Cl, препятствующий образованию Mg(OH)2. После окончания реакции выпадает характерный кристаллический осадок — фосфат магния-аммония MgNH4PO4. (Проведите данную реакцию на стекле и рассмотрите кристаллы в микроскоп, запишите результаты в таблицу) Условия проведения опыта: 1. Реакция проводится в аммиачной среде при рН > 8. 2. Избыток NH4Cl мешает выпадению осадка MgNH4PO4, поэтому не следует брать избыток соляной кислоты. 3. Катионы всех аналитических групп, кроме первой, могут мешать проведению реакции. Опыт 15. Реакция с магнезоном (п-нитробензолазорезорцином) 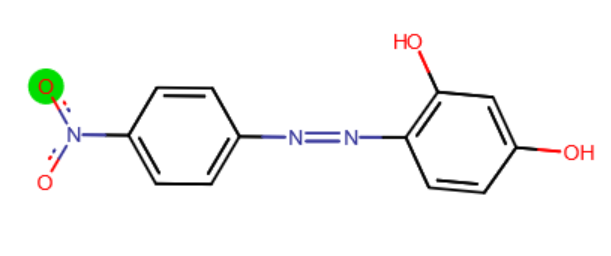 На предметное стекло поместите 1-2 капли анализируемого раствора Mg2+ и добавьте 1-2 капли магнезона и 1-2 капли раствора щелочи. Появляется синяя окраска или синий осадок. Если анализируемый раствор имеет сильнокислую реакцию, то появляется желтая окраска. В данном случае к раствору надо добавить еще несколько капель щелочи. Ход систематического анализа При систематическом ходе анализа катионов пятой группы учитываются некоторые особенности их соединений: гидролизуемость соли висмута, нерастворимость оксида марганца в разбавленной азотной кислоте, растворимость гидроксида магния в растворе хлорида аммония. К полученной пробе добавляют пятикратный объем дистиллированной воды. Образовавшийся осадок основной соли висмута фильтруют и растворяют в концентрированной хлороводородной кислоте. Катионы Bi3+ открывают реакцией с иодидом калия. Раствор, содержащий катионы Mg2+, Mn2+, Fe3+, Fe2+, обрабатывают раствором гидроксида натрия или калия, нагревают на водяной бане и фильтруют. Полученный осадок гидроксидов железа (II) и (III), марганца и магния обрабатывают раствором хлорида аммония для растворения гидроксида магния. Катионы Mg2+ обнаруживают действием магнезона I в фильтрате. Оставшийся осадок обрабатывают разбавленной азотной кислотой для растворения гидроксидов железа(II) и (III). В полученном растворе открывают катионы Fe3+с роданидом аммония и Fe2+ c реактивом Чугаева. Если после растворения гироксидов железа азотной кислотой остается бурый осадок – это свидетельствует о наличии в растворе катионов Mn2+. ? Вопросы Почему осадки гидроксидов Fe2+ и Mn2+ постепенно буреют на воздухе? Напишите уравнения соответствующих реакций. 2. Какие ионы можно обнаружить, используя явление гидролиза? Напишите уравнение реакции. 3. Какие комплексные соединения образуются при взаимодействии железа (II) и железа (III) с желтой и красной кровяной солью соответственно. Напишите уравнения реакций и тривиальные названия полученных комплексов. Вывод: в растворе №______ обнаружены катионы ______________________________________________ Оценка: ____________________(баллов)____ ____________ _____________________________ Дата Подпись преподавателя V аналитическая группа катионов Fe2+, Fe3+, Mn2+, Mg2+, Bi3+
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
