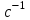студентам на удаленке. Студентам на удаленке 2021. Лабораторная работа Химический эквивалент. Определение эквивалента металла
 Скачать 155.92 Kb. Скачать 155.92 Kb.
|
|
Лабораторная работа «Химический эквивалент. Определение эквивалента металла». Цель и содержание. Ознакомление с понятием химического эквивалента вещества, методикой экспериментального определения эквивалентной массы и расчетами, связанными с законом эквивалентов. Методика и порядок выполнения работы В основе стехиометрических расчётов лежит Закон Эквивалентов: количества молей эквивалентов ( 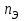 ), участвующих в реакции веществ, равны между собой. ), участвующих в реакции веществ, равны между собой. Так для двух реагирующих веществ A и B с учётом того, что 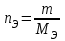 получаем: получаем: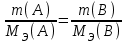 . (1) . (1)Учитывая, что при нормальных условиях 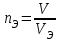 , можно составить аналогичное выражение, связывающее объёмы реагирующих газообразных веществ или комбинированную формулу, которая связывает массу одного и объём другого вещества. , можно составить аналогичное выражение, связывающее объёмы реагирующих газообразных веществ или комбинированную формулу, которая связывает массу одного и объём другого вещества.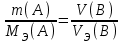 . (2) . (2)где: 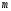 , , 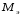 – масса и молярная масса эквивалента вещества, г и – масса и молярная масса эквивалента вещества, г и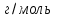 , , 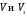 - объем и эквивалентный объем газа, л и л/моль - объем и эквивалентный объем газа, л и л/мольХимическим эквивалентом называют реальную или условную частицу вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим способом эквивалентна одному иону водорода в кислотно-основных или ионообменных реакциях или одному электрону в окислительно-восстановительных реакциях. Массу одного моля эквивалента называют молярной массой эквивалента вещества 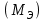 . . Формулы для вычисления эквивалентных масс простых и сложных веществ:  , , 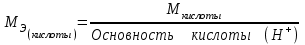 , ,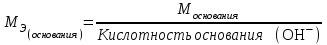 , ,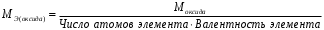 , ,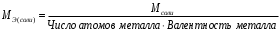 . .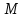 – молярная масса соединений, – молярная масса соединений, 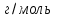 . .Эквивалентным объёмом 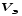 называется объём, занимаемый при данных условиях называется объём, занимаемый при данных условиях  эквивалентом вещества. Значение эквивалентного объёма вещества, находящегося в газообразном состоянии, можно найти по формуле: эквивалентом вещества. Значение эквивалентного объёма вещества, находящегося в газообразном состоянии, можно найти по формуле: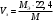 Опыт проводится в приборе, показанном на рисунке 1. 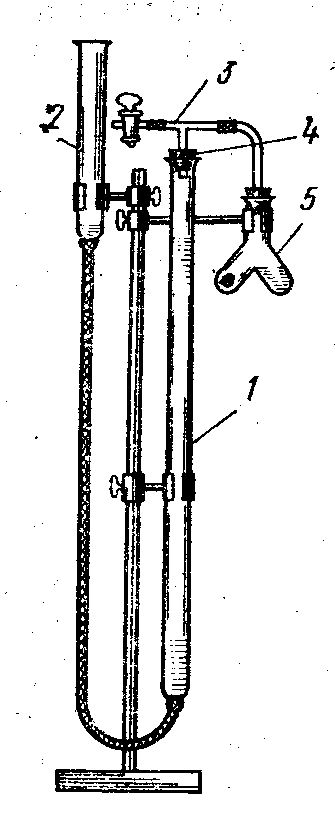 Порошок металла с известной массой, завёрнутый в фильтровальную бумагу, поместите в одно колено склянки Оствальда (5). В другое колено, с помощью пипетки налейте 10-12 мл раствора 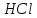 . .Осторожно укрепите склянку Оствальда в зажиме штатива и присоединить к тройнику (3), плотно закрыв пробки в бюретке и в склянке Оствальда. При открытом зажиме на тройнике доведите с помощью уравнительного сосуда (2), поднимая и опуская его, уровень воды в бюретке (1) точно до метки «0» (нижний уровень мениска воды и нулевое деление бюретки должны совпасть и быть на уровне глаза). Рисунок 1 – Прибор для определения эквивалента металла: 1- бюретка на 100 мл; 2 -уравнительный сосуд; 3 - стеклянный тройник с каучуковой трубкой и краном; 4 - каучуковая пробка; 5 - склянка Оствальда с пробкой. Не поднимая уравнительный сосуд, наклоните штатив и перелейте кислоту в колено, где находится металл. Тотчас начинается выделение водорода и вытеснение воды из бюретки в уравнительный сосуд. По окончании реакции следует подождать 10-15 мин, чтобы газ в приборе принял температуру окружающего воздуха. Определите объем выделившегося водорода. Массу металла m и объём водорода V запишите в таблицу 1. ПОСМОТРЕТЬ ОПЫТ!!! https://youtu.be/9gUztggDTMc По исходным данным в таблице 3 произведите расчеты. Таблица 1 – Исходные данные к расчёту эквивалента металла
Рассчитайте молярную массу эквивалентов металла двумя путями. Вычислите массу вытесненного водорода по уравнению Клапейрона-Менделеева:  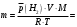 Далее вычислите 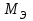 данного металла из выражения Закона Эквивалентов (1): данного металла из выражения Закона Эквивалентов (1): 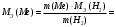 учитывая, что  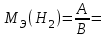 где: А – атомная масса водорода, В – валентность. Приведите объем выделившегося водорода к нормальным условиям по уравнению Клапейрона:  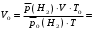 Учитывая, что To=273 К, а Po=101325 Па. Рассчитайте 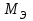 металла по выражению Закона Эквивалентов, связывающее массу металла и объём водорода при н.у. (2): металла по выражению Закона Эквивалентов, связывающее массу металла и объём водорода при н.у. (2): 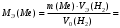 Где, эквивалентный объем водорода находится по формуле:  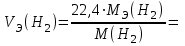 Сделайте вывод какой металл был исследован в опыте, рассчитав его атомную массу: 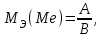 учитывая, что В(Ме) = 2, получим: 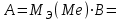 Металл исследованный в опыте - ___________________________. Лабораторная работа 2 СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ И ХИМИЧЕСКОЕ РАВНОВЕСИЕ Цель и содержание. Изучение скорости химической реакции и ее зависимости от различных факторов: природы реагирующих веществ, концентрации, температуры. Методика и порядок выполнения работы https://vk.com/video-29287308_163244886 ОПЫТ 1. Влияние концентрации реагирующих веществ на скорость реакции в гомогенной системе Взаимодействие тиосульфата натрия с серной кислотой протекает по уравнению: 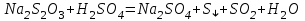 . .Приготовим три раствора тиосульфата натрия ( 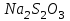 ) различной концентрации. Для этого в три сухие пробирки внесем: ) различной концентрации. Для этого в три сухие пробирки внесем:в первую – 5 капель раствора 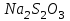 и 10 капель воды, и 10 капель воды, во вторую – 10 капель раствора 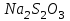 и 5 капель воды, и 5 капель воды, в третью – 15 капель раствора 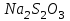 без воды. без воды. Первую и вторую пробирки осторожно встряхнем. Таким образом, концентрация 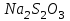 (в моль) будет: в пробирке № 1 –с, в пробирке № 2 – 2с, в пробирке № 3 – 3с. (в моль) будет: в пробирке № 1 –с, в пробирке № 2 – 2с, в пробирке № 3 – 3с.В пробирку № 1 добавим одну каплю серной кислоты ( 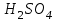 ) и одновременно включим секундомер. По секундомеру измерим время от момента добавления кислоты до появления в растворе заметной опалесценции. Также добавим по одной капле серной кислоты в пробирки № 2 и № 3; отмечая время до появления в растворе опалесценции. Данные опыта занесем в таблицу 5. ) и одновременно включим секундомер. По секундомеру измерим время от момента добавления кислоты до появления в растворе заметной опалесценции. Также добавим по одной капле серной кислоты в пробирки № 2 и № 3; отмечая время до появления в растворе опалесценции. Данные опыта занесем в таблицу 5.Таблица 5 – Зависимость скорости химической реакции от концентрации реагента.
 Постройте график зависимости скорости реакции от концентрации Постройте график зависимости скорости реакции от концентрациис 2с 3с Вывод: _______________________________________________________________ https://www.youtube.com/watch?v=z8ig_koe9q8  ОПЫТ 2. Влияние температуры на скорость реакции ОПЫТ 2. Влияние температуры на скорость реакциив гомогенной системе Чтобы выяснить, как влияет температура на скорость реакций, проведём реакцию тиосульфата натрия с серной кислотой, отмечая время её протекания секундомером, три раза: одно наблюдение выполним при комнатной температуре, второе – при температуре на 10 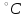 выше комнатной, третье – на 20 выше комнатной, третье – на 20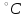 выше комнатной. выше комнатной. Для выполнения данной работы возьмём 3 пробирки с 10 каплями раствора 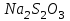 . . Сначала добавить в одну каплю серной кислоты и одновременно включить секундомер. Измерим время от момента добавления кислоты до появления заметной опалесценции. Аналогично проведём измерения со второй и третьей пробирками после их нагревания в термостате до соответствующих температур. Полученные данные занесем в таблицу 6. Таблица 6 – Зависимость скорости химической реакции от температуры
Постройте график зависимости скорости реакции от температуры   Скорость Вывод: ______________________________________________________________ _____________________________________________________________________ _____________________________________________________________________ https://www.youtube.com/watch?v=Oruq6wqu1Kw ОПЫТ 3. Влияние величины поверхности раздела реагирующих веществ на скорость реакции в гетерогенной системе Поместите в одну пробирку гранулы цинка, а в другую и примерно такое же по порошка цинка . В обе пробирки одновременно добавить одинаковое количество (10-20 капель) концентрированной 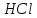 . Отметить в какой из пробирок реакция прошла быстрее (приблизительно). . Отметить в какой из пробирок реакция прошла быстрее (приблизительно).Напишите уравнение протекающнй реакции Наблюдения: ______________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ Вывод: ____________________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ https://www.youtube.com/watch?v=wmuglTWP0rA ОПЫТ 4. Влияние катализатора на скорость реакции. В две пробирки внесем по 10 капель раствора роданида калия ( 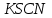 ) и по 1 капле раствора хлорида железа (III) ( ) и по 1 капле раствора хлорида железа (III) (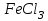 ). В результате реакции образуется роданид железа (III) ). В результате реакции образуется роданид железа (III) 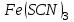 темно-красного цвета: темно-красного цвета: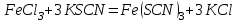 . .В одну из пробирок добавим 1 каплю раствора сульфата меди ( 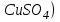 . Затем в обе пробирки внести по 3 капли тиосульфата натрия ( . Затем в обе пробирки внести по 3 капли тиосульфата натрия (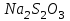 ). Наблюдать различную скорость обесцвечивания растворов, которое происходит вследствие восстановления железа (III) до железа (II) тиосульфатом натрия: ). Наблюдать различную скорость обесцвечивания растворов, которое происходит вследствие восстановления железа (III) до железа (II) тиосульфатом натрия: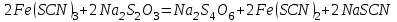 . .В какой из пробирок раствор обесцветился быстрее? Какую роль играет сульфат меди (II)? Наблюдения: ______________________________________________________ __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ Вывод: ____________________________________________________________ ОПЫТ 5. Влияние концентрации реагирующих веществ насмещение химического равновесия https://www.youtube.com/watch?v=IU46z7SwkcI Реакция хлорида железа (III) с роданидом калия ( 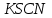 ) является обратимой: ) является обратимой: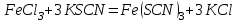 . .В результате реакции образуется роданид железа (III) 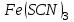 темно-красного цвета. Это позволяет рассмотреть, как влияют добавки реактивов на смещение равновесия по интенсивности окраски раствора. темно-красного цвета. Это позволяет рассмотреть, как влияют добавки реактивов на смещение равновесия по интенсивности окраски раствора.В четыре пробирки внесем по 5-7 капель разбавленных растворов 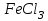 и и 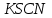 , и перемешаем. Одну пробирку с полученным раствором оставим для сравнения результатов опыта (эталон). В остальные пробирки добавим следующие реактивы: в первую – 1 каплю насыщенного раствора , и перемешаем. Одну пробирку с полученным раствором оставим для сравнения результатов опыта (эталон). В остальные пробирки добавим следующие реактивы: в первую – 1 каплю насыщенного раствора 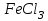 , во вторую – 1 каплю насыщенного раствора , во вторую – 1 каплю насыщенного раствора 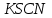 , в третью – несколько кристалликов хлорида калия. Сравните интенсивность окраски полученных растворов с интенсивностью окраски эталона. , в третью – несколько кристалликов хлорида калия. Сравните интенсивность окраски полученных растворов с интенсивностью окраски эталона.Наблюдения и выводы (вычеркните в каждом предложении ненужное слово, написанное курсивом): 1) Окраска раствора в 1-ой пробирке относительно эталона более / менее интенсивна. Равновесие сместилось вправо / влево. 2) Окраска раствора во 2-ой пробирке относительно эталона более / менее интенсивна. Равновесие сместилось вправо / влево. 3) Окраска раствора в 3-ой пробирке относительно эталона более / менее интенсивна. Равновесие сместилось вправо / влево. |

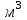
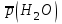 , Па
, Па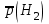 , Па
, Па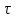 , с
, с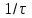 ,
,