Лабораторная работа Определение кобальта в растворе Зав кафедрой Федорова О. В. Преподаватель Кочкина Г. В
 Скачать 46.91 Kb. Скачать 46.91 Kb.
|
Кафедра ХиХТ ЛАБОРАТОРНАЯ РАБОТА «Определение кобальта в растворе» Зав. кафедрой Федорова О.В. Преподаватель Кочкина Г.В. Выполнили студенты гр. 1ХТ-20Д Сайфуллин Р.Ж. Мартюшов А.В. 2023 Введение: Определение кобальта в растворе основано на реакции окисления комплексных ионов кобальта феррицианидом калия в аммиачной среде: 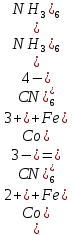 Аммиачный комплекс кобальта имеет ярко-вишнёвую окраску, интенсивность которой возрастает по мере приближения к точке эквивалентности. Данный метод является достаточно простым, точным и дает возможность определять кобальт в разбавленных и относительно концентрированных растворах ( 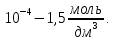 Таким образом, окислительно-восстановительное титрование показывает преимущества потенциометрической индикации конечной точки титрования по сравнению с использованием цветных индикаторов. Реакции протекают по уравнениям: Таким образом, окислительно-восстановительное титрование показывает преимущества потенциометрической индикации конечной точки титрования по сравнению с использованием цветных индикаторов. Реакции протекают по уравнениям:CoC 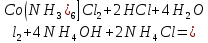 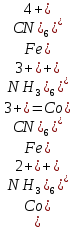 До ТЭ протекает электрохимическая реакция: 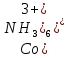 +е= +е=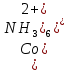 После ТЭ: 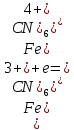 Реальные потенциалы этих реакций резко отличаются, обеспечивая большой скачок потенциала. Экспериментальная часть. 1. Приборы и реактивы: Установка для потенциометрического титрования, платиновый индикаторный электрод, хлорсеребряный электрод сравнения, бюретка вместимостью 25 мл, стандартный раствор гексацианоферрата калия-0,05 моль/ 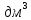 , раствор хлорида аммония 10%, раствор аммиака 25%, анализируемый раствор Co в колбе вместимостью 100 мл. , раствор хлорида аммония 10%, раствор аммиака 25%, анализируемый раствор Co в колбе вместимостью 100 мл.2. Выполнение работы: 2.1 Включили прибор в сеть и тумблер на приборе, прогреть его в течение 15-20 минут. Вытащили из отверстия хлорсеребряного электрода резиновую пробку. Заполнили бюретку стандартным раствором. 2.2 Приготовили посуду к выполнению работы 2.3 Получили анализируемый раствор 2.4 Пипеткой перенесли 20 мл полученного раствора в стакан вместимостью 100 мл, добавили 10 мл 10%-го раствора хлорида аммония и 10 мл 25%-го раствора аммиака. Полученный раствор разбавили до 70 мл. 2.5 Погрузили электроды, включили мешалку и дали прогреться иономеру. 2.6 Провели титрование пробы анализируемого раствора и замеряем ЭДС на приборе. Данные внесли в таблицы.
График Е-V(T)  Построим дифференциальную кривую, для точного определения точки эквивалентности. Таким образом, мы определили, что при добавлении 0.5 раствора из бюретки. Точка эквивалентности при объеме 3 мл. Рассчитаем концентрацию Co в титруемом растворе согласно закону эквивалентов: С1V1 = C2V2, C(Co)*20=0.05*3, С(Со)=0,0075(моль-экв/л) Найдем массу Со в растворе: m(Co)=C(Co)*V(р-ра)*М(Со)=0,0075*0,1*58,933=0,04419 г. Найдем количества вещества: n(Co)=m(Co)/M(Co)=0.04419/58.933=0.000749 моль/мл. 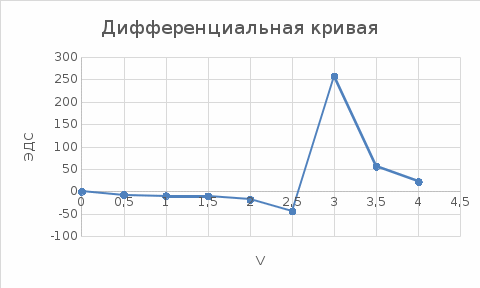 Рассчитаем более точно концентрацию, количества вещества при добавлении 0,2 титранта:
Построим График Е-V(T): 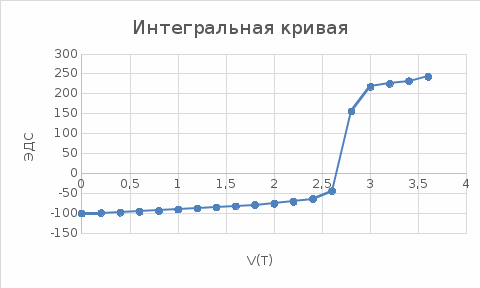 Построим дифференциальную кривую, для точного определения точки эквивалентности. 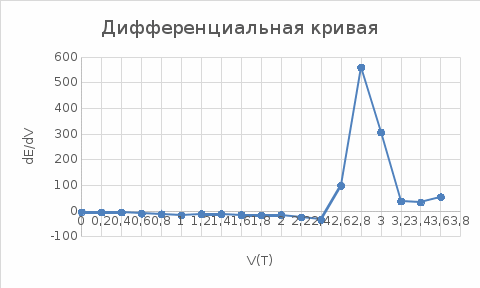 Таким образом, мы определили, что при добавлении 0.2 раствора из бюретки. Точка эквивалентности наступит при объеме 2,8 мл. Рассчитаем концентрацию Co в титруемом растворе согласно закону эквивалентов: С1V1 = C2V2, C(Co)*20=0.05*2.8, С(Со)=0,007(моль-экв/л) Найдем массу Со в растворе: m(Co)=C(Co)*V(р-ра)*М(Со)=0,007*0,1*58,933=0,04125 г. Найдем количества вещества: n(Co)=m(Co)/M(Co)=0.04125/58.933=0.00699 моль/мл. Вывод: в ходе проделанной работы, при точности добавления 0,2 мл раствора титранта: С(Со)=0,007(моль-экв/л), n(Co)=0.00699 моль/мл. Контрольные вопросы: 2. Какая зависимость выражается уравнением Нернста? Привести уравнение окислительно-восстановительной пары и пояснить смысл входящих в него величин. Зависимость величины электродного потенциала (Е) от природы металла, активности его ионов в растворе и температуры. 6. Что представляют собой электроды 1-го рода? Привести примеры. Привести уравнение Нернста для потенциала электродов 1-го рода. Электроды первого рода представляют собой систему из металла или неметалла, погруженного в раствор, содержащий его же ионы. Например Cu2+/Cu0. 9. Какие функции выполняют индикаторные электроды и какие- электроды сравнения? Какие требования к ним предъявляют? Индикаторный электрод чувствителен к изменению концентрации определяемого иона, поэтому по его потенциалу можно измерить концентрацию анализируемого компонента. Так как измерить абсолютное значение потенциала нельзя, то потенциал индикаторного электрода определяется по значению ЭДС, между индикаторным электродом и электродом сравнения. Электрод сравнениявыполняет функцию эталона. Его потенциал известен и остается постоянным на протяжении всего анализа. Индикаторный электрод должен быть обратимым, неполяризуемым, химически устойчивым по отношению к контактирующему с ним раствору. Конструкция электрода должна быть простой, а время установления равновесного потенциала минимальным. Электрод сравнения должен быть химически устойчивым, неполяризуемым , и должен иметь простую конструкцию . Потенциал электрода должен быть стабильным, легко воспроизводимым и не зависеть от состава анализируемого раствора. 18. Как устроен хлорсеребряный электрод? От чего зависит потенциал этого электрода? К какому типу он относится? Хлорсеребряный электрод представляет собой серебряную проволоку, покрытую равномерным слоем хлорида серебра, который хорошо проводит электрический ток. Потенциал этого электрода зависит от концентрации хлорид ионов. К электродам 3-го типа. 19. Составьте электролитическую ячейку для кислотно-основного и окислительно-восстановительного титрования. 36. Как влияет концентрация посторонних комплексообразующих ионов на потенциал индикаторного электрода? |
