Лаба ЗОЛОТО. Лабораторная работа Определение концентрации золота методом инверсионной вольтамперометрии на вольтамперометрическом анализаторе ста
 Скачать 26.69 Kb. Скачать 26.69 Kb.
|
|
МИНИСТЕРСТВО НАУКИ И ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное автономное образовательное учреждение высшего образования Северский технологический институт – Филиал федерального государственного автономного образовательного учреждения высшего образования «Национальный исследовательский ядерный университет «МИФИ» (СТИ НИЯУ МИФИ) Кафедра ХиТМСЭ Лабораторная работа «Определение концентрации золота методом инверсионной вольтамперометрии на вольтамперометрическом анализаторе СТА» Выполнил: студент гр. В-489 Ельчанин Ю.Ю. __________ Проверил: доцент кафедры ХиТМСЭ Агеева Л.Д._____________ Северск 2021 Теоретическая часть Методы анализа, основанные на расшифровке поляризационных кривых (вольтамперограмм), полученных в электролитической ячейке с поляризующимся индикаторным электродом и неполяризующимся электродом сравнения, называют вольтамперометрическими. Метод предложен в 1922 г. чешским электрохимиком Ярославом Гейровским и назван им полярографией. За выдающиеся заслуги в развитии теории и практики метода Я. Гейровскому в 1959 г. была присуждена Нобелевская премия. В настоящее время название полярография сохранено в память создателя метода для раздела вольтамперометрии, где индикаторным электродом служит капающий ртутный электрод. Современная вольтамперометрия – высокочувствительный и экспрессный метод определения неорганических, биохимических, медицинских, фармацевтических и других объектов. Это один из наиболее универсальных методов определения следовых количеств веществ. Для ряда элементов метод конкурентоспособен с атомно-абсорбционной спектроскопией. К другим несомненным достоинствам следует отнести возможность одновременного определения нескольких компонентов (в оптимальных условиях эксперимента до четырёх – пяти), а также то, что современный полярограф позволяет получить линейную зависимость тока от концентрации в диапазоне 10-8 – 10-2 М. Вольтамперометрия – это современный высокочувствительный физико-химический метод анализа, основанный на явлении электролиза. Электролизом называется процесс, в котором химические реакции происходят под действием электрического тока. Явление электролиза заключается в выделении веществ (газы, металлы) на электроде, в возможном растворении вещества электрода и в изменении состава электролита возле поверхности электрода. Рассмотрим наиболее простую схему такого процесса. К двум электродам, погруженным в раствор электролита, приложена внешняя разность потенциалов от какого-либо источника постоянного тока. Ионы электролита, достигая соответствующего электрода, взаимодействуют с ним, уменьшая или полностью теряя свой заряд, и превращаются в нейтральные атомы или атомные группы. Положительный электрод (анод) имеет меньшее число электронов, чем его материал в нейтральном состоянии. Поэтому анод отнимает электроны у анионов электролита, являясь окислителем. На отрицательном же электроде (катоде), обладающем избытком электронов по сравнению с нейтральным состоянием данного материала, идет процесс восстановления катионов. Оба процесса – анодное окисление и катодное восстановление, протекающие одновременно, – являются окислительно-восстановительной реакцией и составляют основу процесса электролиза. Экспериментальная часть 2.1 Лабораторная работа «Определение концентрации золота методом инверсионной вольтамперометрии на приборе СТА» Цель работы: ознакомиться с методом инверсионной вольтамперометрии, ознакомиться с работой прибора СТА, определить содержание золота в пробе на приборе СТА, пользуясь методом стандартных добавок. 2.1.1 Материалы и оборудование - вольтамперометрический анализатор «СТА»; – химические кварцевые стаканы – 3 шт; – пипетки на 1 -2 мл;– индикаторный графитовый электрод; – хлорсеребряный-электрод сравнения. 2.1.2 Подготовка электрода сравнения к работе 1) Снять корпус с электрода, рабочую поверхность серебряной проволоки обработать концентрированной азотной кислотой в течение 1-2 с. Электрод с корпусом промыть дистиллированной водой. 2) В корпус залить 0,1 моль/дм3 раствора хлористого калия, электрод вставить в корпус. Заполненные электроды выдержать не менее 2-х часов. 2.1.3 Реактивы – стандартный раствор золота 5мг/дм3; – фоновый электролит: 0,1-1м раствор HCl; – анализируемый раствор. 2.1.4 Методика выполнения лабораторной работе на приборе СТА 1) Включить компьютер; 2) включить прибор-анализатор «СТА», нажав кнопку включение. Прогрев прибора 10-20 мин; 3) налить 10 мл (0,1-1М) HCl в 1-2 стаканчика (если работа будет проходить в 3 ячейках, то 3 стаканчика), предварительно помыв их с содой; 4) стаканчики с HCl поставить в ячейки прибора; 5) вставить электроды: графитовый (индикаторный) в отсек РЭ, а хлорсеребряный в отсек ХСЭ (если хлорсеребряные электроды новые, то их предварительно необходимо подготовить к работе см п. 2.1.2); 6) опустить электроды в стаканчик, закрыть крышку; 7) на компьютере запустить программу «СТА» ; 8) нажать на кнопку «ВЫБОР» (команда «Выбор» позволяет просмотреть и выбрать конкретные методики анализа, имеющегося в Вашем распоряжении); 9) в появившемся окне выбрать методику «Au. Нанесение золотой пленки»; 10) нажать ESC; 11) провести снятие вольтамперограммы холостой пробы (или фона), т.е. 1M HCl, для этого нажать на кнопку «ФОН» (команда «ФОН»– позволяет провести полные измерения аналитического сигнала для определения исходного загрязнения системы электродов и раствора); 12) нажать кнопку «ТРАССА» (данная команда позволяет отобразить на экране все параметры «трасса» – алгоритма проведения измерений, а именно, все измерения потенциалов, приложенных между электродами и другие воздействия на раствор во время проведения анализа); 13) ввести «ТРАССу», не забыв, отключить те ячейки, в которых не будут проходить измерения согласно таблице 1. Таблица 1 – Последовательность выполнения этапов измерений с соответствующим потенциалами
14) после того как значения введены нажать кнопку ESC; 15) нажать кнопку пуск; 16) по окончанию измерения ФОНА, нажимаем последовательно кнопки «УСРЕДНЕНИЕ» «Ф» «РЕЗУЛЬТАТЫ»; 17) переписать значения тока I и потенциала для фона в таблицу 2. Таблица 2 – Экспериментальные вольтамперные характеристики пика Au в пробах
18) нажать ESC, кнопку «ВЫХОД»; 19) нажать кнопку «ПРОБА»; 20) определить концентрацию неизвестной пробы, для этого добавить в стаканчики (0,1-0,2) мл неизвестной пробы. Запись вольтамперограммы пробы проводится по той же трассе, что и снятие фона; 21) нажать кнопку «ПУСК»; 22) после измерения нажать последовательно кнопки «УСРЕДНЕНИЕ» «П» «РЕЗУЛЬТАТЫ»; 23) переписать значения тока и потенциала для пробы в таблицу 2, 24) нажать ESC, затем кнопку «ВЫХОД»; Анализ анализируемого вещества на содержание золота будет проводиться по методу стандартной добавки. Добавка – это стандартный раствор золота, т.е. раствор с известной концентрацией Au. Принять объем добавки от 0,1(0,3) мл. 25) нажать кнопку «ДОБАВКА», заходим в меню «КОЛИЧЕСТВО» и вводим значения (уточнить у преподавателя): Например: объем аликвоты (см3) – 0,1 (0,2) мл, концентрация АС (мг/дм3) – 5(10) мг/л, объем добавки АС (см3) – 0,1 мл, 26) нажать кнопку «ESC»; 27) в стаканчик ввести – 0,1 мл стандартного вещества с известной концентрацией; 28) нажать кнопку «ПУСК»; 29) после окончания измерений нажать последовательно кнопки: «УСРЕДНЕНИЕ»«Д» «РЕЗУЛЬТАТЫ»; 30) переписать значения тока и потенциала для добавки в таблицу 2. Если добавка оказалась неудачной (например: высота пика осталась на том же уровне и т.д.), вы можете повторить измерение пробы с добавкой, не проводя ещё один анализ пробы, т.к. кривая пробы осталась в памяти компьютера. При этом необходимо в таблице параметров добавки указать величины объёмов для суммарной добавки. 31) по окончании анализа получаем вольтамперограмму; 32) нажать кнопку «ВЫХОД» 33) провести расчеты согласно формуле: 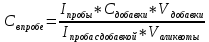 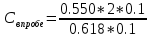 = 1.78 мг/дм3 = 1.78 мг/дм3где Iпробы – высота пика элемента на кривой пробы [A]; Сдобавки – концентрация аттестационного раствора [мг/дм3]; Vдобавки – объем добавки [cм3]; Vминерализата – объем минерализата [cм3]; Iпробы с добавкой – высота пика элемента на ВА – кривой пробы с добавкой [A]; Vаликвоты – объем аликвоты [cм3]; Mнавески – величина навески [г] или объем пробы [дм3]. Вывод. Ознакомились с методом интерсионной вольтамперометрии, определили с помощью прибора СТА содержание золота в пробе, при помощи метода стандартных добавок. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
