Лабораторная работа по химии. Важнейшие классы химических соединений. Косяк Анна Факультет нук рлм
 Скачать 302 Kb. Скачать 302 Kb.
|
|
М Г Т У и м е н и Н. Э. Б а у м а н а Лабораторная работа по химии. «Важнейшие классы химических соединений». Выполнила: Косяк АннаФакультет: НУК РЛМ Группа: БМТ2 - 12 Дата выполнения: 10. 09. 2004 Дата сдачи: 17. 09. 2004 М О С К В А2 0 0 4 1. Цель работы. Получить представление о классах химических соединений и как распознавать оксиды, соли, основания, кислоты в растворах. Освоить способы получения этих веществ и исследовать их взаимодействие между собой и другими веществами. 2. Теоретическая часть. Важнейшими классами химических соединений являются оксиды, кислоты основания и соли. Оксиды – это сложные вещества, состоящие из двух элементов, один из которых – кислород. Оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие в свою очередь делятся на основные, кислотные и амфотерные. Основными оксидами называются оксиды, которым соответствуют основания. Кислотными оксидами называются те, которым соответствуют кислоты. Амфотерными оксидами – называются те, которые в зависимости от условий проявляют основные и кислотные свойства Основания – сложные вещества, в состав которых входят ионы металлов, соединенные с одной или несколькими гидроксильными группами. Кислоты – сложные вещества, которые состоят из атомов водорода, способных замещаться на атомы металлов, и кислотных остатков. Кислоты делятся на кислородные и безкислородные. Число атомов водорода, способных свободно замещаться на металл, определяет основность кислоты: одноосновные – HBr, HClO3; двухосновные – H2SO3, H2S; трехосновные – H3PO4. Соли – сложные вещества, которые можно рассматривать как продукты замещения атомов водорода в молекулах кислот атомами металлов или как продукты замещения гидроксогрупп в молекулах гидроксидов кислотными остатками. Соли делятся на основные, кислые, средние, двойные и смешанные. Основные соли – соли, которые образуются при неполном замещении гидроксогрупп оснований кислотными остатками. Средние соли – соли, которые образуются при полном замещении атомов водорода в молекулах кислот атомами металлов. Кислые соли – соли, которые образуются при неполном замещении атомов водорода в молекулах кислот атомами металлов. 3. Практическая часть. 3. 1 Опыт 1. 1. Название эксперимента. Получение оксида магния. 2. Ход эксперимента. Стружку магния серого цвета тигельными щипцами вносим в пламя горелки. 3. Наблюдения. Через некоторое время магний вспыхивает ослепительно белым светом, цвет пламени горелки при этом ярко – красный. 4. Уравнение реакции. 2Mg + O2 = 2MgO O   02 + 4e = 2O-2 1 окислитель процесс восстановления 02 + 4e = 2O-2 1 окислитель процесс восстановленияMg0 - 2e = Mg+4 2 восстановитель процесс окисления. 5. Иллюстрационный материал  6. Вывод. При нагревания магния в присутствии кислорода воздуха получается оксид магния MgO. Причем магний вспыхивает ослепительно белым пламенем, а пламя при этом становится ярко – красным. 7. Ход эксперимента. Опускаем стружку магния с образовавшимся оксидом магния MgO в пробирку с дистиллированной водой и добавляем фенолфталеин. 8. Наблюдения. Цвет содержимого пробирки становится малиновым. Остается осадок гидроксида магния, так как он не растворим в воде. 9. Уравнение реакции. MgO + H2O = Mg(OH)2 10. Иллюстрационный материал.  11. Вывод. При реагирования оксида магния с водой получается гидроксид магния. На присутствие щелочной среды указывает окрас раствора в малиновый цвет. 3. 2 Опыт 2. 1. Название эксперимента. Получение оксида меди. 2. Ход эксперимента. Кусочек медной пластины вносим в пламя горелки и нагреваем его. 3. Наблюдения. Образуется черный налет. 4. Уравнение реакции. 2   Cu + O2 = 2CuO Cu + O2 = 2CuO Cu0 – 2e = Cu+2 2 восстановитель O20 + 4e = 2O-2 1 окислитель 5. Иллюстрационный материал   CuO 6. Вывод. При нагревании кусочка медной пластины на ней образуется черный налет. 7. Ход эксперимента. Нальем в пробирку 3 капли разбавленной соляной кислоты и опустим в нее прокаленный кусочек меди. 8. Наблюдения. Черный налет растворился, и раствор стал темно – зеленым. 9. Уравнение реакции. CuO + 2HCl = CuCl2 + H2O 10. Иллюстрационный материал.  11. Вывод. При взаимодействии оксида меди CuO с соляной кислотой HCl раствор зеленеет, получается раствор хлорида меди CuCl2. Так как оксид меди CuO растворяется в кислоте, то он является основным. 3. 3 Опыт 3. 1. Название эксперимента. Получение оксида реакцией разложения. 2. Ход эксперимента. Взять тигельными щипцами белый кусочек мела СaCO3 и прокалить его в пламени горелки 3. Наблюдения. При нагревании мел темнеет. 4. Уравнение реакции. CaCO3 → CO2 + CaO   СаО 5. Иллюстрационный материал. 6. Вывод. Мел СaCO3.при нагревании разлагается на оксид кальция СаО и углекислый газ СО2 7. Ход эксперимента. Опускаем прокаленный мел (оксид кальция СаО) в пробирку с дистиллированной водой и добавляем фенолфталеин. 8. Наблюдения. Раствор становится малиновым. 9. Уравнение реакции. CaO + H2O = Ca(OH)2 10. Иллюстрационный материал.  11. Вывод. В результате проведенного эксперимента, мы путем разложения мела СaCO3 получили оксид кальция и гидроксид кальция Са(ОН)2, на что указывает малиновый окрас полученного раствора. 3. 4 Опыт 4. 1. Название эксперимента. Получение гидроксида никеля. 2. Ход эксперимента. Вносим 2 капли раствора сульфата никеля NiSO4 в 3 ячейки капельного планшета и добавляем в каждую ячейку по 2 капли раствора гидроксида натрия NaOH. 3. Наблюдения. В ячейках образуется салатовый осадок гидроксида никеля Ni(OH)2 и раствор сульфата натрия Na2SO4. 4. Уравнение реакции. NiSO4 + 2NaOH = Ni(OH)2 ↓ + Na2SO4 5. Иллюстрационный материал.  6.Вывод. При взаимодействии солей никеля со щелочами образуется осадок гидроксида никеля. 7. Ход эксперимента. Проверим растворимость гидроксида никеля в щелочи и кислоте. Для этого сначала добавим к гидроксиду никеля Ni(OH)2 избыток гидроксид натрия NaOH, а затем соляную кислоту HCl. 8. Наблюдения. При добавлении щелочи NaOH осадок Ni(OH)2 не растворяется, но при добавлении кислоты HCl Ni(OH)2 растворяется полностью. 9. Уравнения реакций Ni(OH)2 ↓ + NaOH = реакция не идет, осадок не растворяется Ni(OH)2 ↓ + 2HCl = NiCl2 + 2H2O 10. Иллюстрационный материал.   11. Вывод. Таким образом, в результате опыта мы выяснили, что гидроксид никеля Ni(OH)2 обладает основными свойствами, так как он растворяется в кислоте и не растворяется в щелочи. 3. 5 Опыт 5. 1. Название эксперимента. Получение гидроксида алюминия. 2. Ход эксперимента. Вносим по 2 капли раствора бесцветного сульфата алюминия Al2(SO4)3 в 3 ячейки капельного планшете, затем добавляем по капле гидроксида натрия NaOH. 3. Наблюдения. Выпадает белый гелеобразный осадок.  4. Уравнение реакции. 4. Уравнение реакции.Al2(SO4)3 + 6NaOH = 2Al(OH)3 + 3Na2SO4 5. Иллюстрационный материал.  6. Вывод. При взаимодействии солей алюминия с щелочами образуется осадок гидроксида алюминия. 7. Ход эксперимента. К получившемуся раствору гидроксида алюминия Al(OH)3 добавляем в одну ячейку избыток щелочи, а в другую – соляную кислоту. 8. Наблюдения. И в одной, и в другой ячейках осадок растворяется. 9. Уравнения реакции. A   l(OH)3 + NaOH = Na[Al(OH)4] NaAlO(OH)2 + H2O NaAlO2 + 2H2O l(OH)3 + NaOH = Na[Al(OH)4] NaAlO(OH)2 + H2O NaAlO2 + 2H2Oреакция протекает во времени. Al(OH)3 + 3HCl = AlCl3 + 3H2O 10. Иллюстрационный материал.   Al(OH)3 11. Вывод. В результате проведенного нами опыта можно утверждать, что гидроксид алюминия – амфотерный, так как он растворяется и в щелочи и в кислоте. 3. 6 Опыт 6. 1. Название эксперимента. Получение гидроксида меди. 2. Ход эксперимента. В пробирку наливаем 2 капли голубого раствора сульфата меди CuSO4 и добавляем к нему 4 капли раствора гидроксида натрия NaOH. 3. Наблюдения. Выпадает голубой гелеобразный осадок. 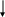 4. Уравнение реакции. 4. Уравнение реакции. 2NaOH + CuSO4 = Na2SO4 + Cu(OH)2 5. Иллюстрационный материал.  6. Вывод. При взаимодействии солей меди щелочами образуется осадок гидроксида меди. 7. Ход эксперимента. Нагреем раствор гидроксида меди Cu(OH)2. 8. Наблюдения. Цвет с голубого сменился на коричневый. При дальнейшем нагревании образуется черный осадок оксида меди. 9. Уравнение реакции. Cu(OH)2 → CuO + H2O 10. Иллюстрационный материал. tْْ  11. Вывод. При нагревании неустойчивый осадок гидроксида меди Cu(OH)2 разлагается на оксид меди CuO и выделяется вода Н2О. 3. 7 Опыт 7. 1. Название эксперимента. Получение уксусной кислоты. 2. Ход эксперимента. В пробирку помещаем небольшое количество кристаллического ацетата натрия CH3COONa и по каплям приливаем соляную кислоту HCl. 3. Наблюдения. Появляется характерный для уксусной кислоты запах. 4. Уравнение реакции. CH3COONa + HCl = NaCl + CH3OOH 5. Иллюстрационный материал. 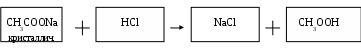 6. Вывод. В результате смешивания кристаллического ацетата натрия CH3COONa и соляной кислоты получается уксусная кислота и хлорид натрия. 3.8 Опыт 8. 1. Название эксперимента. Получение угольной кислоты. 2. Ход эксперимента. В пробирку помещаем небольшой кусочек мела CaCO3 и добавляем раствор соляной кислоты HCl. 3. Наблюдения. Выделяется большое количество газа 4. Уравнение реакции. CaCO3 + 2HCl = H2CO3 + H2O Угольная кислота практически сразу распадается на углекислый газ и на воду. H2CO3 = H2O + CO2 ↑ 5. Иллюстрационный материал.  6. Вывод. В результате смешивания карбоната кальция CaCO3 и соляной кислоты HCl образуются хлорид кальция CaCl2 и слабая угольная кислота H2CO3, которая сразу же распадается на углекислый газ CO2 и воду H2O. 3.9 Опыт 9. 1. Название эксперимента. Получение средней соли. 2. Ход эксперимента. Вносим 2 капли хлорида бария ВaCl2 в ячейку капельного планшета и добавляем 1 каплю раствора серной кислоты H2SO4. 3. Наблюдения. Выделяется белый осадок. 4. Уравнение реакции. BaCl2 + H2SO4 = BaSO4 ↓ + 2HCl 5. Иллюстрационный материал.  6. Вывод. При взаимодействии хлорида бария ВaCl2 с серной кислотой H2SO4 получилась плохо растворимая соль – сульфат бария BaSO4, которая является средней. 3. 10 Опыт 10. 1. Название эксперимента. Получение основной соли. 2. Ход эксперимента. Вносим 2 капли хлорида кобальта CоCl2 розового цвета в ячейку капельного планшета и добавляем 1 каплю гидроксида натрия NaOH. 3. Наблюдения. Выпадает голубой осадок основной соли кобальта. 4. Уравнение реакции. CoCl2 + 2NaOH = Co(OH)Cl ↓ + NaCl 5. Иллюстрационный материал.  6. Вывод. В результате взаимодействия хлорида кобальта CоCl2 и гидроксида натрия NaOH получилась основная соль гидроксохлорида кобальта Co(OH)Cl 3. 11 Опыт 11. 1. Название эксперимента. Получение кислой соли. 2. Ход эксперимента. В пробирку наливаем 3 капли насыщенного раствора гидроксида кальция Ca(OH)2 и добавляем по каплям раствор фосфорной кислоты H3PO4 до выпадения осадка. 3. Наблюдения. Выпадает осадок белого цвета. 4. Уравнение реакции. 3Сa(OH)2 + 2H3PO4 = Ca3(PO)4 ↓ + 6H2O 5. Иллюстрационный материал  6. Вывод. При взаимодействии гидроксида кальция Ca(OH)2 с фосфорной кислотой H3PO4 получается нерастворимый в воде осадок фосфата кальция Ca3PO4 . 7. Ход эксперимента. Затем добавляем избыток фосфорной кислоты H3PO4. 8. Наблюдения. Осадок растворяется, образуется кислая соль. 9. Уравнение реакции. Ca3(PO4)2 + 4H3PO4 = 3Ca(H2PO4)2 10. Иллюстрационный материал  11. Вывод. При добавлении избытка фосфорной кислоты H3PO4 осадок растворяется и получается кислая соль гидрофосфата кальция Ca(H2PO4)2. 3. 12 Опыт 12. 1. Название эксперимента. Получение комплексной соли. 2. Ход эксперимента. В пробирку наливаем 2 капли голубого раствора сульфата меди CuSO4 и добавляем 2 капли водного раствора аммиака NH4OH. 3. Наблюдения. Выделяется темно – синий гелеобразный осадок. 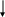 4. Уравнение реакции. 4. Уравнение реакции.2CuSO4 + 8NH4OH = (CuOH)2SO4 + (NH4)2SO4 5. Иллюстрационный материал.  6. Вывод. При взаимодействии сульфата меди CuSO4 с гидроксидом аммония NH4OH образуется осадок гидроксосульфата меди (CuOH)2SO4.)2SO4 7. Ход эксперимента. Добавляем избыток раствора аммиака NH4OH до растворения осадка (CuOH)2SO4 и образования комплексной соли. 8. Наблюдения. Цвет раствора меняется с темно – синего на синий. 9. Уравнениереакции. (CuOH)2SO4 + 8NH4OH = [Cu(NH3)4](OH)2 + [Cu(NH3)4]SO4 + 8H2O 10. Иллюстрационный материал.  11. Вывод. При добавлении избытка раствора аммиака NH4OH осадок растворяется и образуется комплексная соль. 4. Контрольная задача. Условие. Одним из компонентов топлива баллистической ракеты США «Атлас – Центавр» является вещество, при сгорании которого образуются вода и азот. В газообразном состоянии плотность этого вещества по водороду Dотн. (Н2) = 16. Расшифруйте состав горючего, ели его масса 3, 2 г дает воду массой 3, 6 г и азот объемом 2, 24 л (н. у.) (Г. Н. Фадеев, Н. Н. Двуличанская. «Решение задач». Глава 1, §1. 2, №1) Р  ешение. ешение.Дано: m(Nx Hy) = 3, 2 г M(Nx Hy) = Dотн(H2) * 2 = 16 * 2 = 32; m(H2 O) = 3, 6 г V(N2) = 2, 24 л m(H2 O) * M(H2) 3, 6 * 2 Dотн(H2) = 16 Z1 = ——————— = ————— = 0,4 г  M(H2 O) 18 M(H2 O) 18Найти: Nx Hy V(N2) * M(N2) 2, 24 * 28 Z2 = ———————— = ————— = 2,8 г Vm 22, 4 Найдем количество атомов азота и водорода в изначальном веществе: Z2 2, 8 X(N) = ————— = ———— = 0, 2 Ar(N) 14 Z1 0, 4 Y(H) = ————— = ———— = 0, 4 Ar(H) 1 X(N) : Y(H) = 1:2, а значит х = 2 и у = 4, следовательно вещество, которое является топливом баллистической ракеты США «Атлас – Центавр» это гидразин, формула которого N2H4. Ответ: Гидразин - N2H4. |
