Лекции 1-2015. ЛЕКЦИи 1-2-2015. Лекции 12 введение п л а н
 Скачать 207 Kb. Скачать 207 Kb.
|
m = Смин V· 106.Здесь m – открываемый минимум, V – исследуемый объем.Для обнаружения данного иона в растворах разной концентрации используют аналитические реакции с различным пределом обнаружения. Так, ион Cu2+ в растворах с достаточно большой концентрацией можно обнаружить по характерной голубой окраске. При разбавлении раствора интенсивность окраски уменьшается и обнаружить ион Cu2+ по этому признаку не удается. Но если к разбавленному раствору прибавить раствор аммиака, образуется амминокомплекс ярко- синего цвета, который указывает на присутствие иона Cu2+ в растворе:  Cu2+ + 4 NH4ОН [Cu (NH3)4]2+ + 4 Н2О. Cu2+ + 4 NH4ОН [Cu (NH3)4]2+ + 4 Н2О.Концентрированный предел обнаружения для этой реакции 4·10-6 г/мл. Для открытия иона Cu2+ в более разбавленных растворах следует проводить более чувствительную реакцию:  2 Cu2+ +[Fe(CN)6] 4- Cu2[Fe(CN)6]↓. 2 Cu2+ +[Fe(CN)6] 4- Cu2[Fe(CN)6]↓.красно- бурый осадок Для этой реакции концентрированный предел обнаружения 4·10-7 г/мл. Селективность и специфичность аналитических реакций. Одной из важнейших характеристик метода анализа является его селективность (избирательность) по отношению к определяемому компоненту. Химику-аналитику часто приходится анализировать смеси сложного состава. Если компоненты смеси не мешают определению исследуемого компонента, метод анализа называют селективным. Селективность метода зависит от того, какие компоненты присутствуют в образце: одни могут сильно мешать определению, другие — не мешают. Поэтому селективность зависит и от количества мешающих компонентов. Иногда мешает даже малое содержание примесей, не позволяя провести точный анализ, в других случаях - только большое, а при малом их содержании метод достаточно селективен Основное требование, предъявляемое к реакциям обнаружения – их селективность (избирательность). Селективной называют такую аналитическую реакцию, которая в условиях опыта позволяет обнаружить данное вещество (данный ион) в присутствии других компонентов раствора, не мешающих проведению этой реакции. Селективность реакции зависит в сильной степени от условий проведения реакции и от присутствия других веществ. Реакции, обладающие наиболее высокой селективностью, называют специфическими. Специфическая реакция присущая только данному иону и позволяет обнаруживать его практически при любых условиях. Такова реакция обнаружения иона NH4+.которая при действии щелочи при нагревании, сопровождается выделением аммиака: tº NH4+ + ОН--→ NH3↑ + Н2О. Специфических и даже высокоселективных реакций в аналитической химии совсем немного. Если метод недостаточно селективен, необходимо перед определением исследуемого компонента прибегать к различным методам разделения. В случаях, когда метод удовлетворяет этому требованию, уменьшается число операций анализа, что снижает затраты времени на его выполнение. 4)Скорость выполнения анализа (экспрессность) - еще одно из предъявляемых к анализу требований. Быстрое выполнение анализа снижает его себестоимость. Экспресс-методы имеют первостепенное значение для четкого контроля и своевременной коррекции производственных процессов. Они позволяют исследовать процессы, протекающие в очень короткие промежутки времени, и анализировать нестабильные продукты. Применение экспресс-методов дает наибольший эффект в сочетании с автоматизацией метода. Возможность автоматизации операций и использование ЭВМ для обработки полученных результатов одно из направлений совершенствования методов анализа. Расширение зон аналитического контроля вызвало необходимость проведения дистанционного анализа и анализа, не требующего разрушения образца. Этим требованиям должны  удовлетворять методы, применяемые для анализа космических объектов; объектов, находящихся на морских и океанских глубинах, и объектов, обладающих большой токсичностью. удовлетворять методы, применяемые для анализа космических объектов; объектов, находящихся на морских и океанских глубинах, и объектов, обладающих большой токсичностью.ЛЕКЦИЯ 2 (ПРОДОЛЖЕНИЕ) ПЛАН 1.РЕАКТИВЫ И ПРАВИЛА РАБОТЫ С НИМИ 2.МЕТОДЫ КАЧЕСТВЕННОГО АНАЛИЗА. 1.РЕАКТИВЫ И ПРАВИЛА РАБОТЫ С НИМИ Таблица 1. Классификация реактивов по содержанию основного вещества и отдельных примесей
Реактивами называют вещества, предназначенные для аналитических препаративных и иных работ в химических и других лабораториях. В лаборатории качественного анализа реактивы используют для выполнения аналитических реакций и проведения анализа. На точность результатов анализа влияет чистота реактива, ее определяют по содержанию основного компонента и примесей В учебных лабораториях чаще всего работают с неорганическими и органическими реактивами марки «х.ч.» и «ч.д.а.». В зависимости от цели анализа, метода его проведения, свойств исследуемых веществ используют реактивы в твердом, жидком и газообразном состоянии или растворы реактивов. В зависимости от свойств реактивов их растворяют в дистиллированной воде, растворах кислот, щелочей, органических растворителях. Концентрация растворов реактивов определяется условиями проведения аналитических реакций. Растворы солей для изучения реакций ионов готовят, как правило, с содержанием определяемого компонента 10 мг/мл. Различают реактивы индивидуального и общего пользования. Первые хранят в штативах для реактивов на рабочих местах учащихся. Реактивы общего пользования хранят в специальных штативах, которые помещают в отведенном для них месте или в вытяжном шкафу. Жидкие реактивы и растворы хранят в склянках, твердые - в банках, небольшое количество этих реактивов можно хранить в бюксах. В штативах реактивные склянки и банки устанавливают в определенном порядке. Они обязательно должны быть снабжены этикетками с указанием формулы или названия реактива и концентрации раствора. 2.МЕТОДЫ КАЧЕСТВЕННОГО АНАЛИЗА. ХИМИЧЕСКИЕ МЕТОДЫ КАЧЕСТВЕННОГО АНАЛИЗА А. Макро-, полумикро- и микрометоды анализа В зависимости от массы анализируемого вещества и объема растворов методы анализа делят на макро-, полумикро-, микро-, ультрамикро-, субмикро- и субультрамикрометоды (табл. 2). Соответственно различают и технику выполнения отдельных операций. Таблица 2 Классификация по массе анализируемого вещества и объему раствора,используемого при проведение химического анализа различными методами
Наиболее широкое применение в качестве анализа получил полумикрометод с элементами микроанализа. Этот метод имеет ряд преимуществ: для выполнения реакции расходуется небольшое количество анализируемого вещества и реактивов; сокращается время, затрачиваемое на выполнение анализа, за счет замены фильтрования осадков центрифугированием; резко сокращается выброс вредных газообразных веществ, тем самым улучшаются санитарно-гигиенические условия работы. Растворы реактивов и жидкие реактивы добавляют к исследуемому раствору по каплям, в строго определенном количестве, так как избыток или недостаток реактива искажает результаты анализа. Раствор реактива отбирают пипеткой, оставляя на месте реактивную склянку. Чтобы избежать загрязнения реактива, нельзя прикасаться кончиком пипетки к внутренней поверхности пробирки, в которой проводится реакция, класть пипетку на стол, опускать ее в склянку с другим реактивом, сливать в реактивную склянку оставшийся в пипетке избыток реактива. Если реактив находится в капельнице или специальной ампуле, то после отбора необходимого количества реактива их следует поставить на соответствующее место в штатив. Твердые реактивы используют в измельченном состоянии и вносят в реакционную смесь шпателем. При анализе кроме реактивов используют реактивную, индикаторную и фильтровальную бумагу, которую хранят в банках с притертыми пробками или в ящиках штативов индивидуального и общего пользования Б.КЛАССИФИКАЦИЯ ПО СПОСОБУ ВЫПОЛНЕНИЯ АНАЛИЗА сухой мокрый 1) окрашивание пламени 1) в пробирках 2) образование окрашенных 2) капельный «перлов» 3) микрокристаллоскопия При сплавлении веществ (например, в буру вводят раскаленную платиновую проволоку – охлаждают, а затем перлом анализируемого вещества судят о присут- ствии того или иного элемента. 3)метод растирания порошков. «Сухой» метод анализа При выполнении анализа «сухим» методом исследуемые вещества и реактивы находятся в твердом состоянии. Большинство подобных определений связаны с нагреванием и образуют группу пирохимических методов анализа. К ним относят метод окрашивания пламени, метод окрашивания «перлов» буры, соды и других 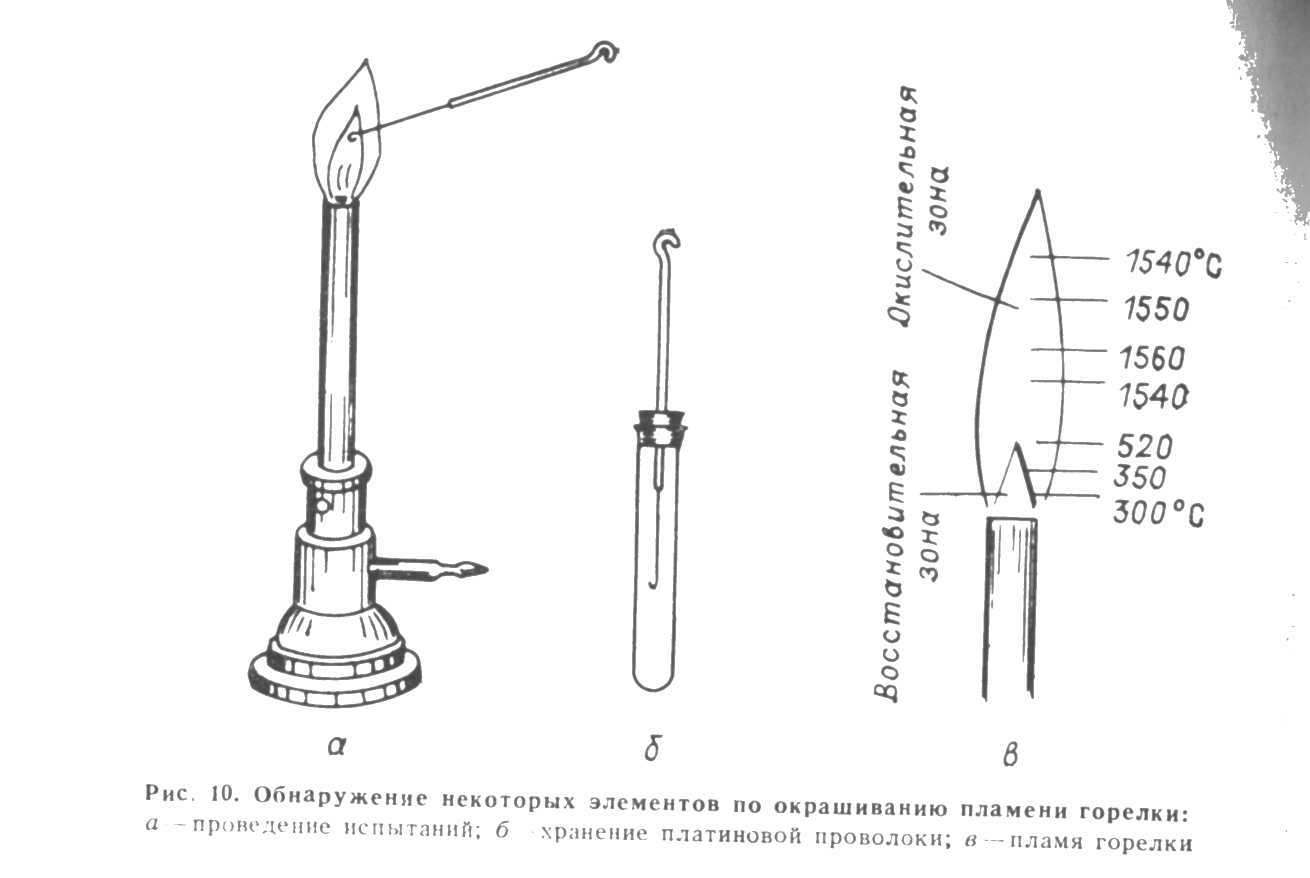 соединений, метод нагревания в калильной трубке и др. К «сухим» методам анализа относят и метод растирания порошков. Метод окрашивания пламени основан на способности некоторых элементов и их соединений (щелочные, щелочноземельные металлы, медь, бор и др.) окрашивать пламя в определенный цвет. соединений, метод нагревания в калильной трубке и др. К «сухим» методам анализа относят и метод растирания порошков. Метод окрашивания пламени основан на способности некоторых элементов и их соединений (щелочные, щелочноземельные металлы, медь, бор и др.) окрашивать пламя в определенный цвет. Например: Элемент Цвет пламени Элемент Цвет пламени Натрий Желтый Стронций Карминово- красный Калий Фиолетовый Барий Желтовато-зеленый Кальций Кирпично-красный Медь Ярко-зеленый Пробу на присутствие иона проводят с помощью тщательно очищенной платиновой или нихромовой проволочки, один конец которой вплавлен в стеклянную трубку небольшого диаметра, а другой согнут в маленькую петлю (ушко). Ушко раскаленной проволочки вводят в анализируемое вещество, а затем вносят в наиболее горячую газовой горелки (рис. 10). Хранят проволочку в пробирке с соляной кислотой. Метод образования окрашенных «перлов». Некоторые вещества при сплавлении с тетраборатом натрия Na2B4O7 - 10Н2О, «фосфатной солью» NaNH4HPO 4 * 4H2O и другими соединениями дают окрашенные стекла - «перлы». Для получения «перла» буры ушко раскаленной платиновой проволочки вводят в твердую буру, нагревают в пламени горелки до прекращения вспучивания, охлаждают и, коснувшись полученным «перлом» анализируемого вещества, вновь вводят ушко проволочки в пламя горелки, а затем охлаждают. По окраске «перла» судят о присутствии того или иного элемента Нагревание в калильной трубке позволяет анализировать вещества, способные возгоняться и разлагаться при нагревании. При полной возгонке исследуемого вещества можно предположить, что в его состав не входят нелетучие соединения. Если вещество совсем не возгоняется, в его составе отсутствуют летучие компоненты. Судить о присутствии тех или иных соединений можно по окраске возгона. Так, соли аммония, хлорид и бромид ртути, оксиды мышьяка и сурьмы дают белый возгон, сернистые соединения ртути и мышьяка, иодид ртути, сера- -желтый возгон; другие соединения ртути и мышьяка, иодиды — серый или черный возгон. Наряду с возгонкой при нагревании может происходить выделение, кипение различных газов и паров, что дает информацию о качественном составе вещества. Например, кислород выделяется, если в анализируемой пробе присутствуют перманганаты, нитраты, пероксиды и др.; оксид углерода (IV) СО2 выделяется при разложение карбонатов; оксиды азота — при разложении нитратом и нитритов; пары воды — при разложении кристаллогидратов, гидроксидов, органических соединений и т. д. Калильная трубка представляет собой пробирку из тугоплавкою стекла или кварца длиной 5—6 см, диаметром 0,5 см. Небольшое количество анализируемого вещества насыпают в трубу, медленно и осторожно нагревают в пламени горелки и наблюдают за происходящим явлением. Метод растирания порошков. Присутствие ионов того или иного элемента обнаруживают по образованию соединений с характерным цветом или запахом. Так, при растирании смеси тиоцианата аммония NH4NCS или тиоцианата калия KNCS с солями Fe3+ появляется красно-бурое окрашивание, а с солями Со2+-синее. Растирание проводят в фарфоровой ступке или на специальной фарфоровой пластинке. Все «сухие» методы анализа используют только для вспомогательных или проверочных определений. | |||||||||||||||||||||||||||||||||||||||||||||||||||
