Лекции 1-2015. ЛЕКЦИи 1-2-2015. Лекции 12 введение п л а н
 Скачать 207 Kb. Скачать 207 Kb.
|
|
ЛЕКЦИИ №1-№2 «ВВЕДЕНИЕ» П Л А Н: 1.Фармацевтический анализ и содержание предмета аналитической химии. Роль аналитической химии в системе профессиональной подготовки фармацевта. 2. История развития аналитической химии и вклад русских учёных. 3. Связь аналитической химии с другими науками. 4.Методы химического анализа. 5. Требования к анализу веществ. Литература: В.Д. Пономарёв «Аналитическая химия» 1983год 3-13,84-92 А.А. Ищенко «Аналитическая химия» 2004 год стр 5-11. 72-77 1.ФАРМАЦЕВТИЧЕСКИЙ АНАЛИЗ И СОДЕРЖАНИЕ ПРЕДМЕТА АНАЛИТИЧЕСКАЯ ХИМИЯ. Роль аналитической химии в системе профессиональной подготовки фармацевта. ФАРМАЦЕВТИЧЕСКИЙ АНАЛИЗ — это наука о химической характеристике и измерении биологически активных веществ на всех этапах производства: от контроля сырья до оценки качества полученного лекарственного вещества, изучения его стабильности, установления сроков годности и стандартизации готовой лекарственной формы. Фармацевтический анализ имеет свои специфические особенности, отличающие его от других видов анализа. Особенности фарманализа 1)Анализу подвергаются вещества различной химической природы ( неорганические, элементорганические, радиоактивные, органические соединения) - от простых алифатических УВ до сложных природных биологически активных веществ. 2)Чрезвычайно широк диапазон концентраций анализируемых веществ. 3)Объектами фармацевтического анализа являются не только индивидуальные лекарственные вещества, но и смеси, содержащие различное число компонентов. 4)Количество лекарственных средств с каждым годом увеличивается. Это вызывает необходимость разработки новых способов анализа. Способы фармацевтического анализа нуждаются в систематическом совершенствовании в связи с непрерывным повышением требований к качеству лекарственных средств, причем растут требования как к степени чистоты лекарственных веществ, так и к определению количественного содержания. Поэтому необходимо широкое использование не только химических, но и более чувствительных физико-химических методов для оценки качества лекарств. К фармацевтическому анализу предъявляют высокие требования. Он должен быть достаточно специфичен и чувствителен, точен по отношению к нормативам, обусловленным ГФ XI, ВФС, ФС и другой НТД, должен выполняться в короткие промежутки времени с использованием минимальных количеств испытуемых лекарственных препаратов и реактивов. Фармацевтический анализ в зависимости от поставленных задач включает различные формы контроля качества лекарств: фармакопейный анализ, постадийный контроль производства лекарственных средств, анализ лекарственных форм индивидуального изготовления, экспресс-анализ в условиях аптеки и биофармацевтический анализ. Составной частью фармацевтического анализа является фармакопейный анализ. Он представляет собой совокупность способов исследования лекарственных препаратов и лекарственных форм, изложенных в Государственной фармакопее или другой нормативно-технической документации (ВФС, ФС). На основании результатов, полученных при выполнении фармакопейного анализа, делается заключение о соответствии лекарственного средства требованиям ГФ или другой нормативно-технической документации. При отклонении от этих требований лекарство к применению не допускают. Заключение о качестве лекарственного средства можно сделать только на основании анализа пробы (выборки). Порядок ее отбора указан либо в частной статье, либо в общей статье ГФ XI (вып. 2). Выполнение фармакопейного анализа позволяет установить а) подлинность лекарственного средства, б) его чистоту, в) определить количественное содержание фармакологически активного вещества или ингредиентов, входящих в состав лекарственной формы. Несмотря на то, что каждый из этих этапов имеет свою конкретную цель, их нельзя рассматривать изолированно. Они взаимосвязаны и взаимно дополняют друг друга. Так, например, температура плавления, растворимость, рН среды водного раствора и т.д. являются критериями как подлинности, так и чистоты лекарственного вещества. Необходимость внутриаптечного контроля обусловлена высокими требованиями к качеству лекарственных форм, изготавливаемых в аптеках. Поскольку изготовление лекарств в аптеках ограничивается сжатыми сроками, оценку их качества осуществляют экспресс-методами Основные требования, предъявляемые к экспресс-анализу: — 1. расход минимальных количеств лекарственных форм, 2.простота и быстрота выполнения, 3.достаточная точность и возможность проведения анализа без изъятия приготовленного лекарства. В настоящее время в аптеках широко используют различные методы как качественного, так и количественного экспресс-анализа. Для этого применяют различные физические,химические и физико-химические методы. Все вещества и материалы характеризуются химическим составом и структурой. Различают качественный и количественный состав вещества. Качественный состав дает сведения о присутствии элементов, функциональных групп и других частей в веществах, а также индивидуальных соединений в различных материалах. Количественным составом называют количество отдельных частей в материалах или в веществах количество может выражаться в виде доли (%, моль\дм3 и т. д.) Содержание части в веществах или материале, либо в виде количества атомов, функциональных групп в молекуле веществ. Структура описывает пространственные расположения составных частей вещества. Функциональной группой называется часть вещества, включаемую как правило-несколько атомов элементов и обладающую химическими свойствами, например: сложные ионы ЅО42-,ŃО3-,РО43-, группировки: - СООН,-ОН Вещества: индивидуальные соединения, существующие в свободном состоянии и имеющие определенный химический состав. Вещества могут быть простыми – состоять из атомов одного элемента (например, кислород) и сложными – включать атомы нескольких элементов (СО2- углерода и кислорода). Материалами называются природные или искусственные смеси нескольких веществ технического или другого назначения. Материалами является древесина, уголь, цемент, сложные лекарства и другие. Качество веществ и материалов. Возможность использования материалов для тех или иных целей определяется их качество – прочность, устойчивость определенным биологическим действием, способностью выдерживать высокие температуры и т. д. Качество вещей и материалов зависит от их химического состава. Параметры качества задаются специальными документами – Государственными стандартами(ГОСТ), техническими условиями(ТУ). В фармации качество лекарств нормируется Государственной фармакопеей ГФ, имеющей законодательный характер. Фармакопейные статьи ФС разработаны и утверждены на все лекарственные препараты и лекарства, выпускаемые фармацевтической промышленностью, и в них изложены требования к химическому составу лекарств и методам его определения. Определение состава веществ и материалов является одной из основных операций оценки их качества. Химический анализ. Определение состава вещества и материала проводят с помощью химического анализа, в этапы которого входят: отбор проб вещества и материалов на анализ, подготовка проб веществ и материалов для анализа, подготовка проб к проведению анализа (включая разделенных смесей) проведение анализа, расчет результатов определение соответствия полученных результатов требованиям нормативных документов. Наука аналитическая химия разрабатывает теорию, общие методы и частные методики химического анализа, необходимые для оценки качества различных объектов (в т.ч. фармацевтической продукции). Задачи качественного анализа. Качественный анализ предназначен для исследования качественного состава вещества. Проводят его с помощью химических качественных реакций – реакций обнаружения или по физическим свойствам анализируемых веществ. Задачи количественного анализа. Определение количественного содержания отдельных частей в веществах и материалах проводят методами количественного анализа. Задачи структурного анализа. Структурный анализ направлен на изучение структуры химических соединений. Структурный анализ проводят, изучая различные физические и химические свойства веществ – оптические спектры, угол преломления, диэлектропроницаемость и др. Идентификация веществ. Вещества идентифицируют по данным качественного и количественного анализа и физическим константам. Методы химического анализа. Химический анализ осуществляется с помощью химических, инструментальных и биологических методов. Химические методы (классические)– используют химическую взаимосвязь строения и свойств веществ. Проводят химические реакции между веществом и реагентом ,( иногда с катализатором). Аналитический эффект (визуальный) – образование осадков, окрашенных соединений, газов с различным запахом. Инструментальные методы анализа Называются методы, использующие специальные аналитические приборы, позволяющие измерить физические свойства веществ(которые зависят или определяются химическим составом и строением). Инструментальные методы делятся на физические и физико-химические методы. В физических методах измеряют физические свойства вещества. Качественный анализ- например - снятие спектров поглощения и др. свойства. При количественном анализе физическими методами измеряют интенсивность физических свойств веществ, которые зависят от их количества. Физико-химические методы объединяют физические и химические процессы. В этих методах проводят химические реакции с веществом и результат реакции наблюдают инструментальным путем. Биологические методы. Многие методики обнаружения и определения веществ основаны на использовании их биологических свойств, например, способности подавлять рост и развития микроорганизмов (антибактериальная), переваривать животные ткани (ферментативная) и т. д. 2.КРАТКИЙ ИСТОРИЧЕСКИЙ ОЧЕРК. ВКЛАД РУССКИХ УЧЕНЫХ Уже в древние века появились некоторые зачатия химического и другого анализа. Одним из основателей физического анализа можно считать великого ученого древности Архимеда, сумевшего с помощью открытого им закона определить качество драгоценных металлов. Возникновение и развитие отдельных методов анализа было связано с необходимостью распознавания материалов, которые использовались в первых химических производствах (керамике, металлургии, получении лекарственных препаратов, парфюмерии). Анализ зародился в виде «пробирного искусства» и был тесно связан с производственной деятельностью человека и товарообращением. По существу анализ представлял собой уменьшенную копию производства. Целью анализа была проверка возможности получения нужного продукта из небольших количеств сырья при определенных условиях. Для раннего периода развития аналитической химии характерно составление разрозненных практических указаний к проведению отдельных приемов анализа. Первым успехом аналитической химии можно считать то, что научились выделять и различать отдельные металлы (золото, серебро, медь, железо, олово), кислоты и щелочи. В алхимический период развития химии зародились и чисто химические методы анализа в XIII веке было установлено, что «крепкая водка» (азотная кислота) растворяет серебро и не растворяет золото, а «царская водка» (смесь азотной и соляной кислот) растворяет и золото. Основателем аналитической химии как науки считают Р. Бойля (1627-1691). Он первый (1661 г.) ввел понятие о химическом элементе как неразложимой далее составной части вещества, из которой образуются химические соединения и смеси. Разложение веществ на элементы Бойль назвал анализом. Он разработал основы «мокрого» метода, заложив начала качественного анализа; ввел термин «химический анализ» для обозначения химических реакций, используемых для идентификации различных веществ; привел в систему известные до него качественные реакции и предложил ряд новых; впервые применил лакмус и другие природные красители в качестве индикаторов. Первые научные труды в разработке теории и практики химического анализа в России связаны с именем М. В. Ломоносова (1711-1765). Он внес большой вклад в становление атомно-молекулярной теории, именно ему принадлежит первое определение элементарных частиц-корпускул. Сформулировав в 1748 году закон сохранения материи.    Один из основателей Русского химического общества Н. А. Меншуткин (1842-1907)-автор учебного руководства по качественному и количественному анализу «Аналитическая химия», которое было издано в России в 1871 году. В учебнике курс аналитической химии был представлен как система знаний, опирающихся на важнейшие достижения теоретической химии. Учебник выдержал 16 изданий и был переведен на многие иностранные языки. Один из основателей Русского химического общества Н. А. Меншуткин (1842-1907)-автор учебного руководства по качественному и количественному анализу «Аналитическая химия», которое было издано в России в 1871 году. В учебнике курс аналитической химии был представлен как система знаний, опирающихся на важнейшие достижения теоретической химии. Учебник выдержал 16 изданий и был переведен на многие иностранные языки.В XX веке появляются новые методы химического анализа. Многие из них основаны на измерении различных физических величин и поэтому получили название физико-химических. Так, использование электрохимических явлений привело к появлению различных электрохимических методов анализа. Работы В.Нернста (1864-1941), создавшего теорию гальванического элемента, способствовали появлению потенциометрического метода анализа. Одним из методов ионометрии является рН-метрия, в развитие теории и практики которой большой вклад внесли ленинградские химик Б. П. Никольский и М. М. Шульц. Чешский химик Я. Гейровский (1890-1967) разработал в 1925 году полярографический анализ, большой вклад в развитие которого внесли советские ученые А. Н. Фрумкин и И. П Алимарин. Развиваются и другие электрохимические методы: кулонометрия и кондуктометрия. В настоящее время широко распространены спектральные методы анализа, начало которым положили работы Б. Бунзена (1811-1904) и Кирхгофа (1804 - 1887). Применение получили спектрофотометрические методы анализа: атомно-абсорбционная спектроскопия, разработанна австралийским ученым А. Уолшем в 1955 году, эмиссионный спектральный анализ, рентгеноспектральный микроанализ. Успешно используется люминесцентный анализ, развитию которого способствовали работы С. И. Вавилова и его школы. 3.СВЯЗЬ АНАЛИТИЧЕСКОЙ ХИМИИ С ДРУГИМИ ДИСЦИПЛИНАМИ Аналитическая химия тесно связана и с другими точными науками. Связь ее с физикой выражается во все большем развитии физических методов анализа, в основе которых лежат процессы, связанные со строением электронной оболочки и ядра атома. Постоянна и все более укрепляется связь аналитической химии с математикой. Результаты анализа часто выражаются в виде математических функций (кривые титрования, градуировочные графики). Оценку метрологических характеристик аналитических методов, точности результатов анализа, выявление погрешностей определения проводят на основе методов математической статистики. В последние годы для решения аналитических задач применяют теорию информатики, математические методы планирования и оптимизации эксперимента. Аналитическая химия тесно связана с техникой и приборостроением, так как совершенствование методов анализа направлено на все более широкое использование инструментальных методов. В практике анализа большие преимущества имеет комбинация аналитического прибора с ЭВМ малой и средней мощности. Большие ЭВМ используют аналитики-исследователи при расшифровке молекулярных структур сложных соединений, расчете сложных ионных равновесий, нахождении оптимальных условий осуществления метода и др. ЛЕКЦИЯ №2 4. ХИМИЧЕСКОГО МЕТОДЫ ХИМИЧЕСКОГО АНАЛИЗА 4.1. АНАЛИТИЧЕСКИЕ СВОЙСТВА ВЕЩЕСТВА. АНАЛИТИЧЕСКИЕ РЕАКЦИИ. Свойства веществ, их составные частей ,с помощью которых проводят анализ, называют аналитическими. Аналитические свойства могут быть характерными, присущими только одному или небольшой группе веществ, например, (сине-голубой цвет меди II сульфата пентагидрата) и нехарактерные, присущие многим веществам (белый цвет и так далее). Если вещество или его составные части не имеют характерных аналитических свойств, проводят химические реакции для получения продукта обладающие аналитическими свойствами. Такие реакции называют аналитическими, а результат реакции – аналитическим эффектом. Аналитическими эффектами реакции могут быть образование цветных соединений, выделение газов, появление осадков. Аналитические реакции должны протекать достаточно полно(как правило,необратимо!!), быть чувствительными и специфичными. 4.1.1.РЕАКЦИИ РАЗДЕЛЕНИЯ И ОБНАРУЖЕНИЯ. В качественном анализе реакции подразделяют на реакции разделения (отделения) и обнаружения (открытия). Реакции разделения должны практически полностью отделять одни компоненты (ионы) от других. для этих целей чаще используют реакции осаждения(обменные), реже – реакции комплексообразования, окисления- восстановления. К реакциям разделения относят групповые реакции, в которых с аналитическими реагентами в данных условиях взаимодействует целая группа компонентов (ионов). Так, при действии H2S в соляно кислой среде осаждаются в виде сульфидов катионы Cu2+, Cd2+, Bi3+, Sn2+, Sn(IV), Sb(III), Sb (V), Hg2+, As(III), As (V). Реагент, с помощью которого осуществляют групповую реакцию, называют групповым (H2S). Реакции обнаружения должны сопровождаться легко наблюдаемыми аналитическими признаками (внешними признаками): изменением окраски раствора, выпадением или растворением осадка, выделением газа. При этом заключение о наличии или отсутствии определяемого иона делают не только по появлению или отсутствию осадка, но и по его цвету, структуре (кристаллический, аморфный), форме кристаллов (если реакция выполняется микрокристаллоскопическим способом). При выделении газа во внимание принимаются также свойства этого газа – запах, цвет, способность к химическим взаимодействиям. 4.1.2.УСЛОВИЯ ПРОВЕДЕНИЯ РЕАКЦИЙ 1) среда раствора 2) температурный режим 3) концентрация. Условия выполнения аналитических реакций. Под оптимальными условиями проведения реакции понимают определенную среду раствора, температуру, концентрацию определяемого иона и реактива. Рассмотрим влияние каждого из этих факторов подробнее. Среда раствора. Необходимая для проведения реакции оптимальная кислотно- основная среда раствора зависит от свойств исследуемого вещества (иона), реактива и продукта реакции, по образованию которого делают вывод о наличии или отсутствии данного иона. Например, ион Са2+ может быть открыт оксалатом аммония (NH4)2C2О4: Са2+ + С2О42- = СаС2О4-↓ белый осадок Однако осадок СаС2О4 растворим в сильных, но нерастворим в слабых кислотах: СаС2О4 + 2Н+ = Са2+ + Н2С2О4. Поэтому открывать ион Са2+ этим реактивом можно в слабокислой или нейтральной среде. Ион Fe3+ нельзя открывать гексацианоферратом (II) калия К4[Fe(CN)6] в щелочной среде, так как вместо осадка «берлинской лазури» Fe4[Fe(CN)6]3 выпадает менее растворимый красно-бурый осадок гидроксида железа (III) Fe(ОН)3: 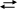 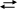 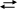 Fe3+ + 3ОН- Fe(ОН)3↓ Fe3+ + 3ОН- Fe(ОН)3↓красно-бурый аморфный осадок Температурный режим реакции выбирают таким образом, чтобы получить нужный эффект. Осадки, растворимость которых значительно возрастает с повышением температуры, можно получить только при комнатной температуре или « на холоду». Так, реактивом на ион К+ является гидротартрат натрия NaHC4H4O6: 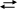 К+ + HC4H4O6- КHC4H4O6-↓ К+ + HC4H4O6- КHC4H4O6-↓белый кристаллический осадок Растворимость этого соединения достаточно большая, поэтому реакцию следует проводить на холоду. Специфическая реакция на ион NН4+ - действие щелочей при нагревании: t 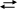 NН4+ + ОН- NН3↑ + Н2О. NН4+ + ОН- NН3↑ + Н2О.Признак наличия иона NН4+ – выделение аммиака, образующегося при разложении гидроксида аммония NН4ОН, что происходит при нагревании. Концентрация определяемого иона и реактива – очень важное условие протекания тех реакций, которые сопровождаются образованием осадка. Концентрация ионов в растворе должна быть достаточно высока, так как осадок образуется лишь в том случае, когда раствор пересыщен относительно этих ионов. Соблюдение этого условия особенно важно при осаждении соединений с большим значением ПР (т.е. высоким пределом обнаружения). 5.ТРЕБОВАНИЯ, ПРЕДЪЯВЛЯЕМЫЕ К АНАЛИЗУ ВЕЩЕСТВ Основные характеристики методов химического анализа - это их1) точность, 2)предел обнаружения, 3)селективность, 4)экспрессность, 5)экономичность. Известно, что любой анализ проводят с определенной погрешностью, поэтому результат не может быть абсолютно точным. Точность анализа должна соответствовать поставленной задаче. Точность анализахарактеризуется воспроизводимостью и правильностью результата. Результаты анализа должны совпадать между собой при повторении анализа. Совпадение результатов в пределах допустимых погрешностей характеризует воспроизводимость метода анализа. Необходимо также, чтобы результат анализа был правильным, т. е. отличался от истинного значения не более, чем это позволяют возможности метода и требования, предъявляемые к анализу. Для проверки правильности получаемых результатов часто применяют стандартные образцы. Это образцы, состав которых типи-чен для данного класса анализируемых материалов и содержание определяемого компонента в которых точно известно. Если при анализе стандартного образца применяемый метод дает правильные результаты, можно считать, что правильные результаты получаются и при анализе исследуемою объекта. Увеличение точности анализа -одна из основных задач химического анализа. Постоянно повышаются требования к пределу обнаружения метода. 2)Предел обнаружения это- наименьшее содержание вещества, при котором его можно определить данным методом с достаточной точностью. Снижение предела обнаружения имеет большое значение для анализа микропроб и микропримесей. Необходимость анализировать особо чистые вещества потребовала снизить предел обнаружения элементов в 100-1000 и более раз. Определение содержания порядка 10- 6 % (по массе) и менее стало повседневной потребностью многих отраслей промышленности, так как содержание примесей на том уровне определяет качество продукции. Предел обнаружения. Концентрация открываемых ионов в исследуемом растворе может колебаться в значительных пределах, часто эта концентрация бывает очень мала. Поэтому выбранная аналитическая реакция обнаружения имеет определенный предел обнаружения. Под пределом обнаружения понимают такое наименьшее содержание определяемого компонента (иона), при котором можно обнаружить его присутствие данной реакцией с достаточной достоверностью. Различают предел обнаружения по содержанию вещества и предел обнаружения по концентрации вещества в растворе (концентрированный предел обнаружения). При проведении анализа в растворах концентрированный предел обнаружения представляет собой наименьшую концентрацию Смин, при которой определенный ион может быть обнаружен данной реакцией. Выражают Смин в граммах на миллилитры. Реакции с низким пределом обнаружения характеризуются Смин = 10-7 – 10-8г/мл. Иногда применяют понятие обнаруживаемый (открываемый) минимум. Это масса обнаруживаемого компонента (иона), содержащего в объеме раствора, в котором с помощью данной реакции проводят обнаружение при условии, что концентрация этого иона в растворе равна Смин (г/мл): Обнаруживаемый минимум удобно выражать в микрограммах. Тогда |
