Аналитическая химия. 22.01.2022 5 пара Лекция. Лекции отправляем в группу WhatsApp бх231
 Скачать 21.44 Kb. Скачать 21.44 Kb.
|
|
Уважаемы студенты, изучите и законспектируйте лекцию, дайте ответ на вопросы в конце лекции. Обратная связь: Все вопросы по лекции отправляем в группу WhatsApp БХ2-31 Конспект и ответы на тест отправляем Кашленко И.В. в WhatsApp (вы фотографируете конспект и ответы на вопросы, если что-то отсутствует, оценка снижается). Лекция 3. Состояние идеального газа. Газы распространены в природе и находят широкое применение в технике. Их используют в качестве топлива, теплоносителей, сырья для химической промышленности, рабочего тела для выполнения механической работы (газовые турбины); газы являются физической средой для осуществления газового разряда в трубках, их используют при сварке и резке металлов, при газовой химико-термической обработке металлических поверхностей. В физической химии часто употребляют термин «идеальный» и «реальный» газ. Идеальным газом – называется газ, находящийся в таких условиях, при которых можно пренебречь силами взаимодействия между молекулами и собственным объемом молекул, который чрезвычайно мал по сравнению с общим объемом газа. В газах, реально существующих в природе (в реальных газах), сравнительно небольшие по величине силы межмолекулярного притяжения (силы сцепления) и отталкивания проявляются в большей или меньшей степени в зависимости от температуры и давления. Молекулы реальных газов обладают (хотя и очень малым) собственным объемом, который наряду с проявляющимися межмолекулярными силами сцепления и отталкивания необходимо учитывать при различного рода расчетах. С повышением температуры газа расширяются, расстояние между молекулами увеличиваются, а молекулярные силы взаимодействия ослабевают. В условиях высоких температур и низких давлений можно не принимать во внимание ничтожно малые величины сил притяжения и отталкивания и не учитывать весьма малый (по сравнению с общим объемом газа) собственный объем молекул. Подобное состояние идеального газа приближается к идеальному газу. Таким образом идеальный газ является предельным состоянием любого вещества при достаточно высокой температуре и низком давлении. Идеальный газ – это газ, состояние которого описывается уравнением Клапейрона-Менделеева: 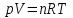 (2.1), (2.1),Где, p – давление газа; V – объем; R – универсальная (молярная) газовая постоянная – 8,314; Т – абсолютная температура; n – число молей газа. Уравнение состояния идеального газа широко применяется для вычисления параметров состояния газов, а также при опытном определении молекулярных масс газообразных (парообразных) веществ на основе измерения газа. Законы идеальных газов чрезвычайно просты. Первоначально они были установлены опытным путем. Теоретическое истолкование и обоснование этих законов было дано позже на основание молекулярно-кинетической теории. В основе молекулярно-кинетической теории газов лежат следующие допущения: 1. молекулы газа представляют собой маленькие упругие шарики, постоянно находящиеся в состоянии хаотического поступательного движения (тепловое движение); 2. объем самих молекул чрезвычайно мал по сравнению с общим объемом газа, поэтому молекулы рассматривают как материальные точки, обладающие массой m; 3. от столкновения до столкновения молекулы газа друг на друга не действуют и движутся прямолинейно (имеется в виду идеальный газ); 4. при данной температуре все молекулы движутся с некоторой постоянной (средней) скоростью. При повышении температуры средняя скорость движения молекул возрастает; 5. столкновения молекул друг с другом подчиняются закону соударения упругих шаров, а именно после столкновения (при постоянной температуре) изменяется направление движения молекул, а величина их скорости остается прежней. Следовательно, при упругих столкновениях молекул обмен энергией между ними не происходит. В действительности движение и столкновение молекул газа друг с другом и со стенками сосуда протекают гораздо сложнее. Вследствие того, что столкновения частиц не вполне упруги, отдельная молекула в разные моменты времени имеет самые разнообразные скорости как по направлению, так и по величине. По этой причине невозможно описать движение отдельной молекулы. Однако при огромном количестве молекул в данном объеме газа и беспорядочности их движения становится возможным применение законов теории вероятности. При выводе законов идеальных газов не учитывались силы межмолекулярного взаимодействия и объем самих молекул. Так как молекулы реальных газов имеют собственный определенный объем и характер взаимодействия между ними более сложный, чем для упругих шаров, то реальные газы не могут точно следовать законам идеальных газов. Отклонения становятся тем больше, чем плотность газа (выше давление и ниже температура) и масса его частиц (сильнее проявляется взаимодействие между частицами газа). Поведение реальных газов при средних давлениях характеризует уравнение состояния, предложенное Ван-дер-Ваальсом. Ван-дер-Ваальс ввел две поправки: рˊ (величина, характеризующая силы межмолекулярного притяжения) и b (поправка на собственный объем молекул газа). Поскольку силы притяжения действуют в одном и том же направлении с внешним давлением и стремятся как бы дополнительно сжать газ, то поправка рˊ (внутреннее давление газа) в уравнении имеет знак «плюс». Величину объема самих молекул необходимо вычесть из общего объема газа. Как показал Ван-дер-Ваальс, поправка b равна учетверенному объему молекул и представляет собой тот предельный объем, до которого можно сжимать газ. Дальнейшее сближение молекул невозможно, так как этому начинают препятствовать возникающие огромные силы электростатического отталкивания. Таким образом, b учитывает как собственный объем молекул, так и силы отталкивания между ними при малых расстояниях. Вопросы для самоконтроля: 1. В чем разница «идеального» и «реального» газа? 2. Что происходит в газе с повышением температуры? 3. Что объясняет молекулярно-кинетическая теория? 4. При выводе законов идеальных газов что не учитывается? |
