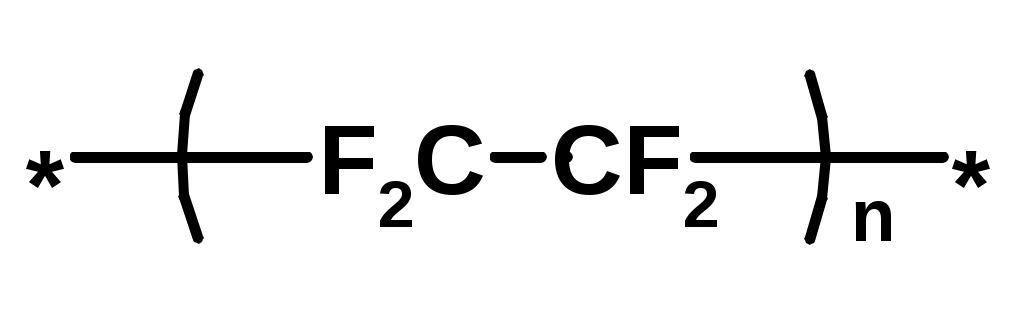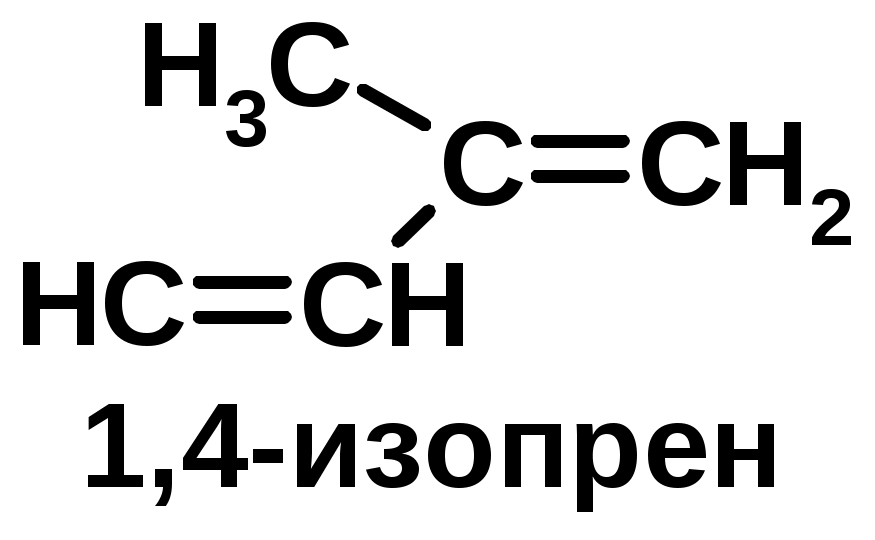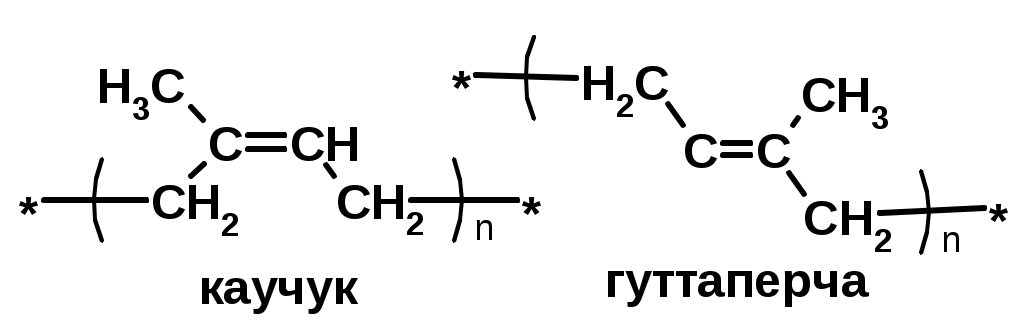Лекции по органической химии. Лекции по органической химии
 Скачать 0.99 Mb. Скачать 0.99 Mb.
|
|
Лекции по органической химии. Основным элементом, входящим в состав органических соединений, является углерод. Поэтому А.М. Бутлеров определил органическую химию как химию соединений углерода. Однако существуют простые вещества, содержащие углерод (СО; СО2; СS2, соли синильной кислоты и др.), которые относят к неорганическим соединениям и изучают в курсе общей или неорганической химии. Учитывая это, более точно органическую химию следует определять как химию углеводородов и их производных, в состав которых могут входить почти все элементы периодической системы. Реакция замещения (галогенирование) 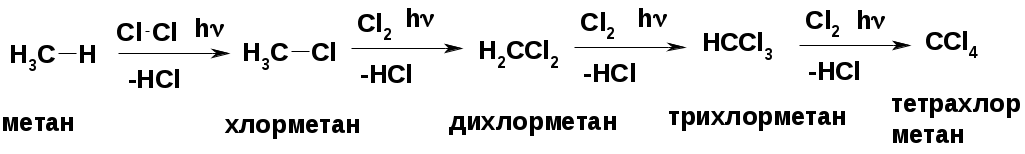 Механизм реакции 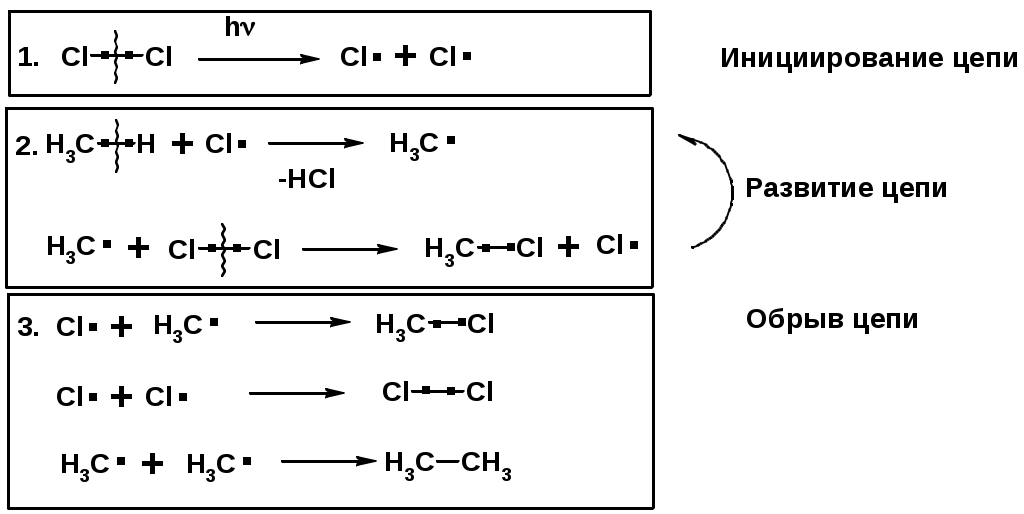 Сульфохлорирование 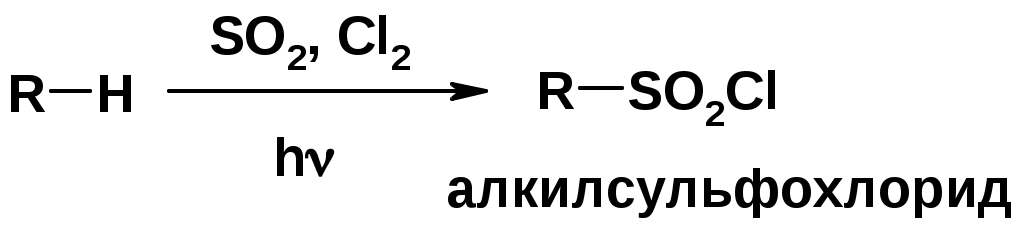 Cульфоокисление 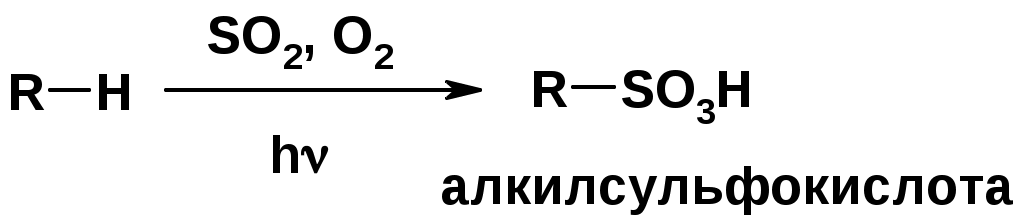 Нитрование 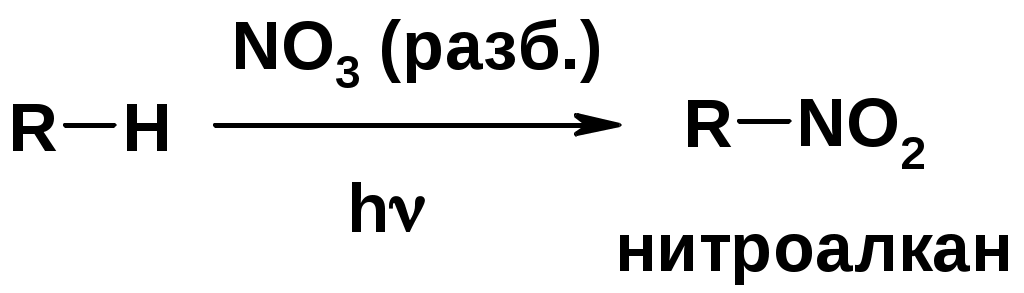 Горение 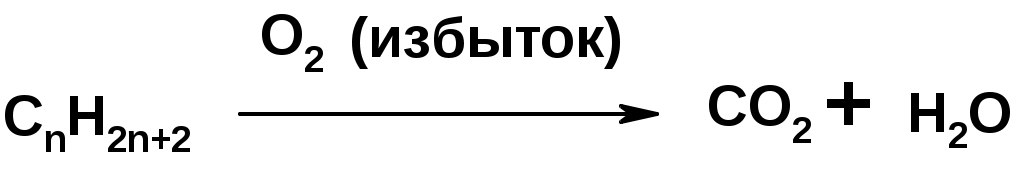 Управляемое окисление  ЦиклоалканыCnH2n 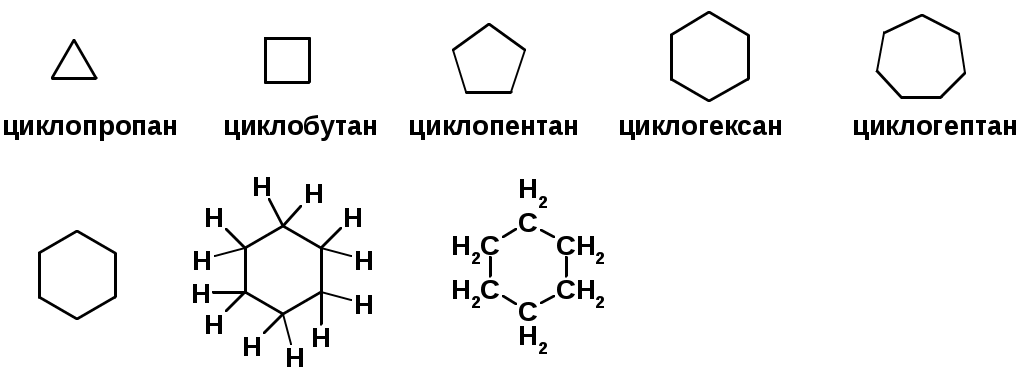 ПолучениеВнутримолекулярная реакция Вюрца 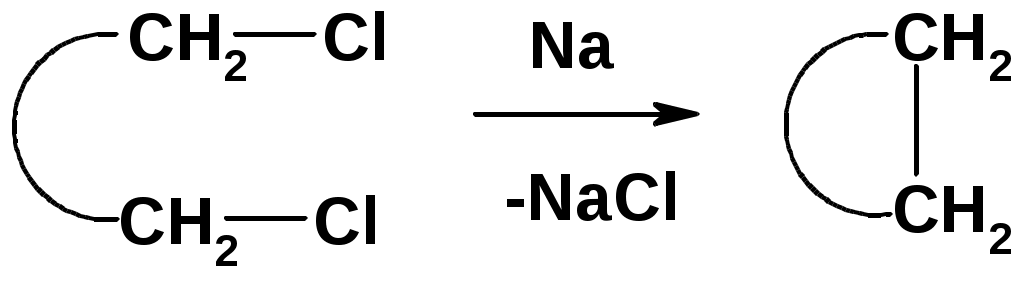  Хим. свойства см. алканыРеакции присоединения (для напряженных циклов С3-С4) 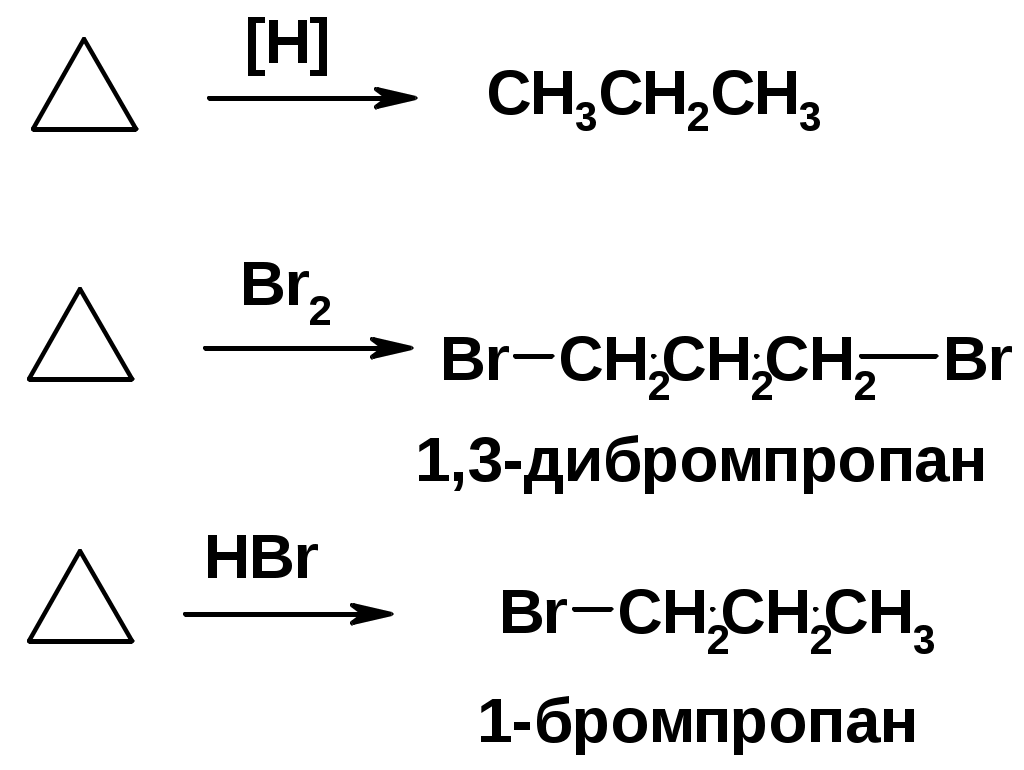 АЛКЕНЫСnH2n ненасыщенные углеводороды с двойной связью Номенклатура -  Двойная связь sp2-гибридизация 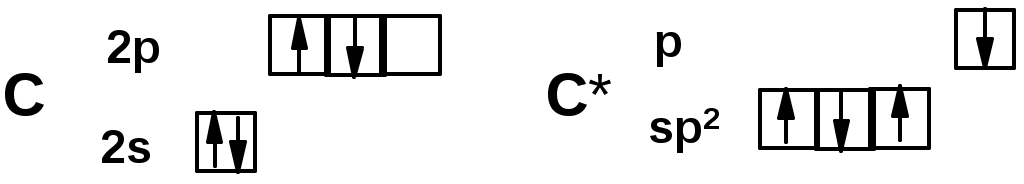 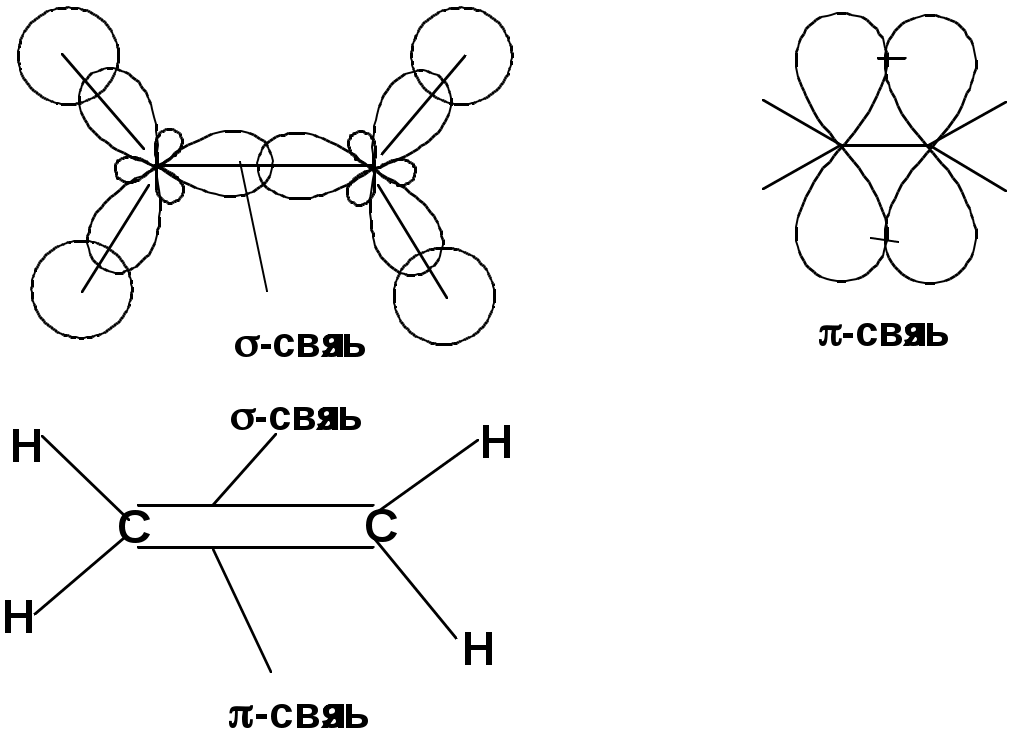 Пространственная изомерия относительно двойной связи  Способы получения1. Дегидратация спиртов 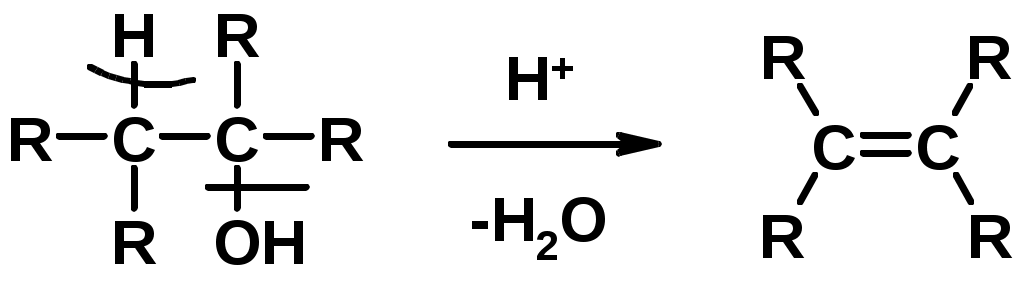 2.Дегидрогалагениерование галогеналканов  3.Дегалагениерование 1,2-дигалогеналканов  4.Дегидрирование алканов 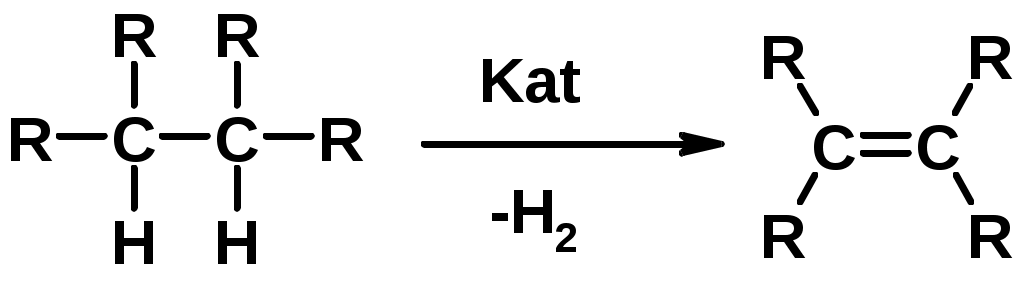 Химические свойстваРеакция присоединения 1. Гидрирование 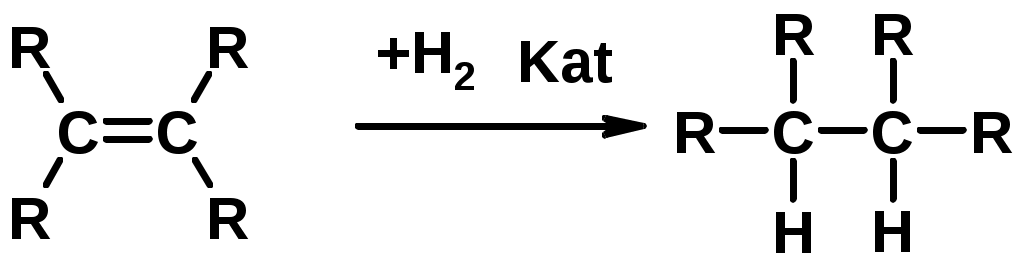 2. Присоединение галогеноводорода 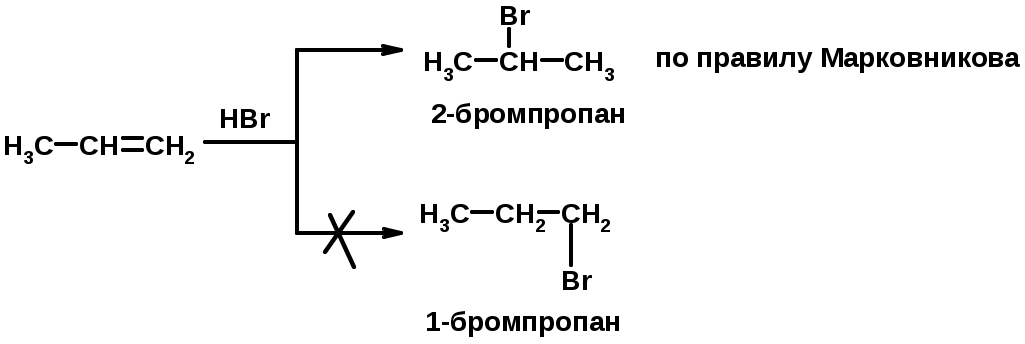 3. Гидратация 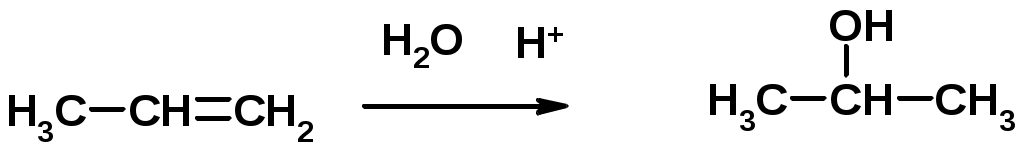 4. Окисление KMnO4 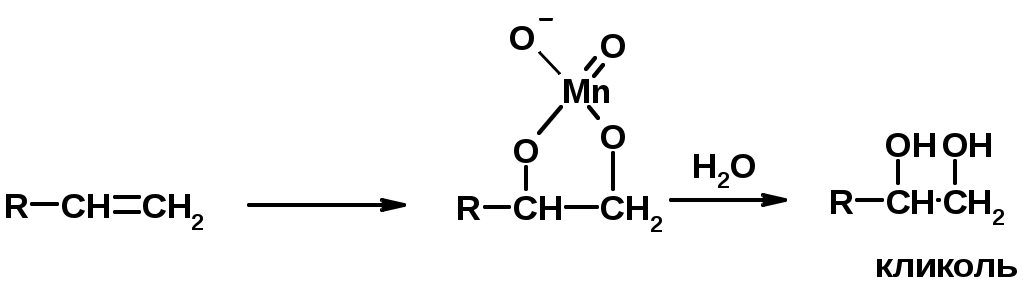 5. Озонолиз 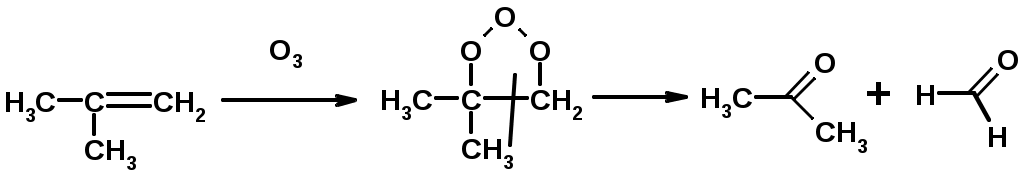 Алкадиены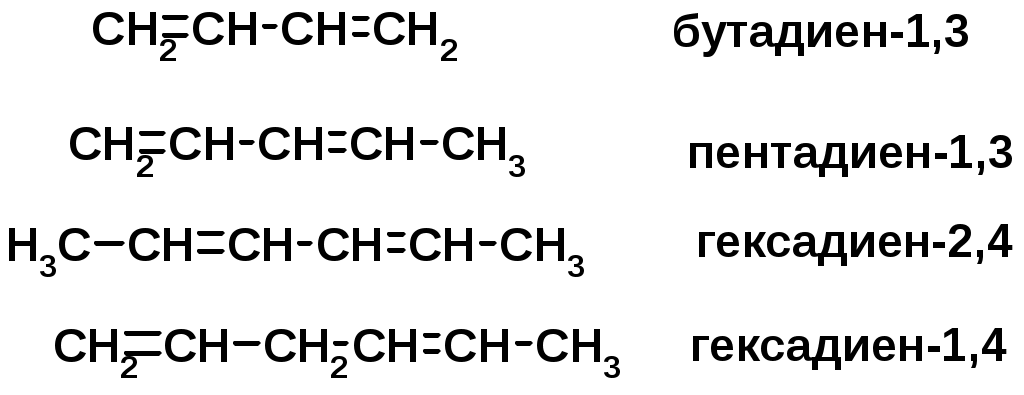 Классификация диенов  Особенности хим. свойства сопряженных диенов, по сравнению с алкенамиПрисоединение 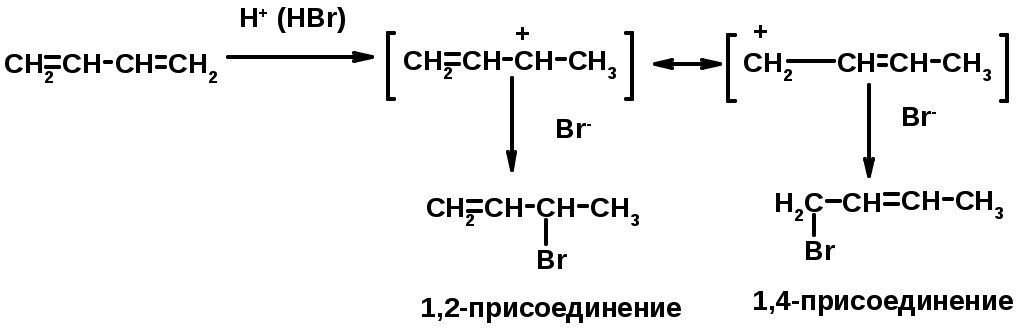 Диеновый синтез (реакция Дильса-Альдера)  Из 3 -связей образуется новые 1 - и 2 -связи Из 3 -связей образуется новые 1 - и 2 -связиАЛКИНЫ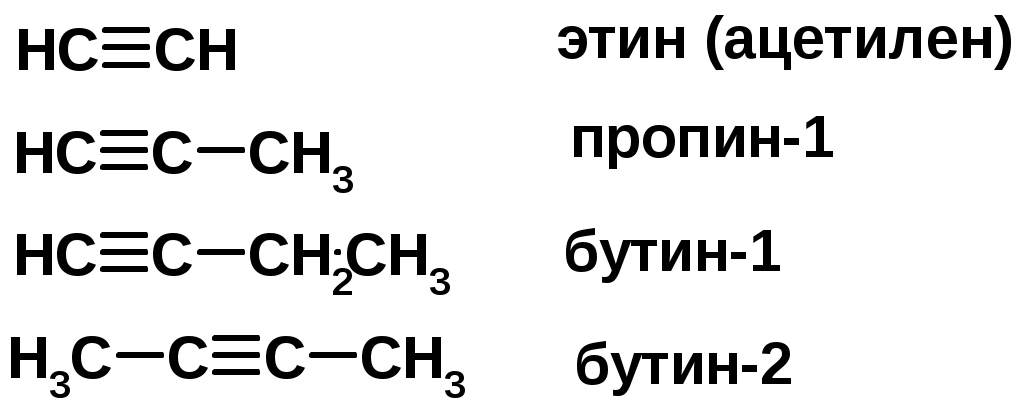 sp-гибридизация углерода при тройной связи  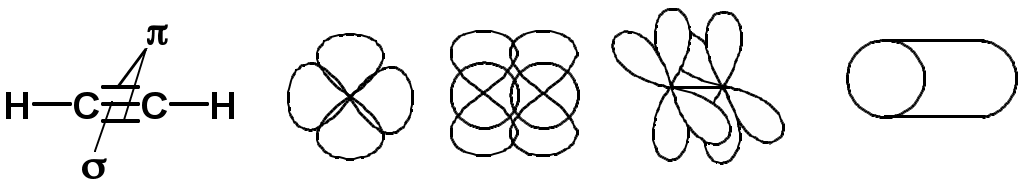 Методы получения1. 2. Дегидрогалогенирование 1,1- и 1,2-дигалогеналканов 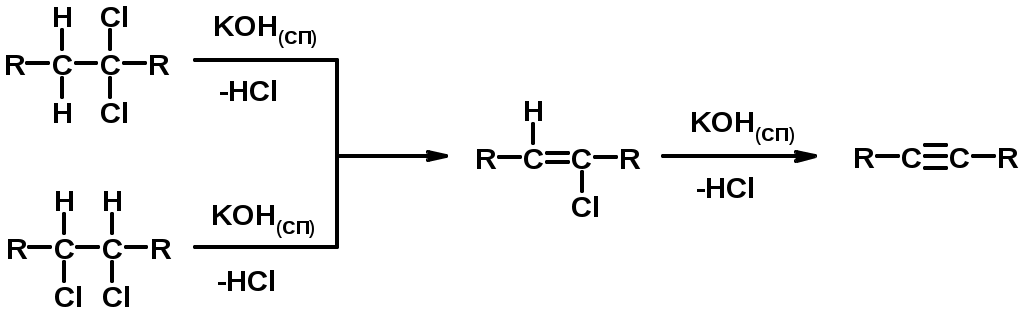 Химические свойства1. Гидрирование 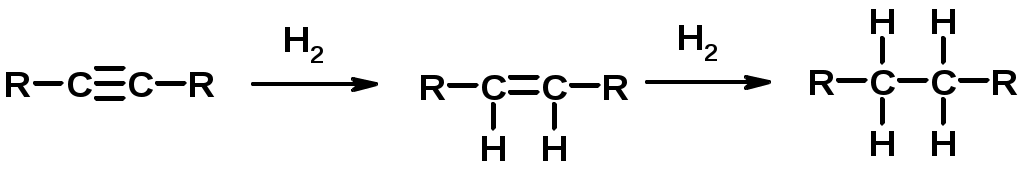 2. Галогенирование 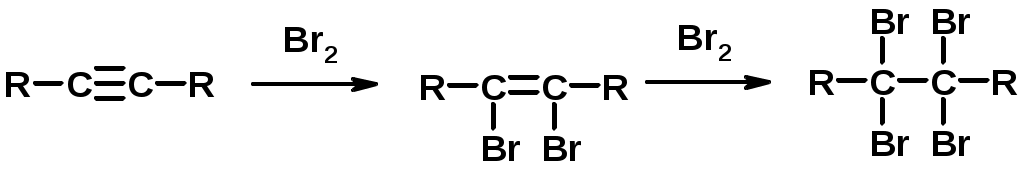 3. Гидрогалогенирование 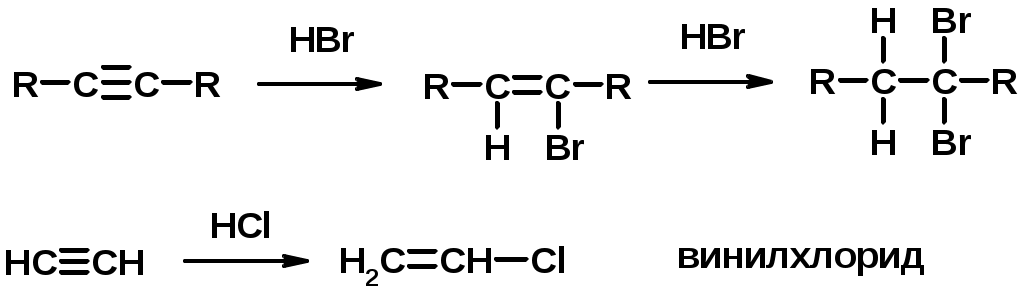 4. Винилирование 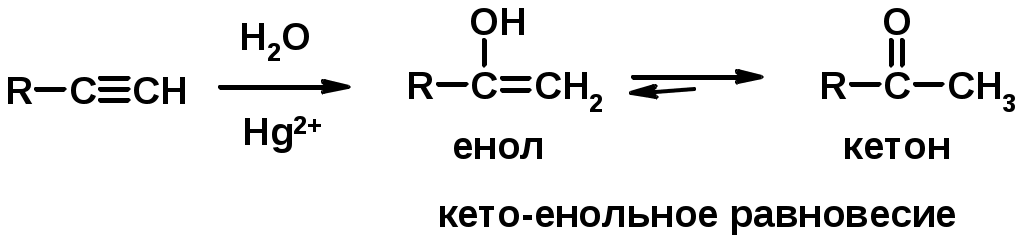 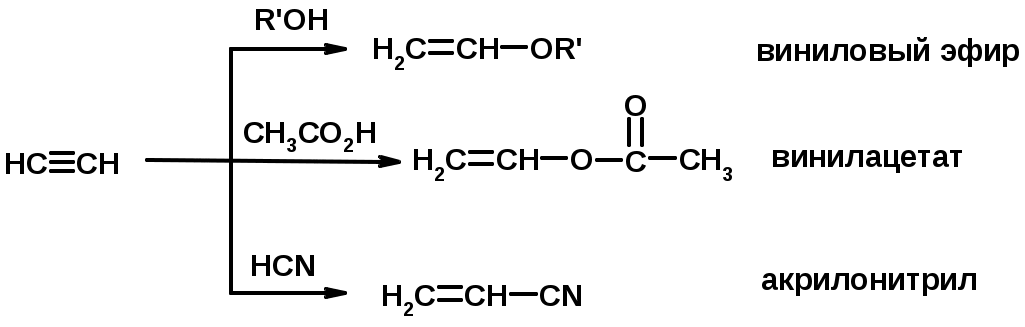 5. Кислотность алкинов с концевой тройной связью  Соли алкинов – ацетилениды Соли алкинов – ацетилениды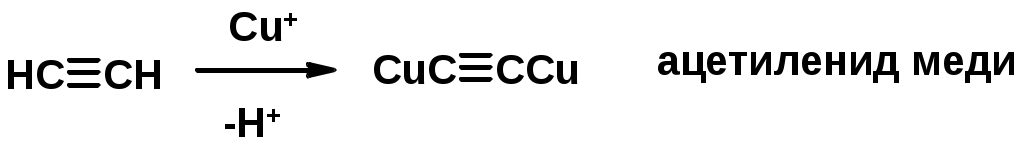 6. Циклизация 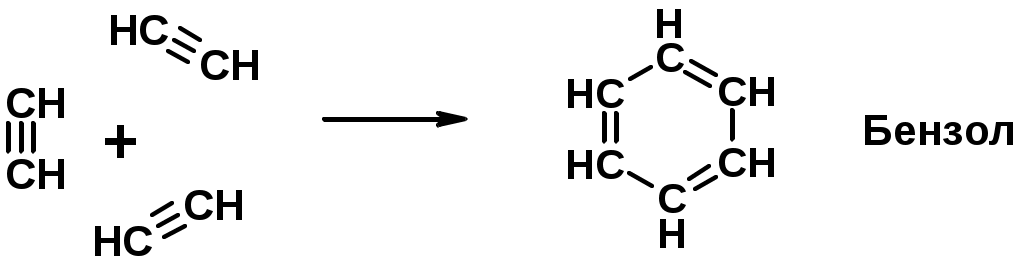 Ароматические углеводороды (арены)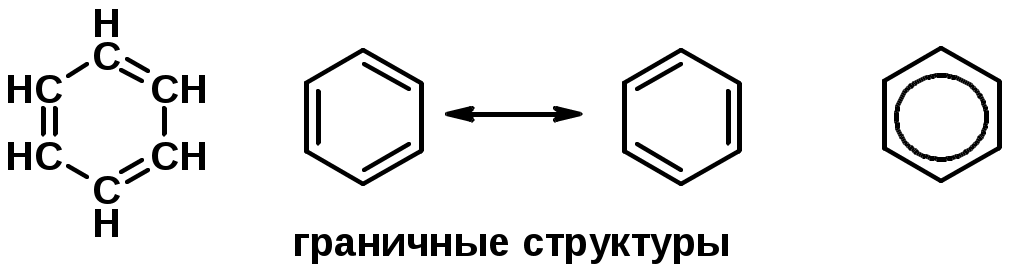 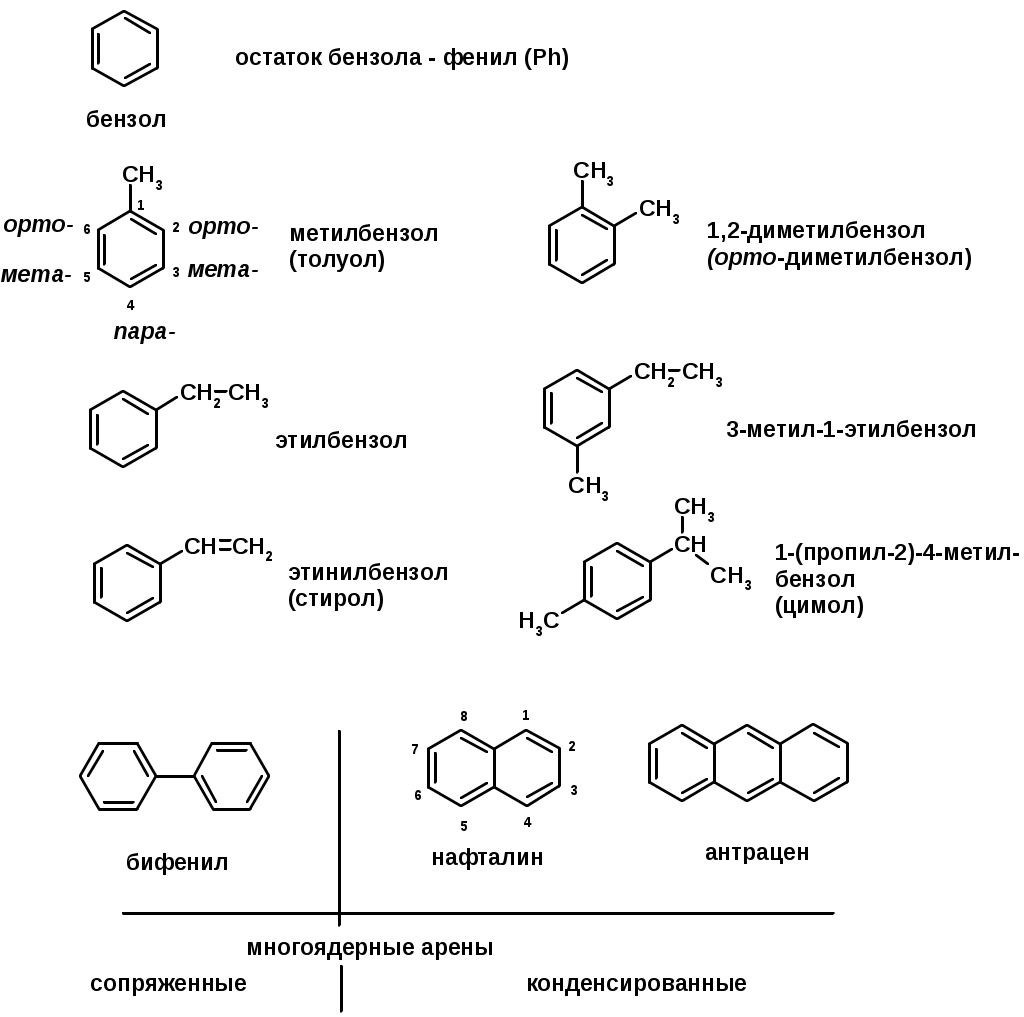 Углерод в ароматическом ядре – sp2-гибридизован Принцип ароматичности – принцип Хюккеля Замкнутая циклическая система сопряженных -электронов Количество -электронов – 4n+2 (n = 0, 1, 2...) С 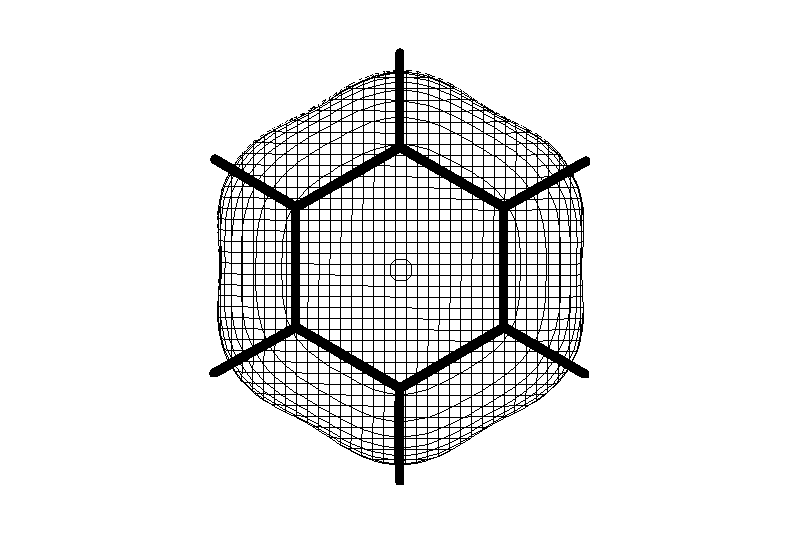     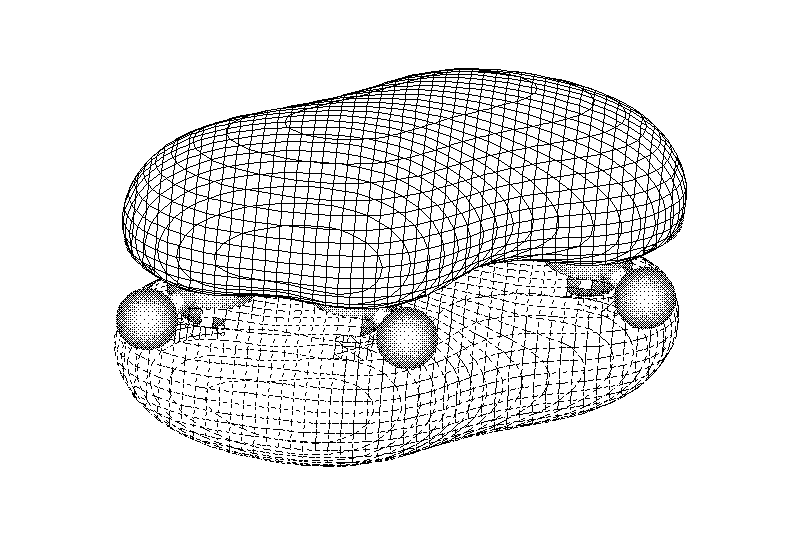 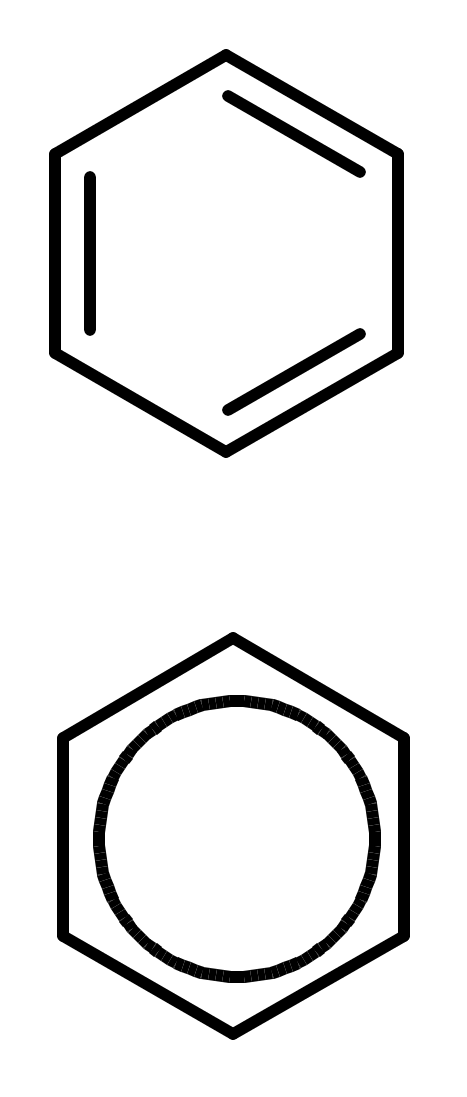 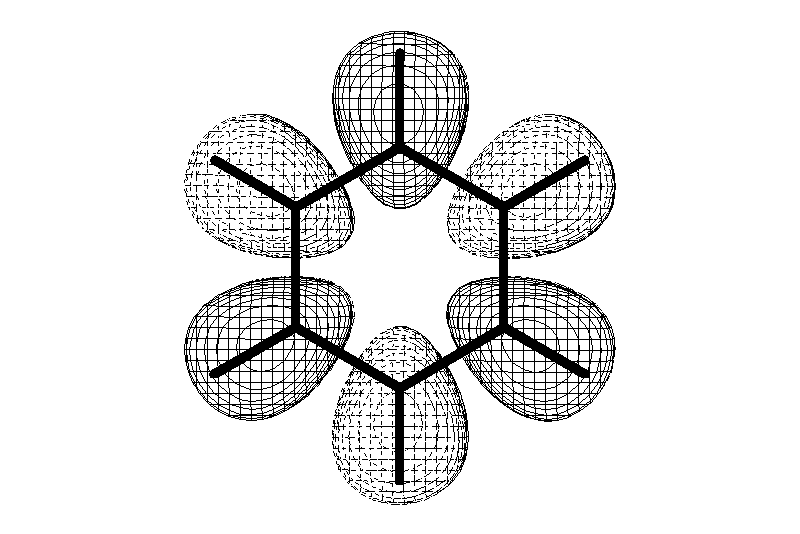 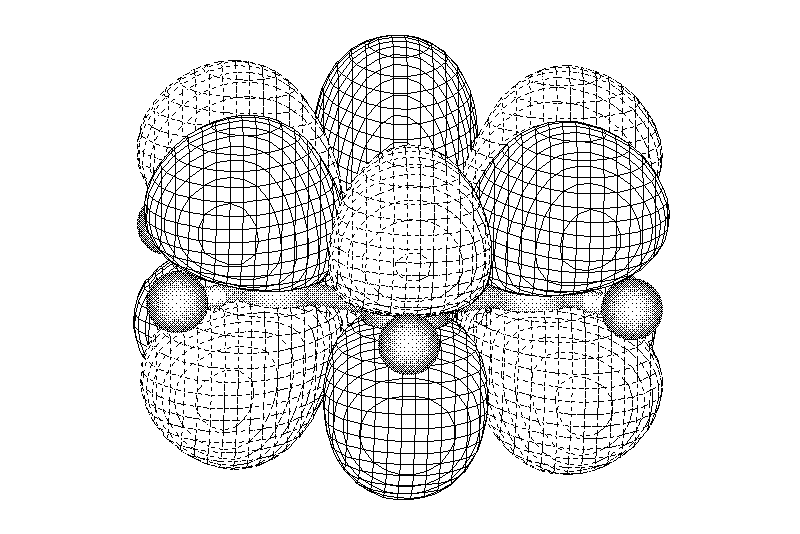 опряжение 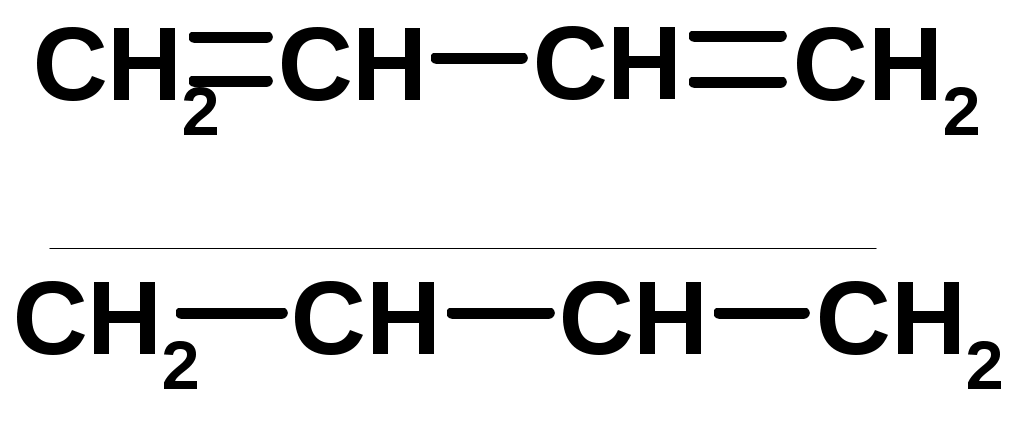 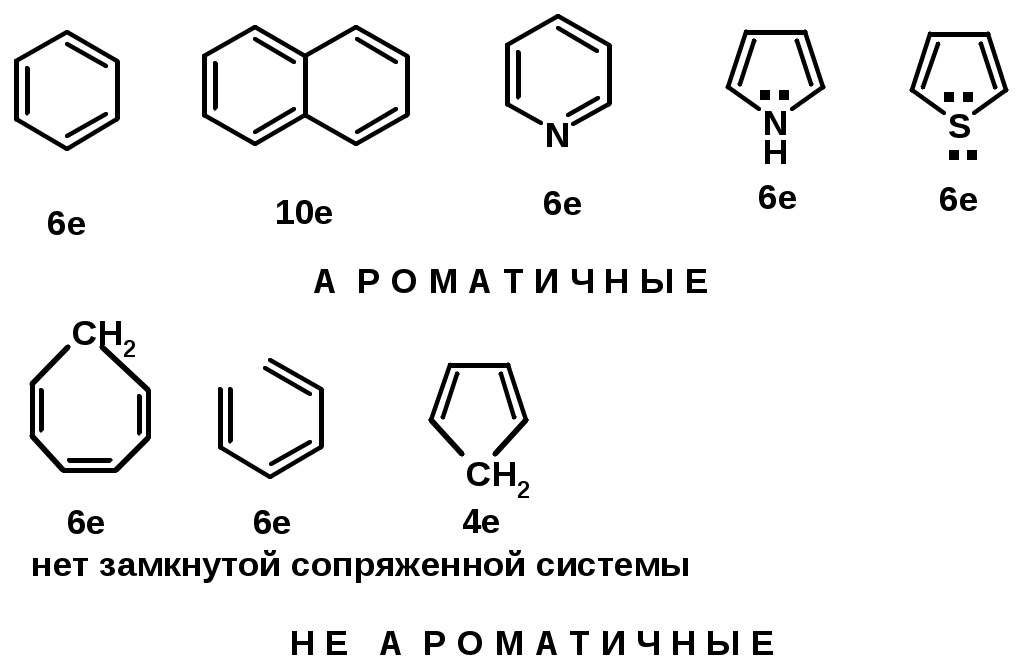 Химические свойстваЭлектрофилы (Е+) – акцепторы электронной плотности E+ = R+ (H3C+) – карбокатионы, NO2+, Br+, SO3, и др. Нуклеофилы (Nu-) – доноры электронной плотности Nu- = R- (H3C-) – карбанион, ОН-, RO-, NH2-, Br-, HOH, RNH2 и др. Электрофильное ароматическое замещение SEAr  Влияние заместителей в бензольном кольце на реакцию SEAr Электронные эффекты заместителей Индуктивный эффект (I – эффект) – изменение распределения электронной плотности в молекуле из=за разницы электроотрицательности атомов.  Мезомерный эффект (М – эффект) – возникает в сопряженных системах (заместитель связан с sp2- или sp-гибридизованным углеродом)  Заместители I рода – направляют реакцию в орто- и пара-положение СН3 (R), OH, OR, NH2, NR2 (ускоряют реакцию), Cl, Br, I (замедляют) +I или +М -I, но +M 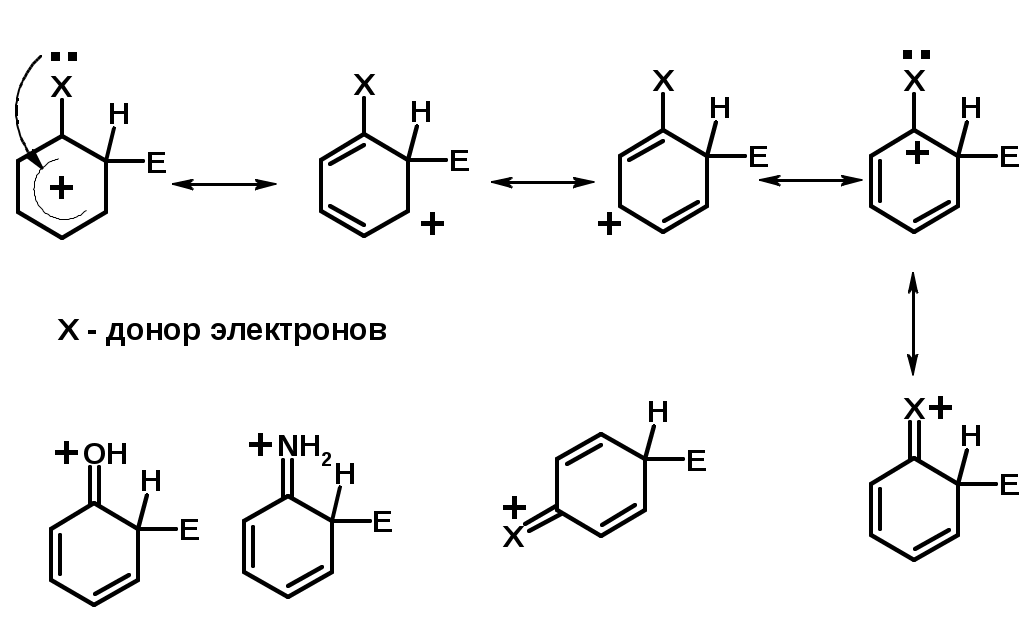 Заместители II рода – направляют реакцию в мета-положение и замедляют реакцию NO2, NO, СООН, COOR, SO3H, CN, N3, CСl3 -M и/или -I  1. Хлорирование 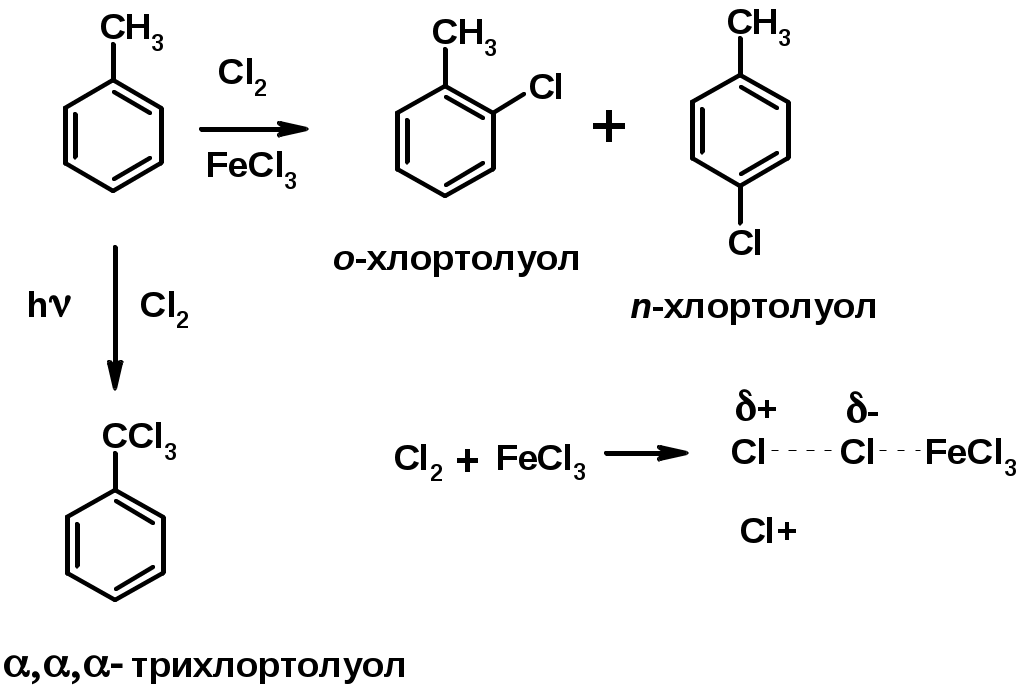 2. Нитрование 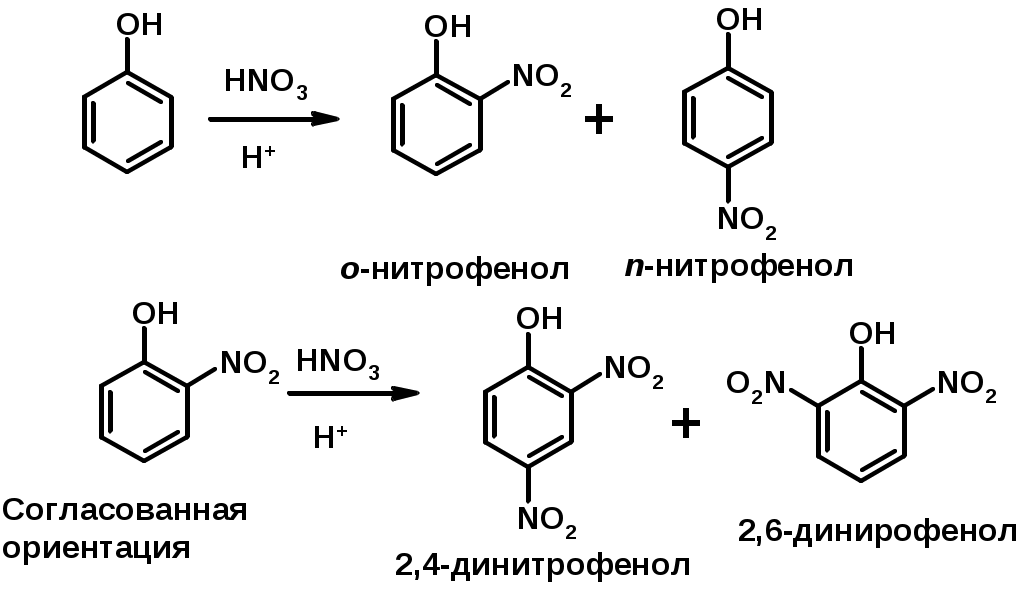 3. Сульфирование 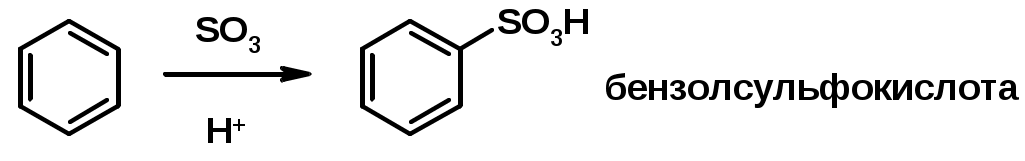 4. Алкилирование по Фриделю-Крафтсу 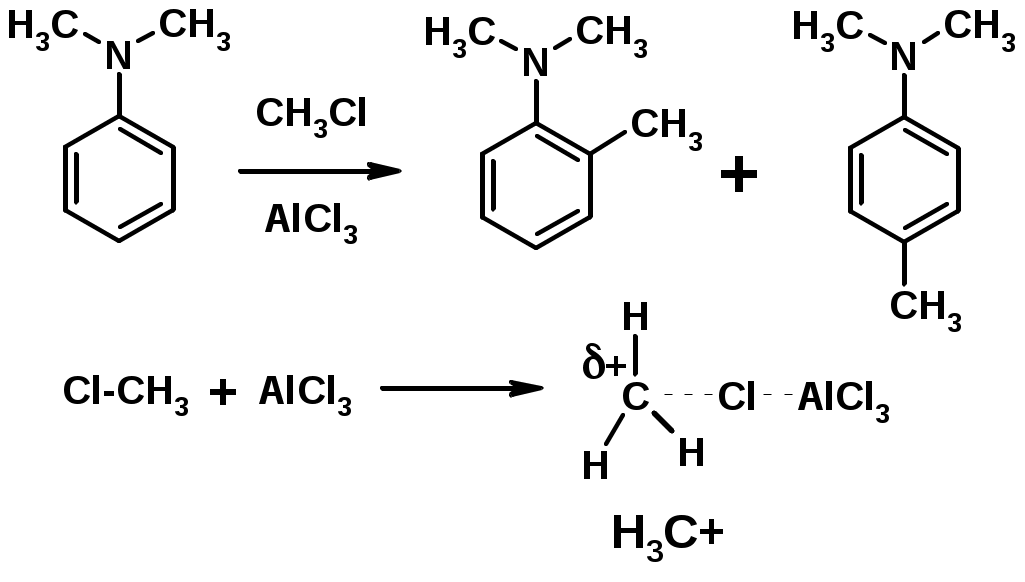 5. Ацилирование по Фриделю-Крафтсу 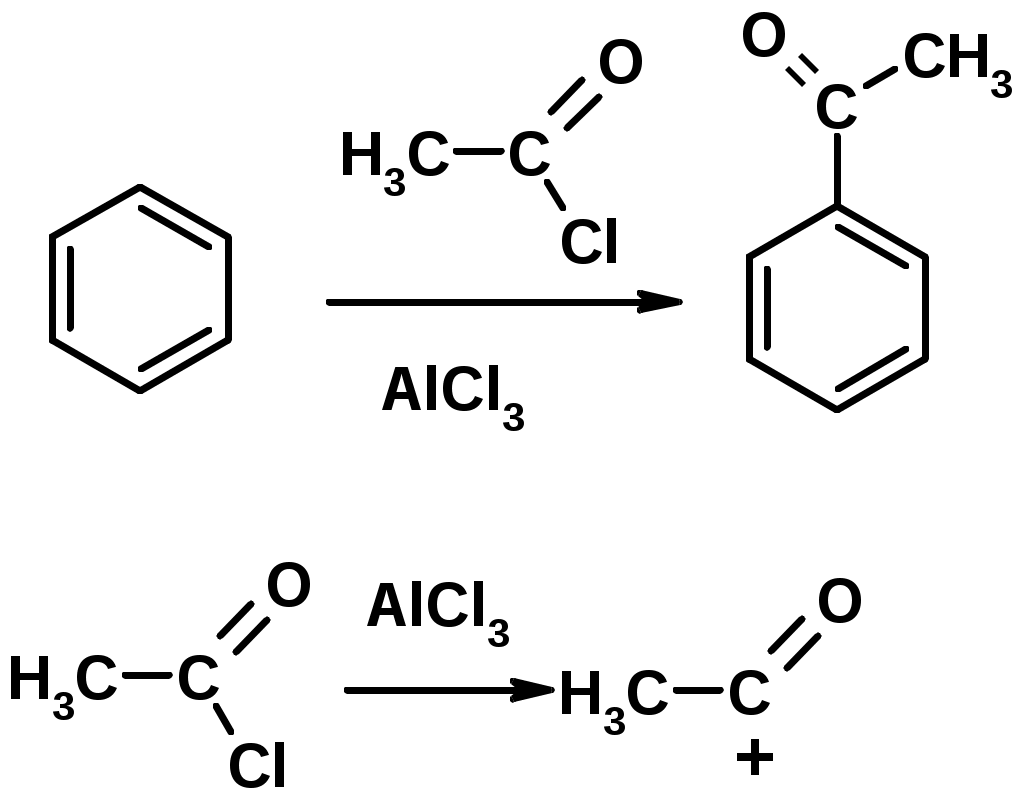 Согласованная ориентация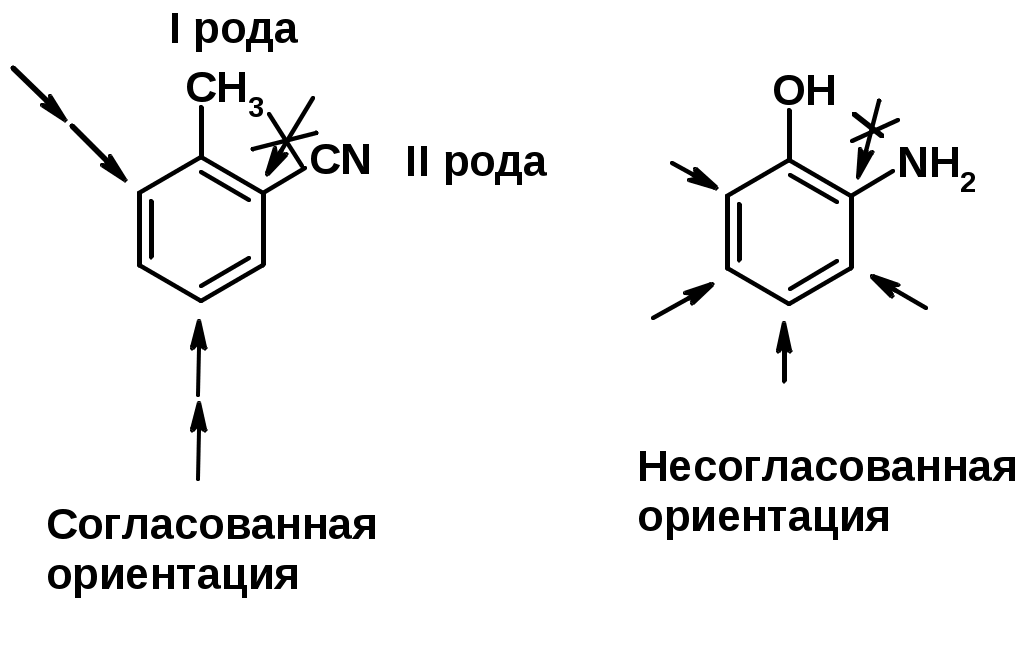 ГАЛОГЕНУГЛЕВОДОРОДЫ (Hal = F, Сl, Br, I)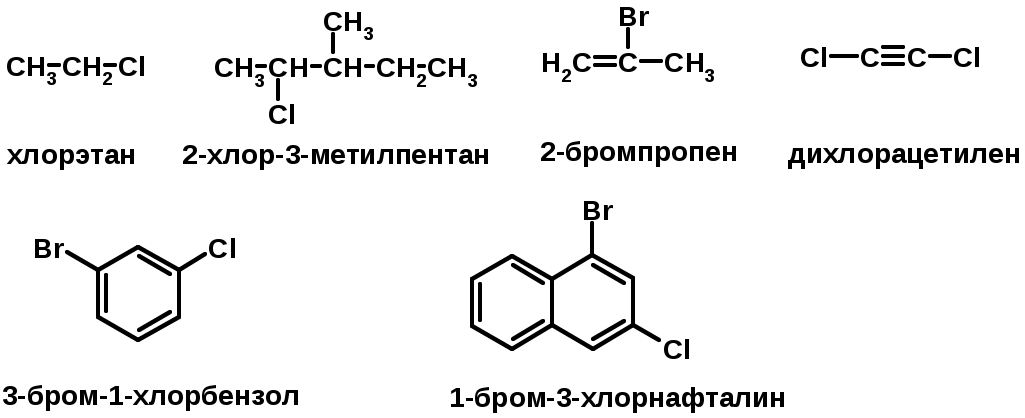 Способы получения1. Галогенирование алканов (см. алканы) 2. Гидрогалогенирование алкенов и алкинов (см. алкены, алкины) 3. Присоединение галогенов к алкенам и алкинам (см. алкены, алкины) 4. Реакции спиртов с галогеноводородами  Два основных механизма реакции нуклеофильного замещения: Уравнение скорости реакции: A + B C  SN1 v = k [R-OH] 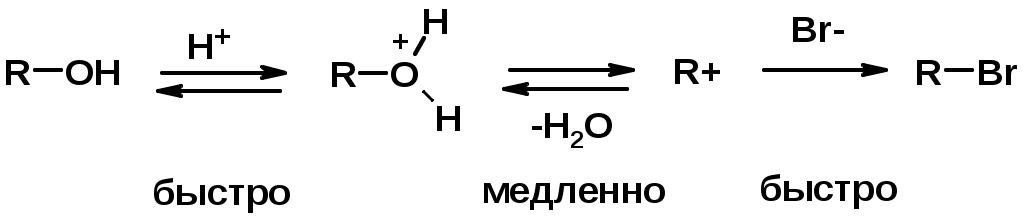 Лимитирующая стадия – образование карбокатиона, значит протекание всей реакции зависит от стабильности самого карбокатиона 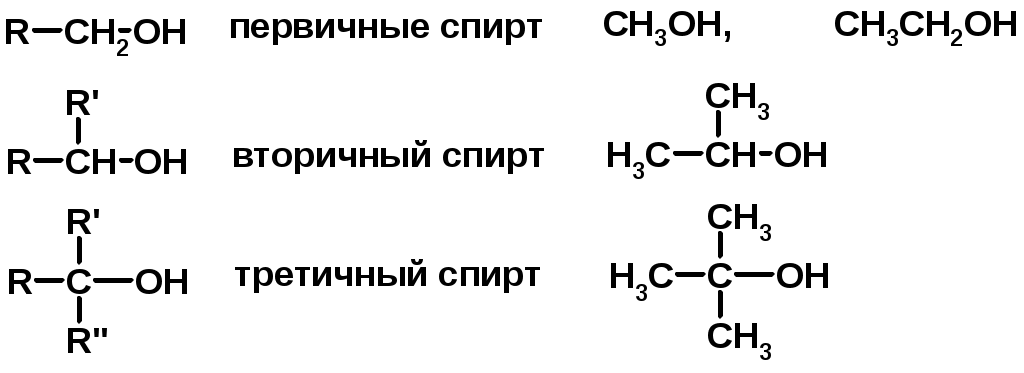 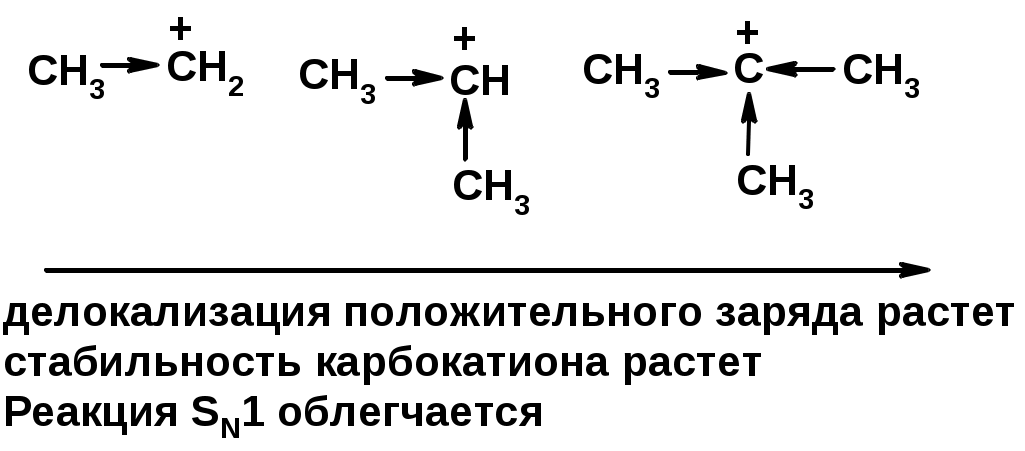 SN2 v = k [R-OH] [Hal-] 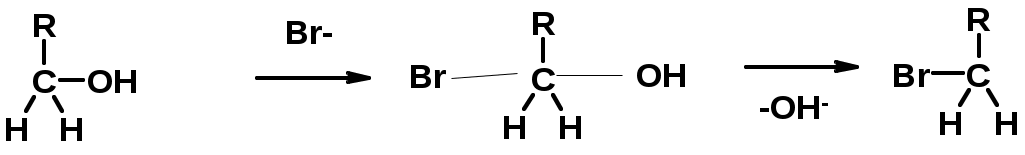 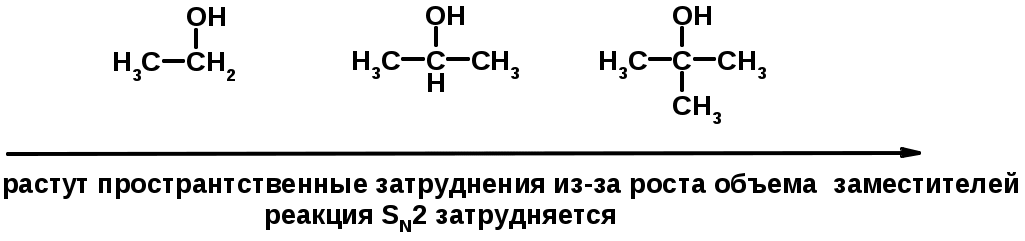 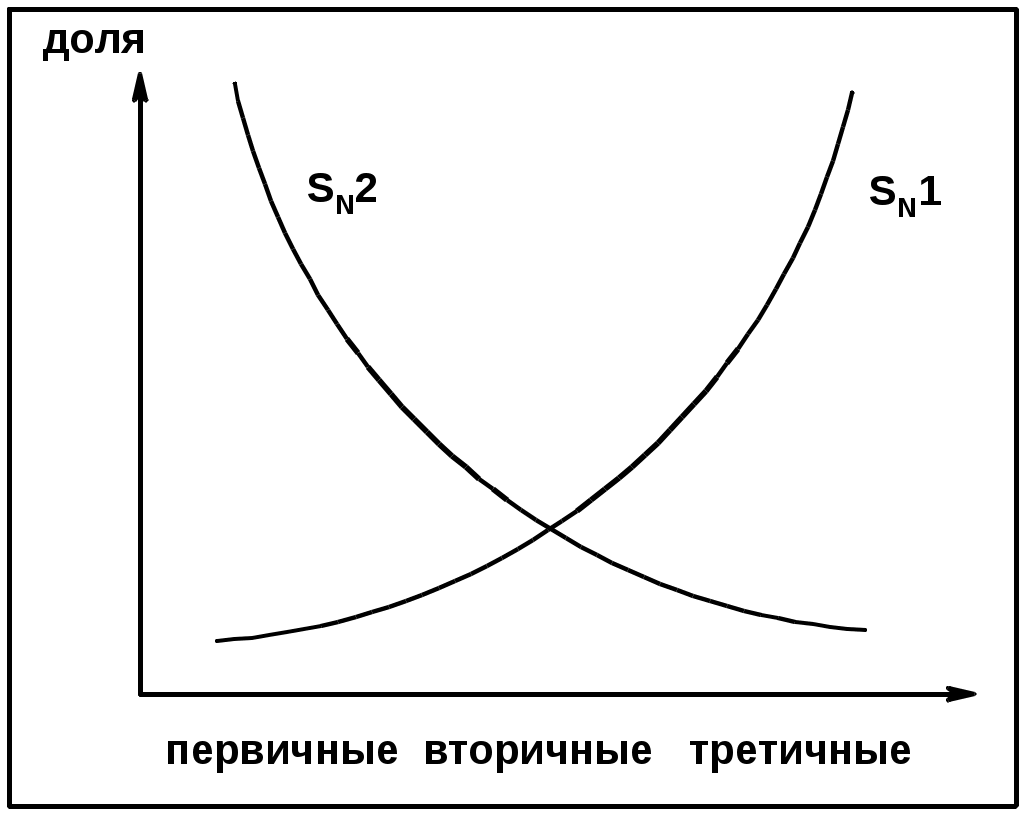 ПОЛУЧЕНИЕ ГАЛОГЕНУГЛЕВОДОРОДОВ (продолжение) 5. Галогенирование аренов (см. хлорирование аренов) Химические свойства1. Отщепление галогеноводорода (см. получение алкенов и алкинов) 2. Реакция Вюрца (см. получение алканов) 3. Нуклеофильное замещение галогена (для алифатических галогенуглеводородов) 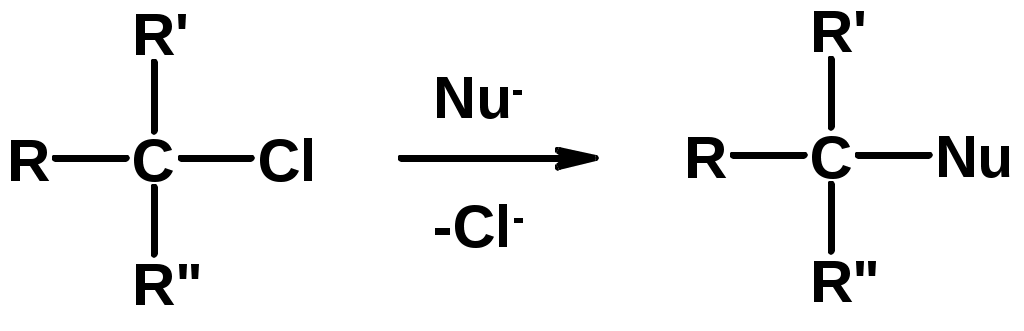 Реакцию можно рассматривать как введение остатка алифатического углеводорода (алкила) в другую молекулу – реакция алкилирования, а галогенуглеводород – алкилирующий агент  4. Ароматическое нуклеофильное замещение - возможно только для активированных сильными акцепторами (нитро-группа) аренов 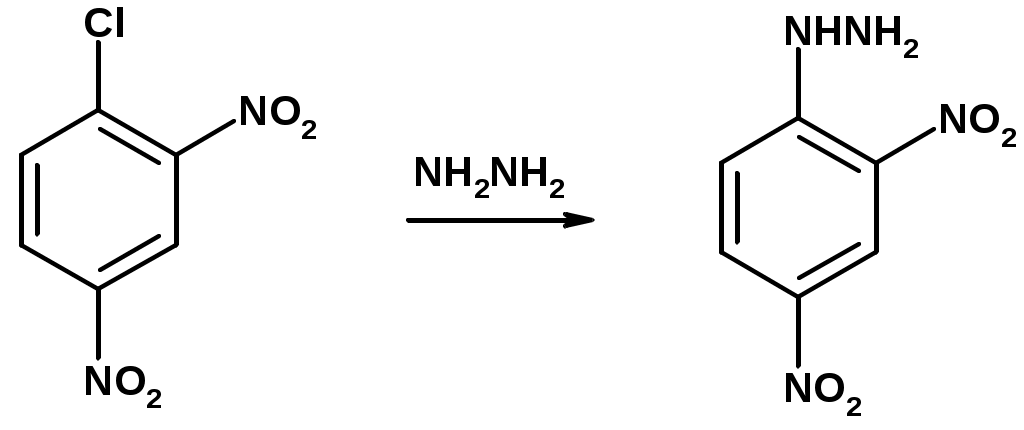 5. Получение магнийорганических соединений (реактивов Гриньяра) СПИРТЫ и ФЕНОЛЫ(ОН – гидроксил или гидрокси-группа)(приставка для обозначения гидроксила – гидрокси, суффикс – ол)  Методы полученияПолучение спиртов1. Гидратация алкенов (см. алкены) 2. Замещение галогена на гидроксил (OH) (см. галогенуглеводороды) 3. Восстановление карбоновых кислот  Получение фенолов 1. Кумольный метод получения фенола в промышленности 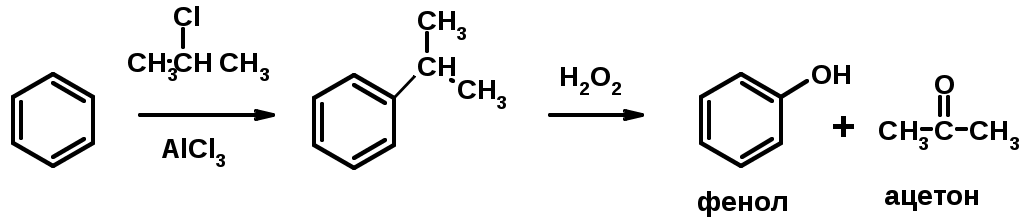 2. Сплавление сульфокислот с щелочами 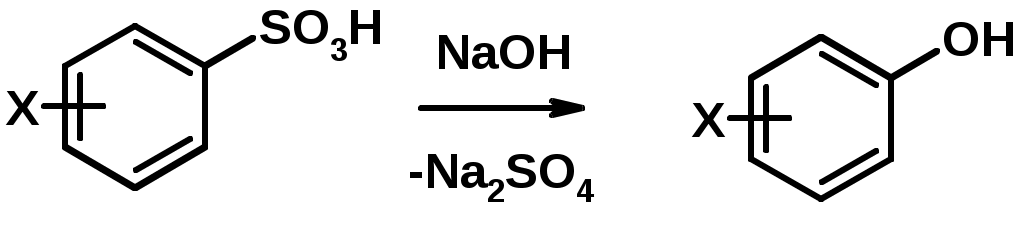 Химические свойства1. Кислотность (способность отдавать протон) 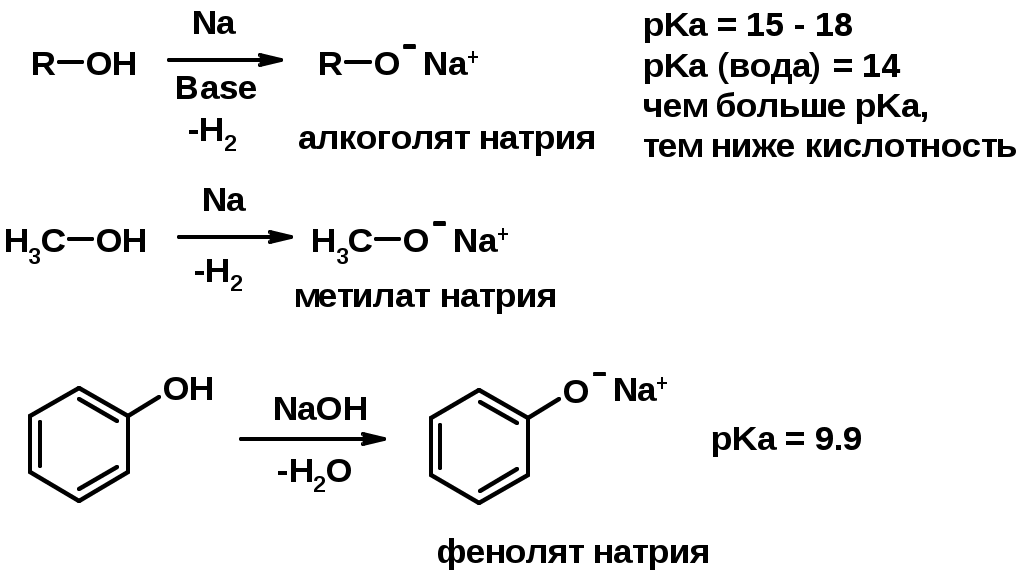 Кислотность фенолов выше, чем алифатических спиртов Кислотность тем выше, чем выше стабильность образующегося анионаСтабильность заряженной частицы тем выше, чем выше делокализация заряда 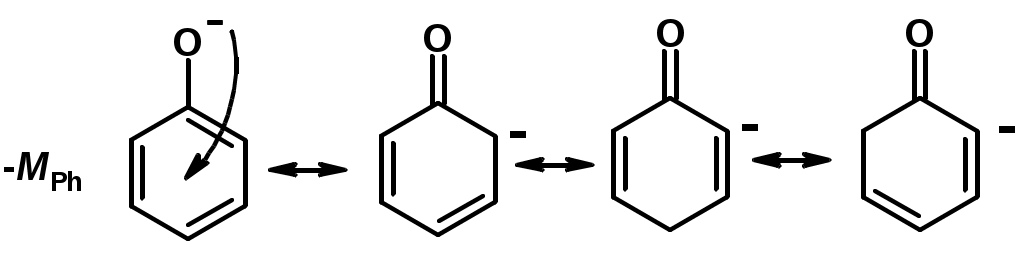 2. Реакции спиртов с галогеноводородами (SN) (см. получение галогенугдеводородов) 3. Образование простых эфиров 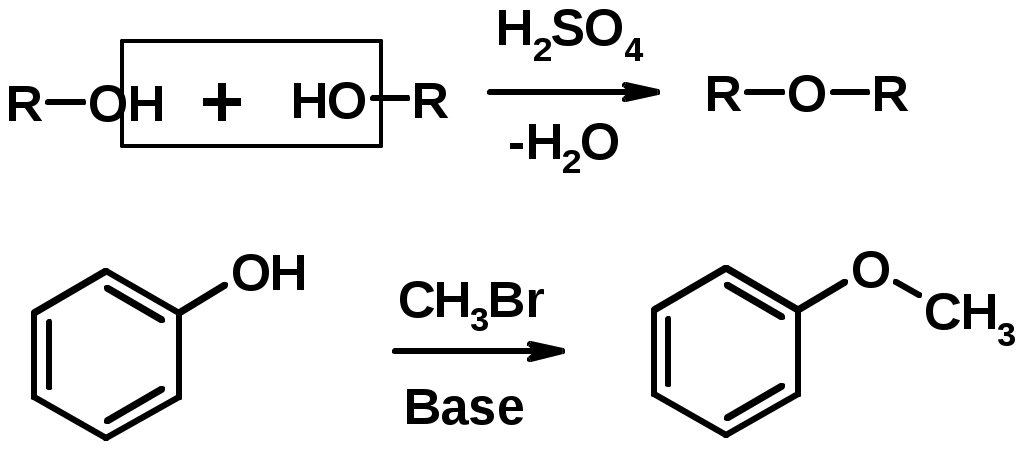 4. Образование сложных эфиров (этерификация) 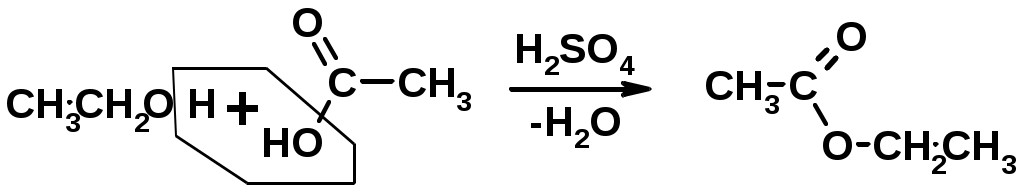 Окисление спиртов 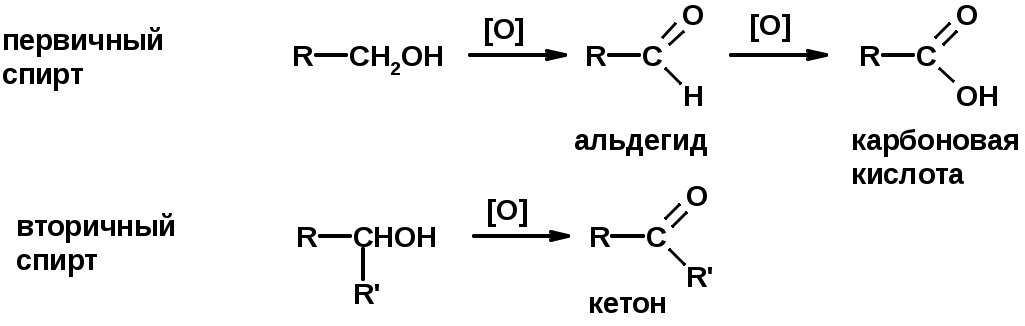 Окисление 1,2- и 1,4-дигидроксибензолов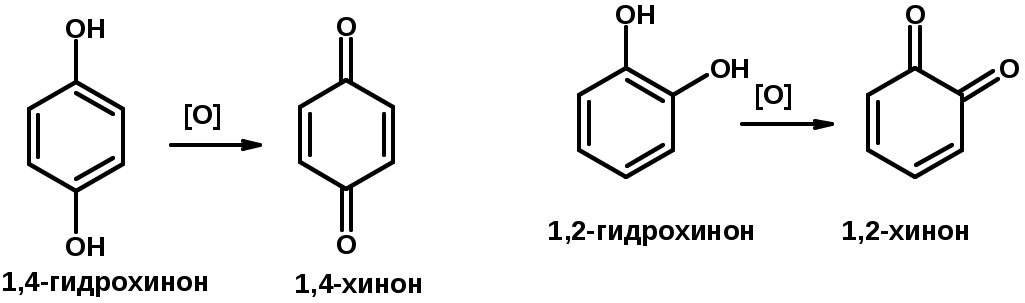 Электрофильное ароматическое замещение в фенолах ОН –заместитель I рода, направляет реакцию в орто- и пара-положения 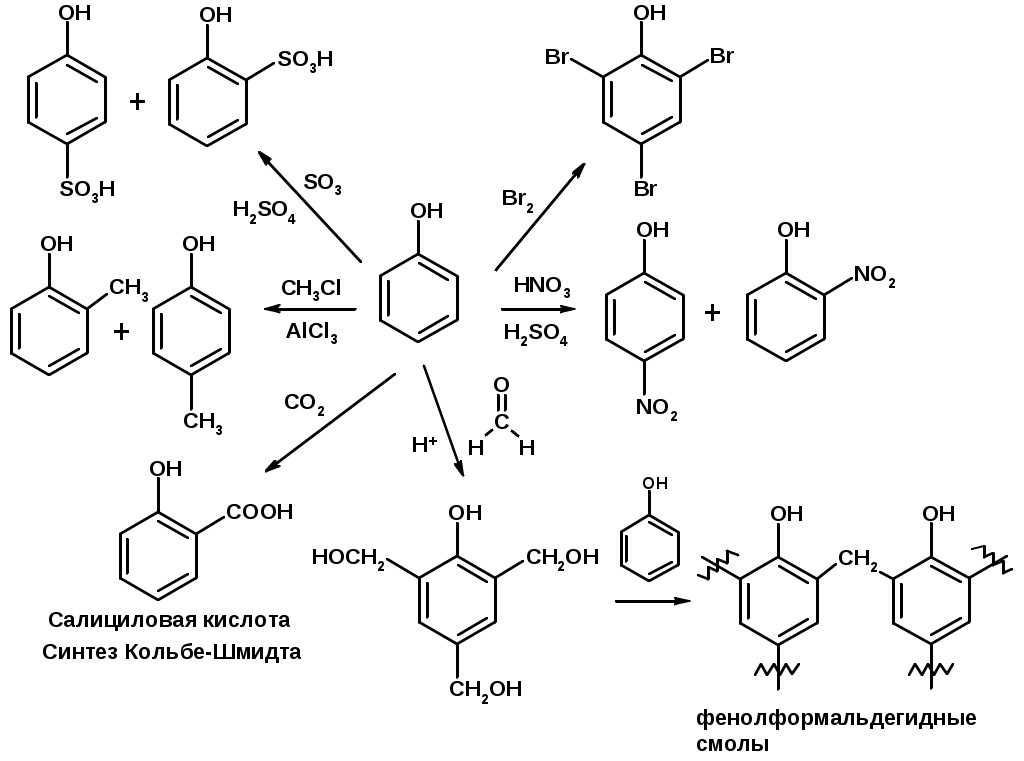 Ацилирование фенолов 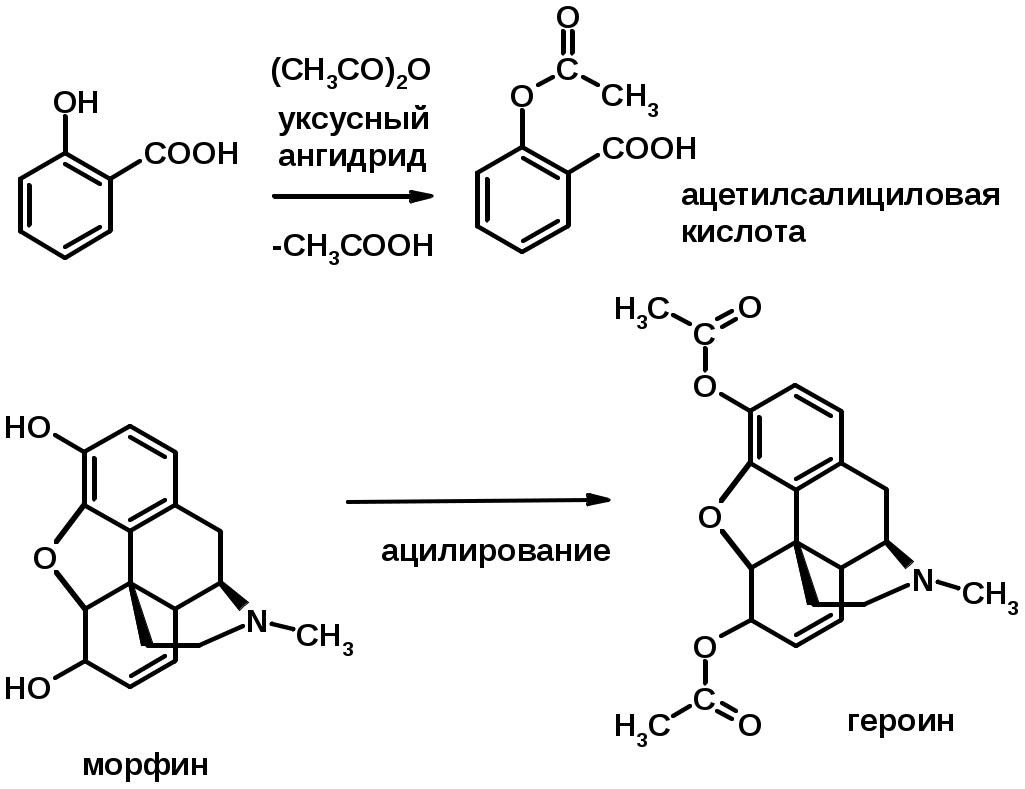 Простые эфиры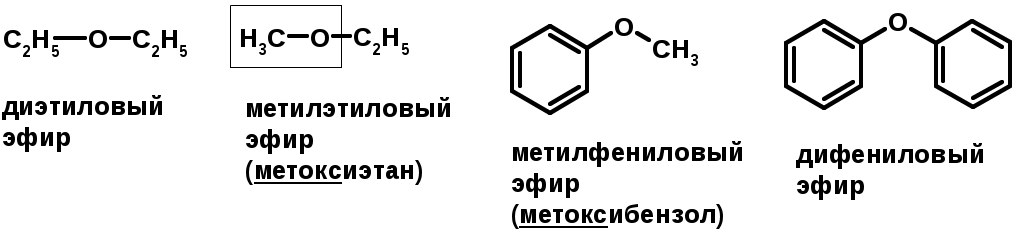 Методы получения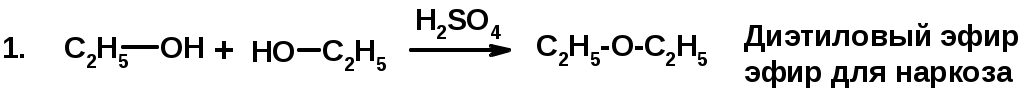 2. Алкилирование спиртов и фенолов 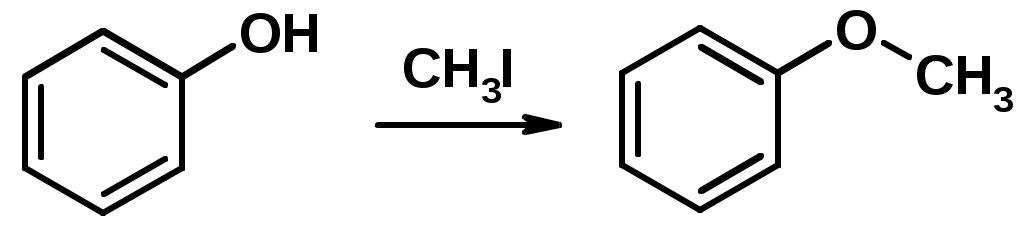 Эфиры – довольно стабильные соединения и используются как растворители. Расщепляются до исходных спиртов лишь в жестких условиях Карбонильные соединения – альдегиды и кетоны Методы получения1. Окисление первичных и вторичных спиртов (см. спирты) 2. Озонолиз алкенов (см. алкены) 3. Пиролиз кальциевых и бариевых солей карбоновых кислот 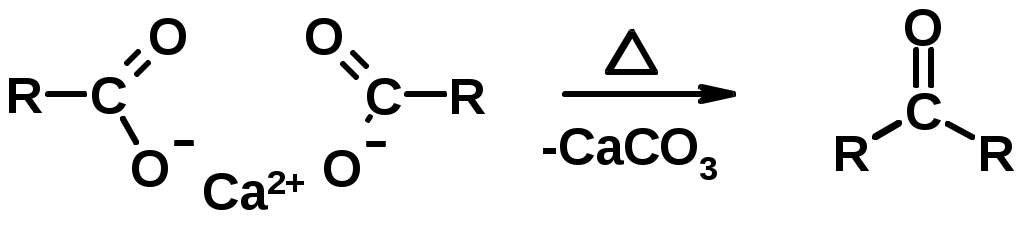 4. Ацилирование по Фриделю-Крафтсу (см. свойства аренов) 5. Восстановление карбоновых кислот и их производных  Химические свойства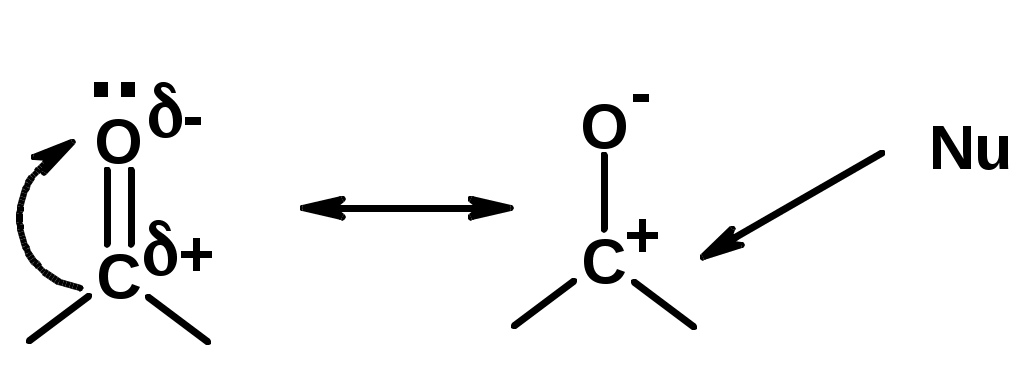 1. Реакции с водой и спиртами 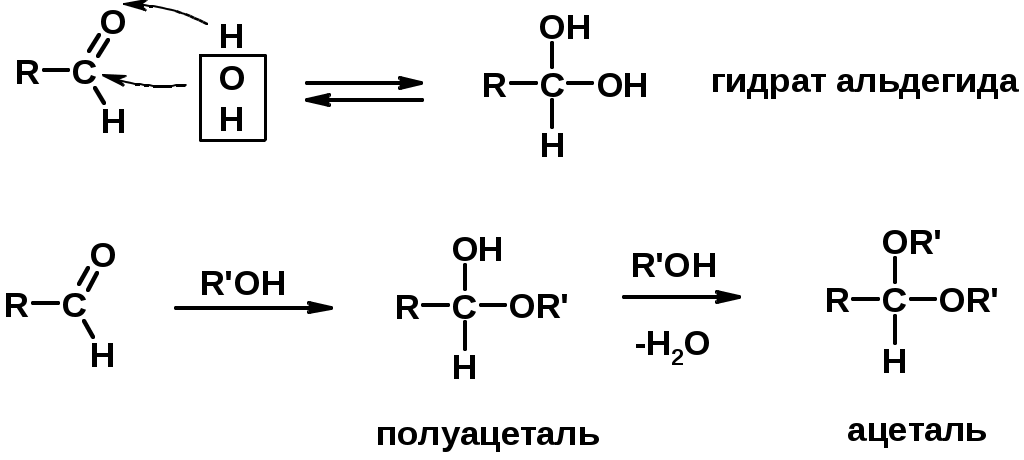 2. Реакции с аммиаком 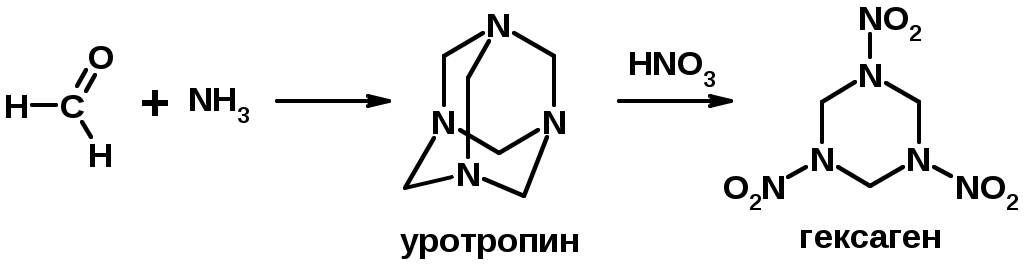 3. Реакции с аминами и их производными (присоединение-отщепление) 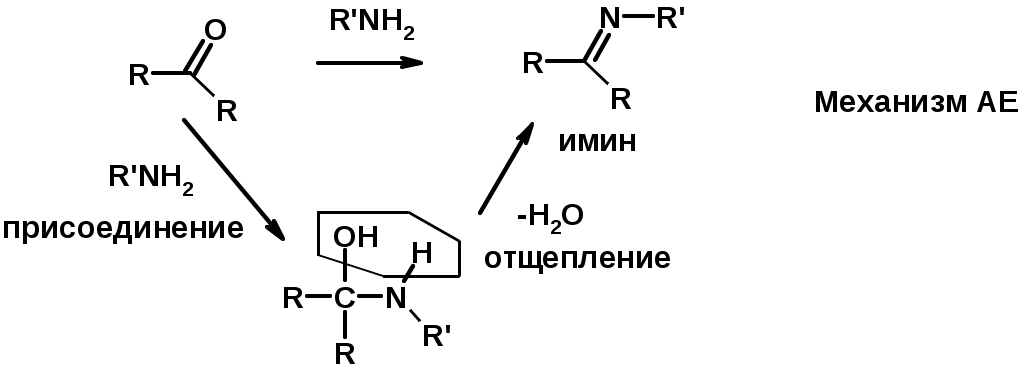 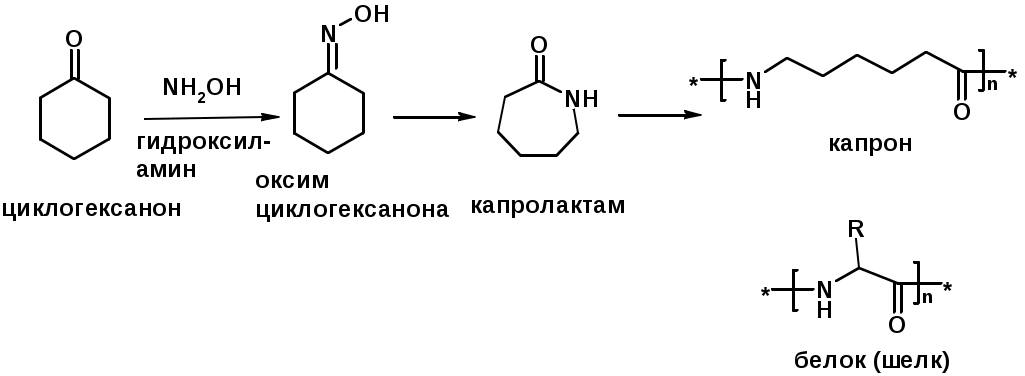 4. Конденсации СН-кислотность – карбонильные соединения способны отдавать протон от -углеродного атома 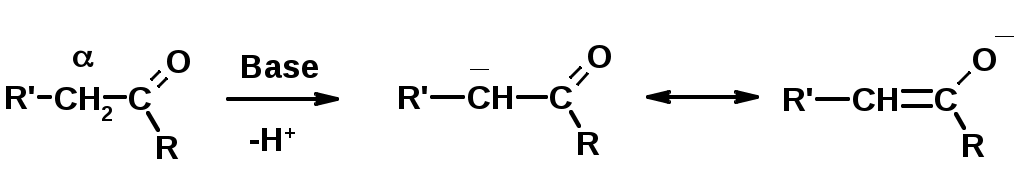  Если нет протона в -положении, то происходит реакция Каниццарро 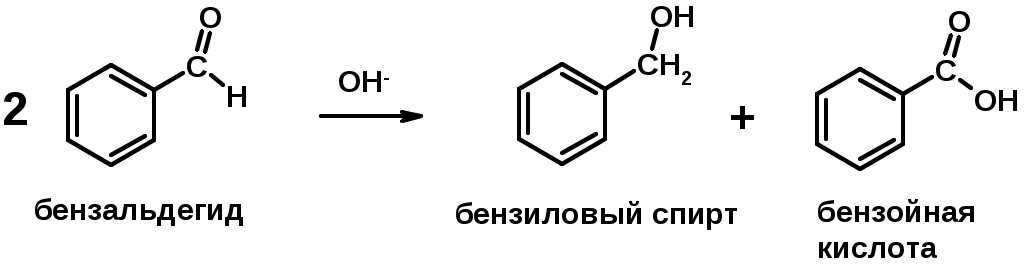 5. Окислительно-восстановительные реакции 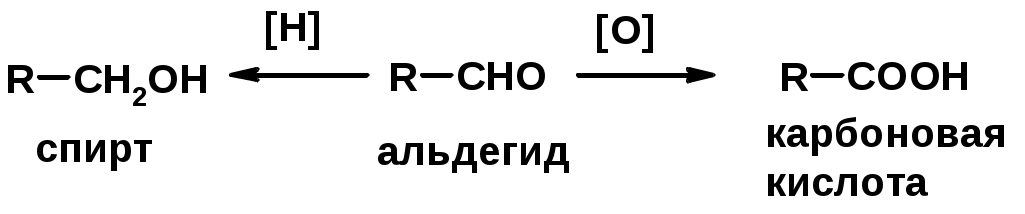 Карбоновые кислоты Методы получения1. Окисление первичных спиртов и альдегидов 2. Гидролиз трихлорметильных производных аренов 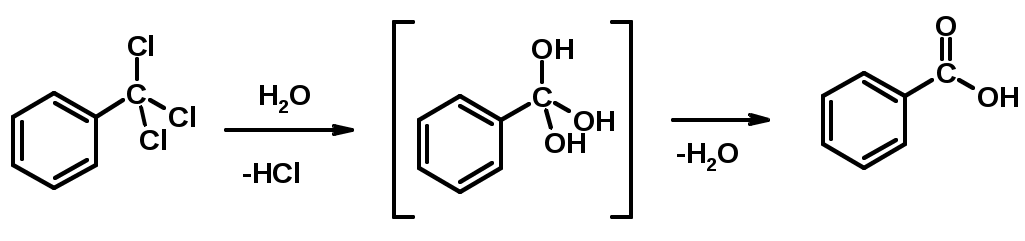 3. Гидролиз сложных эфиров (омыление) 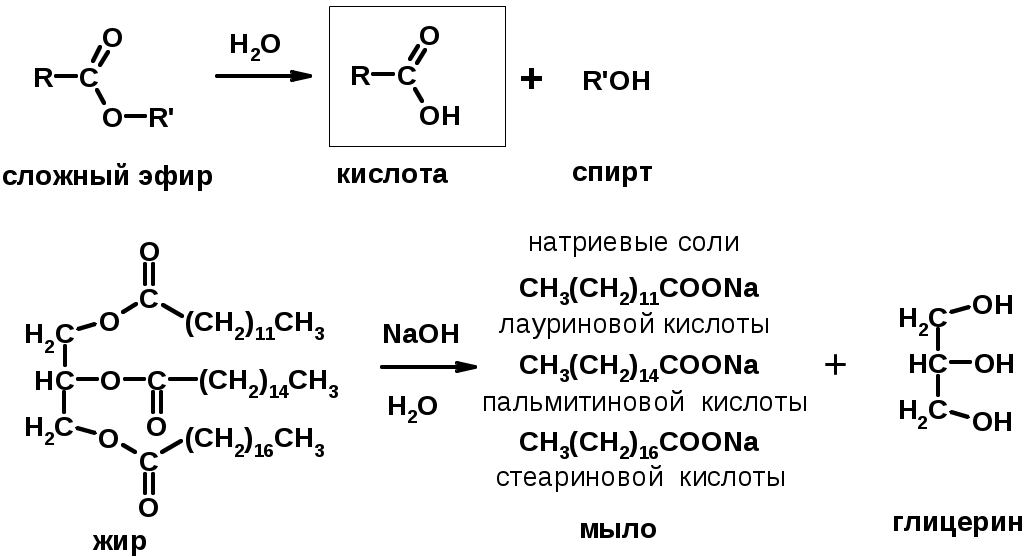 Химические свойстваКарбоновых кислот 1. Кислотность (образуют соли в реакциях даже со слабыми основаниями)  2. Реакции с нуклеофилами 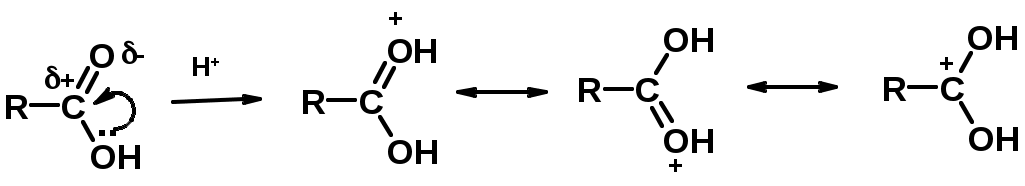 Углерод карбоксильной группы малоактивен по отношению к нуклеофилам (по сравнению с карбонильной группой) из-за +М гидроксила, для активации карбоновых кислот применяют протонирование, вносящее положительный заряд 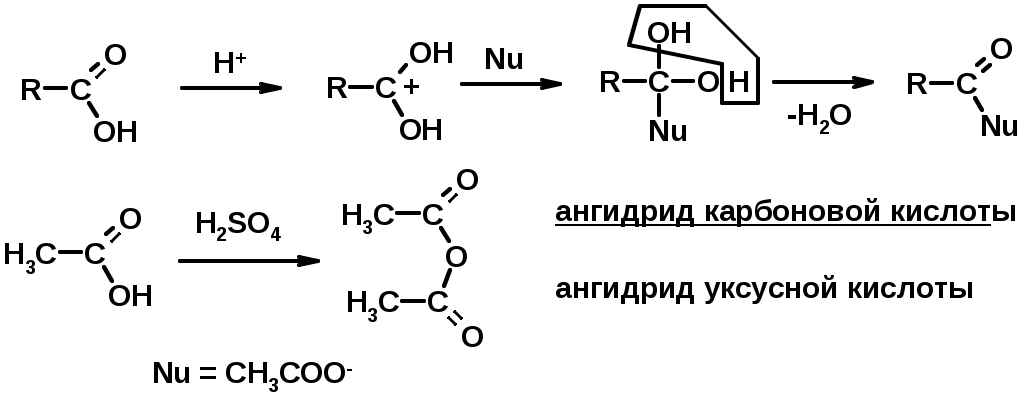  Химические свойства производных карбоновых кислот  Нитрилы карбоновых кислот (CN - циано-группа) 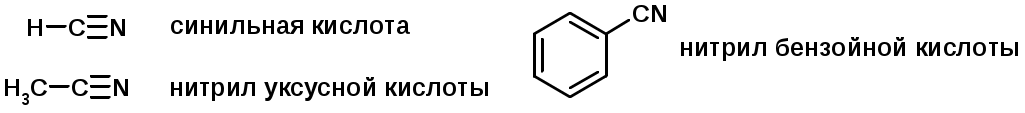 Получение 1. Дегидратация амидов 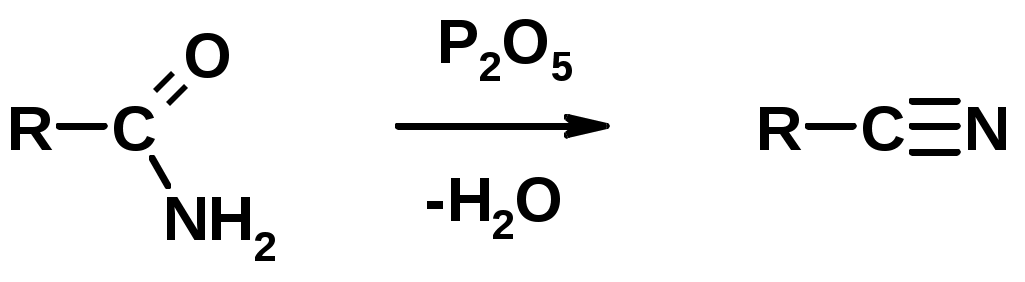 2. Цианирование галогеналканов Гидролиз нитрилов 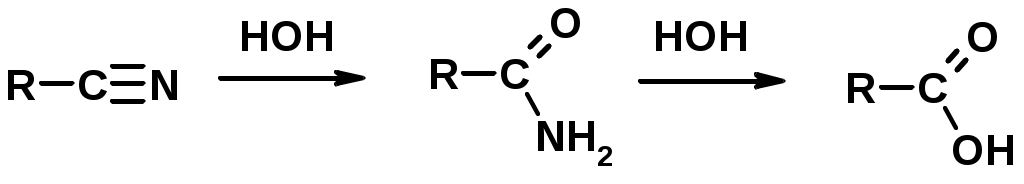 Серосодержащие органические соединения1. Тиоспирты (меркаптаны) R-SH СH3SH – метантиол (метилмеркаптан) 2. Тиоэфиры (сульфиды) R-S-R’ СH3-S-C2H5 метилэтилсульфид 3. Сульфокислоты R – SO3H CH3SO3H метансульфокислота 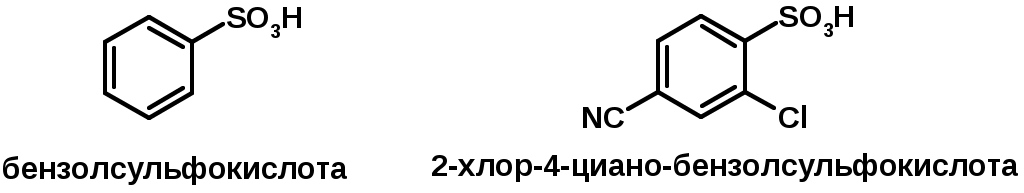 Получение (см. сульфоокисление алканов и сульфирование аренов) Нитросоединения (R-NO2)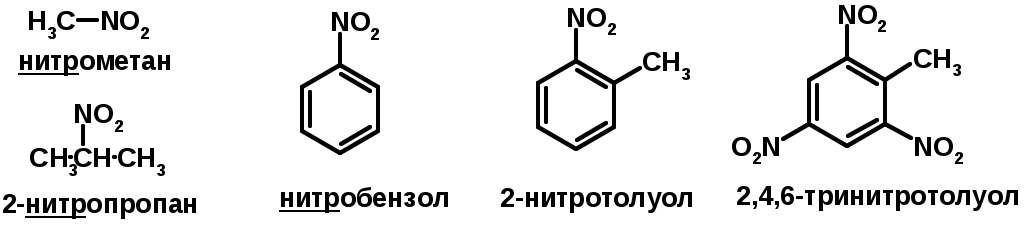 Получение (см. нитрование алканов и аренов)Хим. свойства1. СН-кислотность нитроалканов 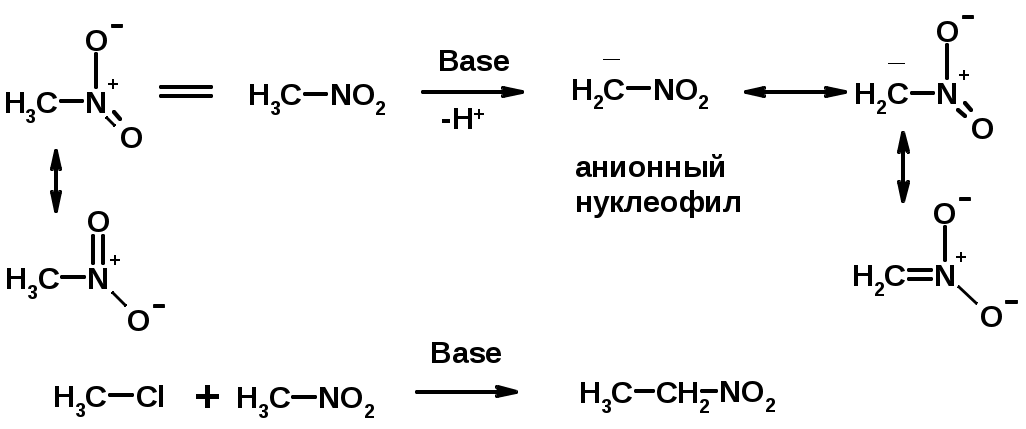 2. Восстановление нитроаренов 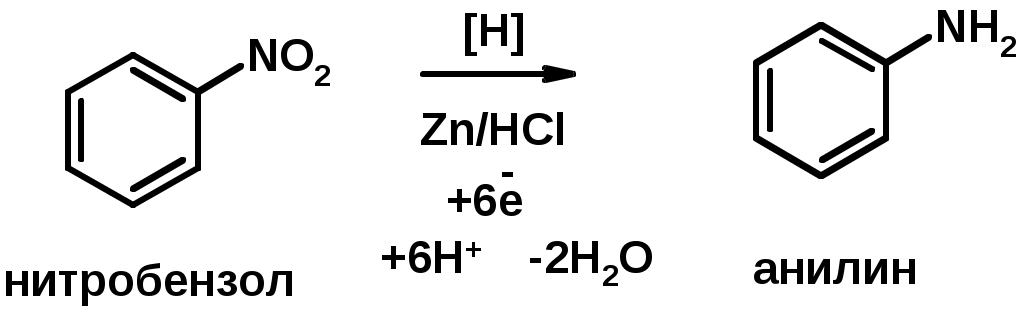 Амины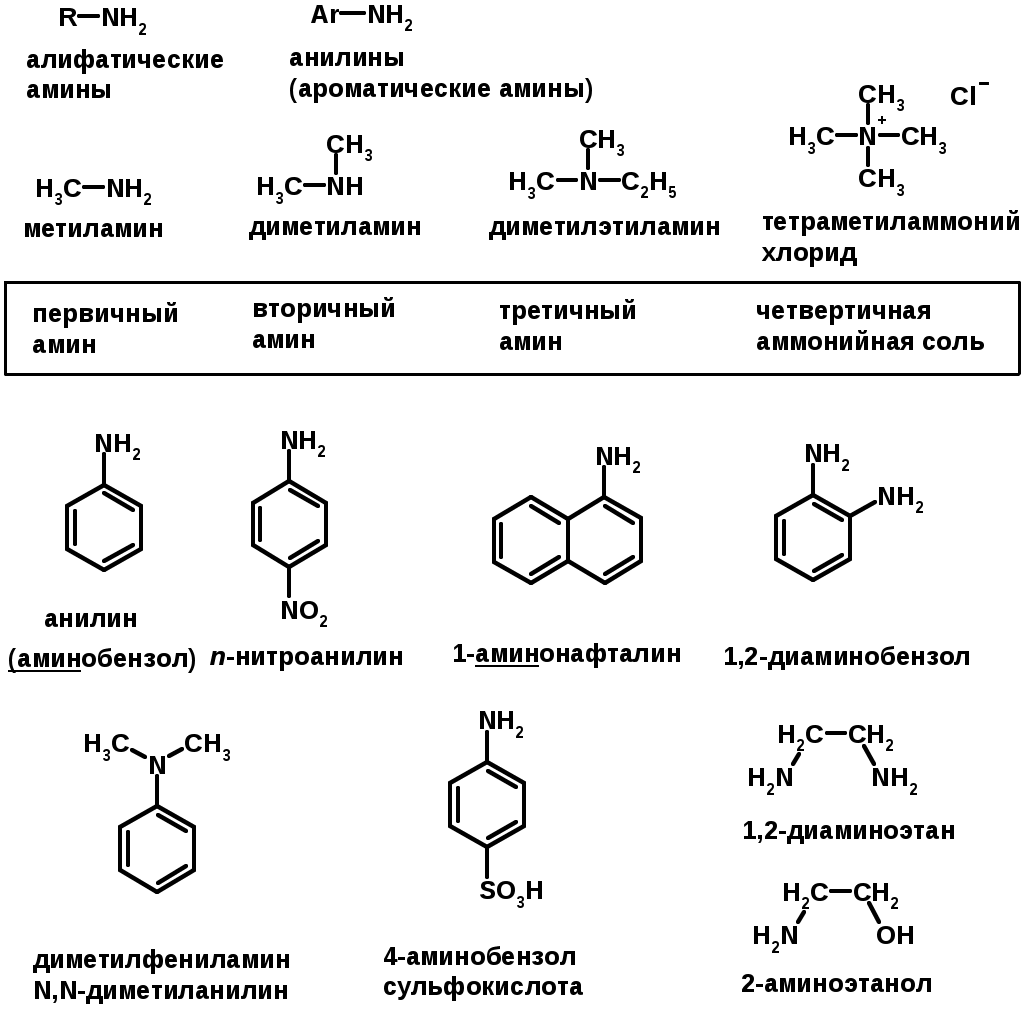 Методы получения1. Алкилирование аммиака  2. Восстановление нитросоединений 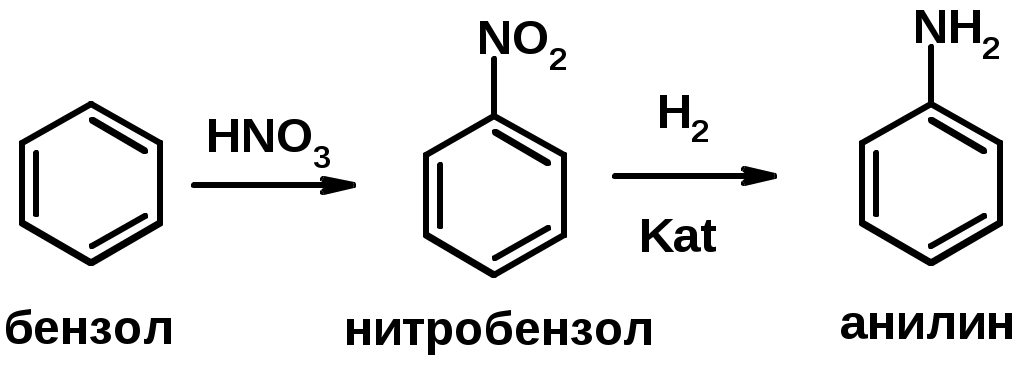 3. Восстановление амидов 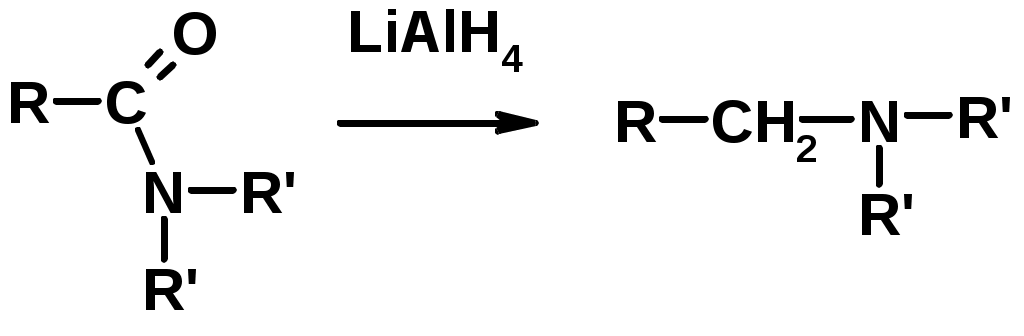 4. Восстановление нитрилов 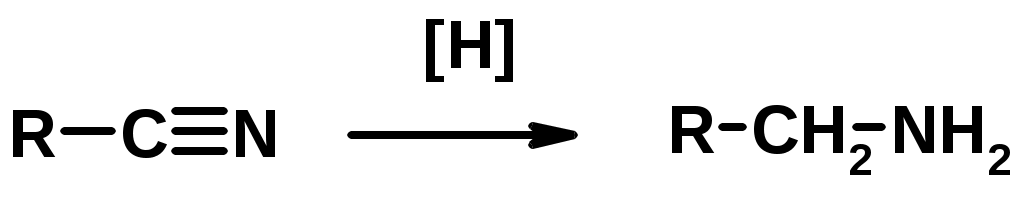 1. Кислотно-основные сойства 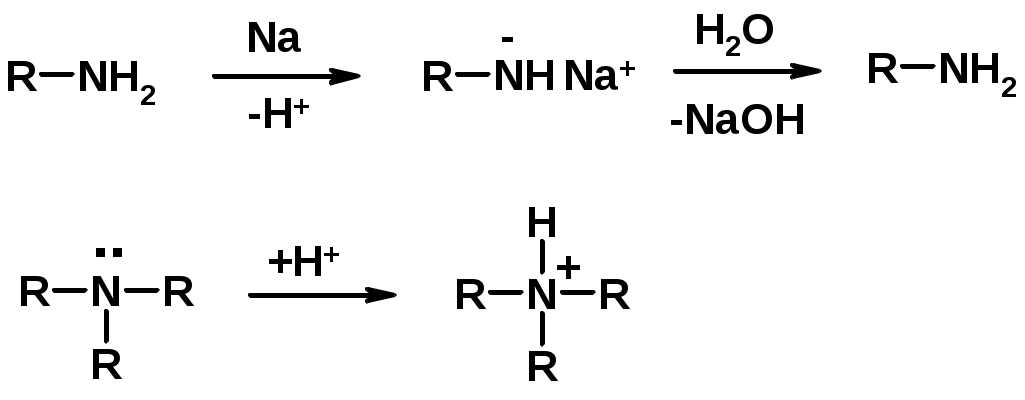 Основность – способность принимать протон или отдавать пару электронов Основность амина тем выше, чем выше электронная плотность на азоте. Донорные заместители у азота повышают электронную плотность на азоте, а значит повышают основность амина. Акцепторные заместители у азота понижают электронную плотность на азоте, а значит понижают основность амина.  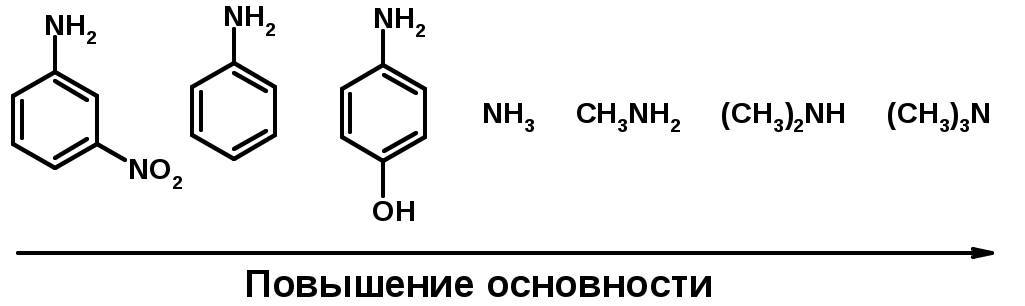 2. Алкилирование (см. получение аминов, способ 1) 3. Ацилирование  4. Реакции с карбонильными соединеиями (образование иминов) 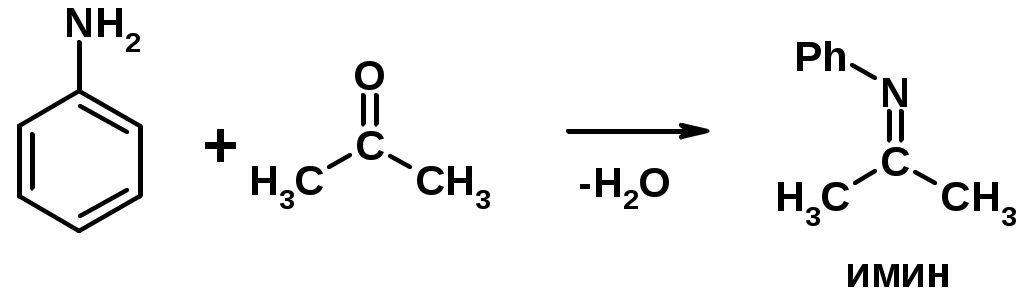 5. Электрофильное ароматическое замещение амино-группа – заместитель I рода (ацилирование и алкилирование не меняют ориентирующий эффект) 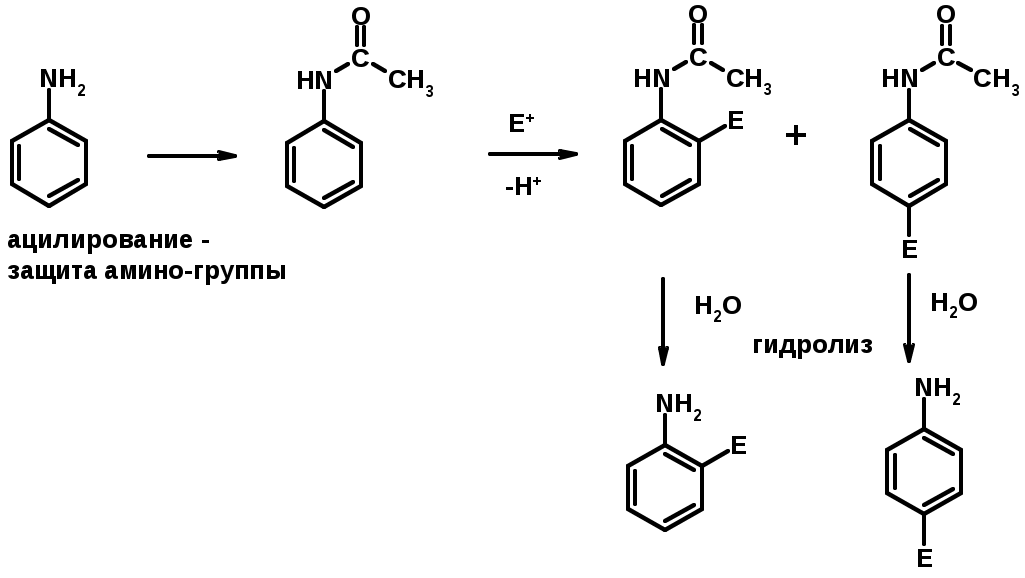 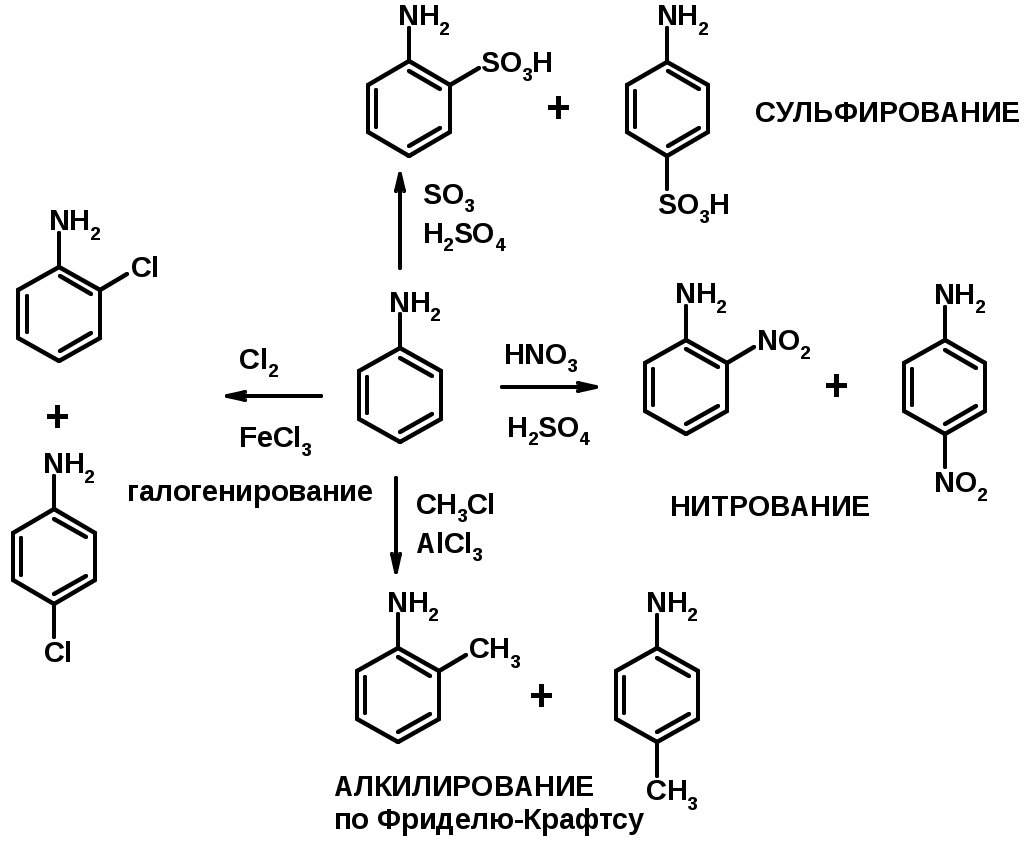 6. Реакции с азотистой кислотой Третичные амины разлагаются под действием азотной кислоты Вторичные амины образуют нитрозоамины 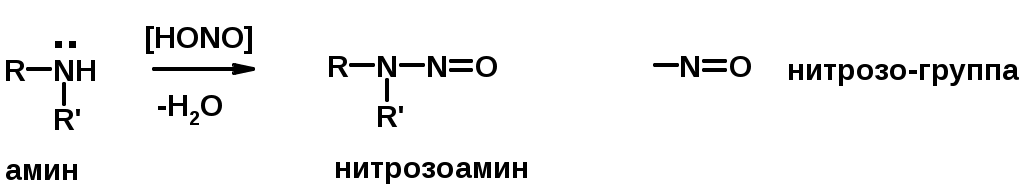 Первичные амины 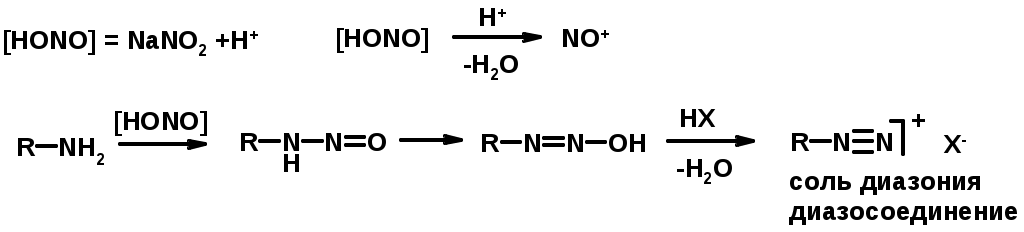 Диазосоединеия алифатического ряда крайне неустойчивы и разлагаются с выбросом молекулярного азота. Образующийся карбокатион рекомбинируется, реагируя с нуклеофилами 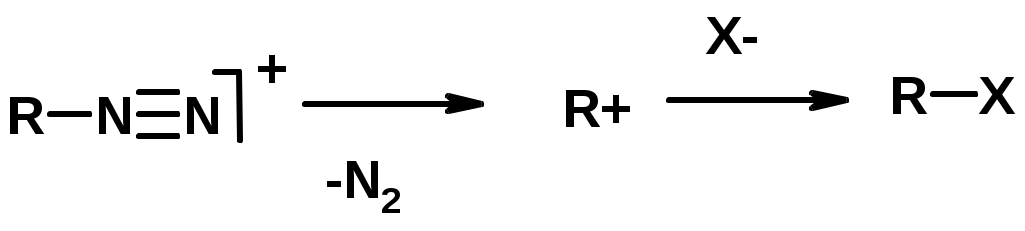 Ароматические первичные амины реагирут с азотистой кислотой с образованием солей диазония. В этом случае +МPh приводит к делокализации положительного заряда и стабилизирует соль диазония 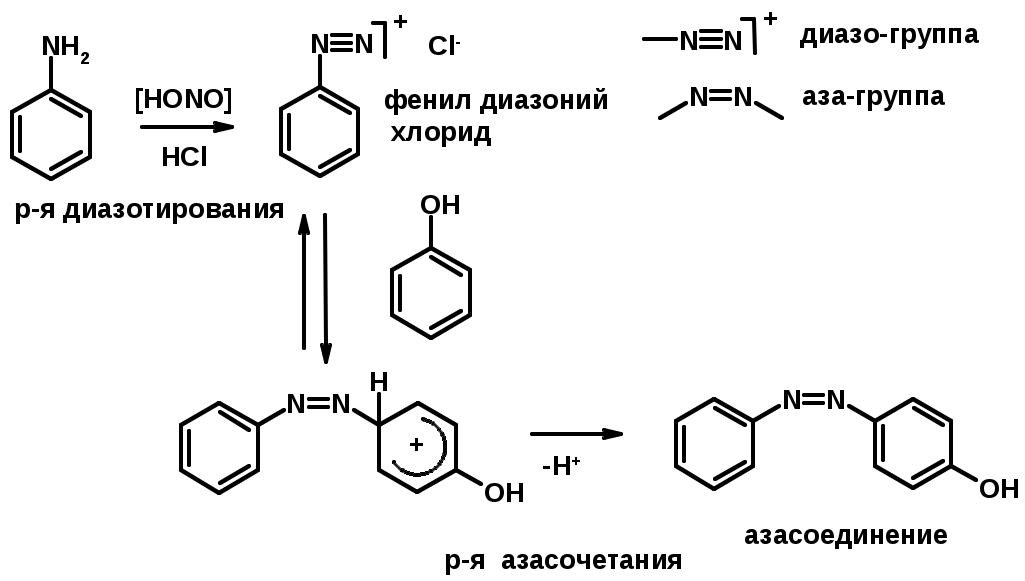 Синтез метилоранжа 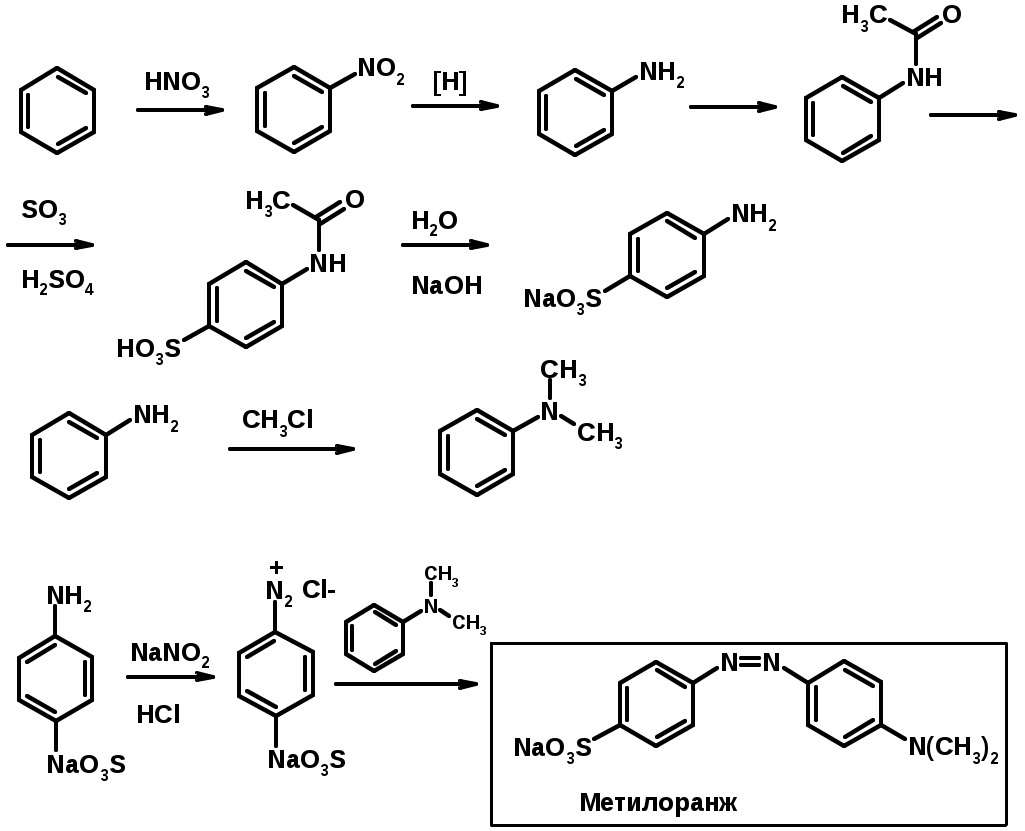 Красители и теория цветности
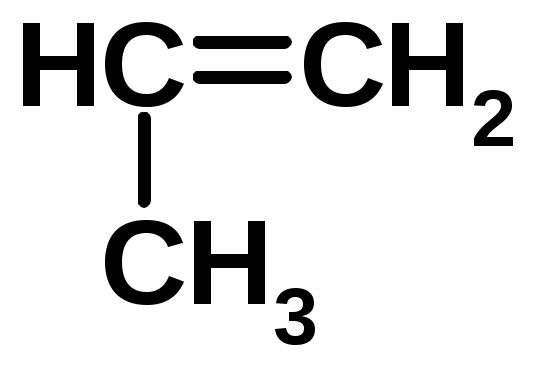
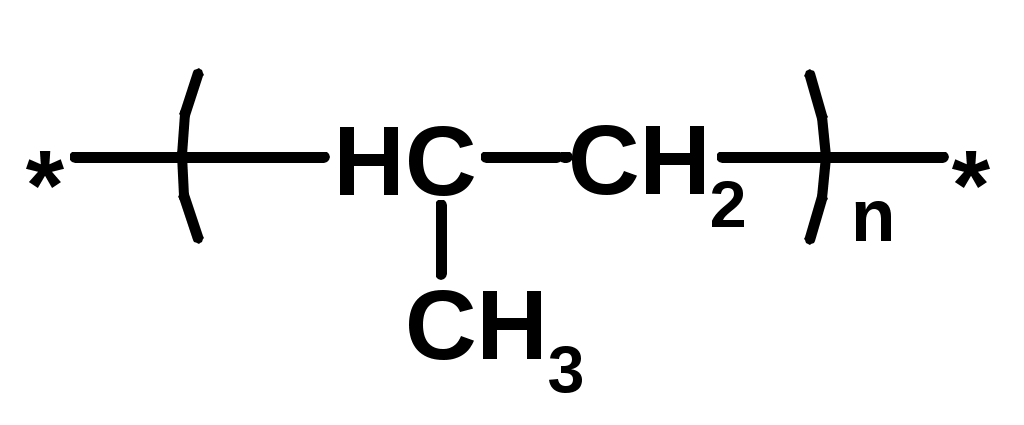
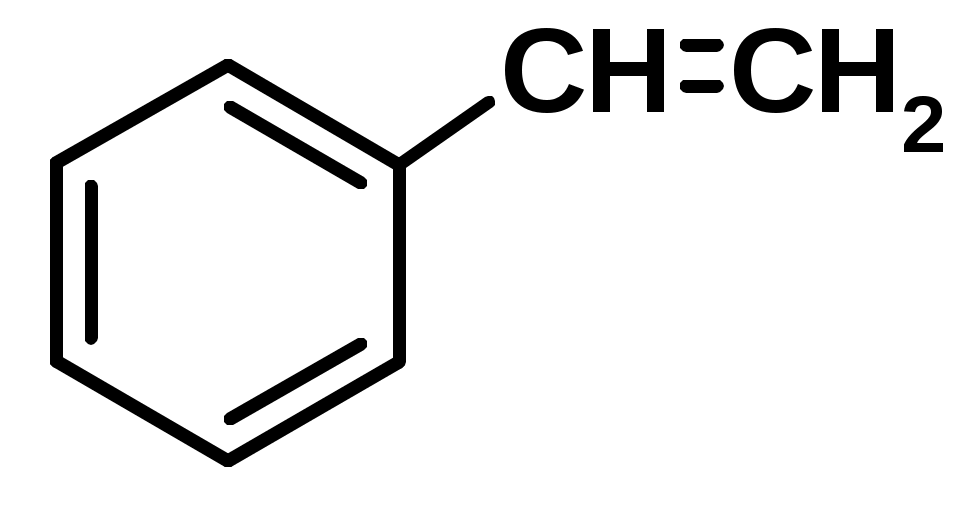
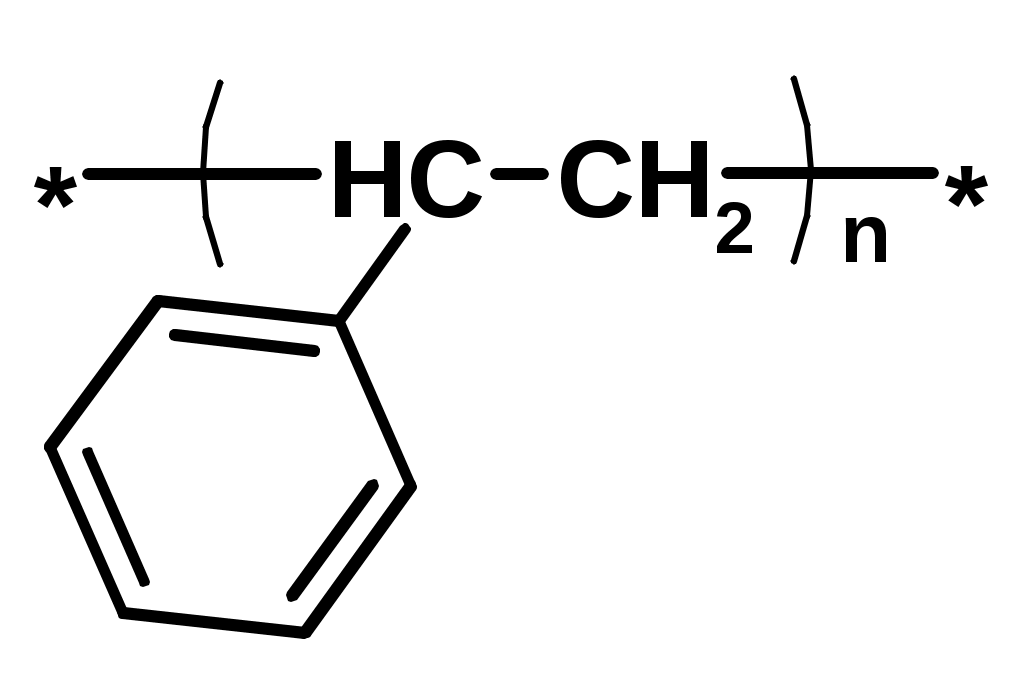
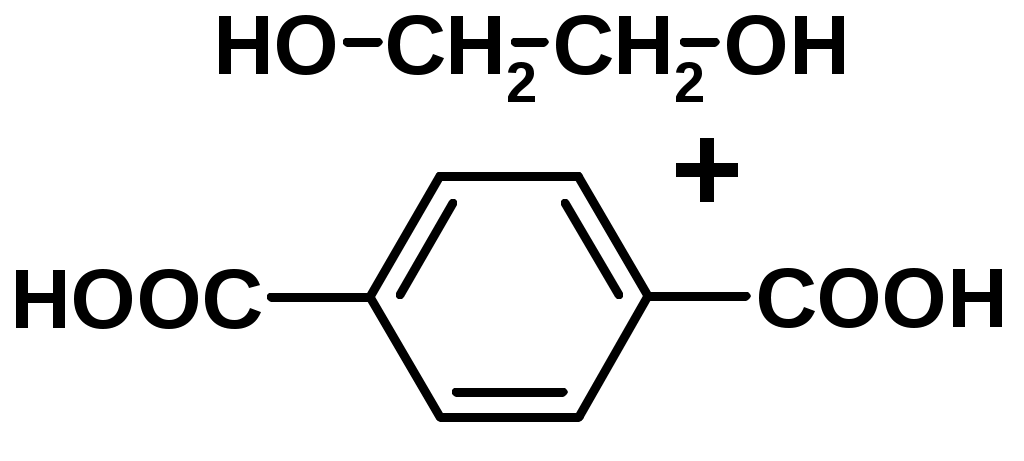
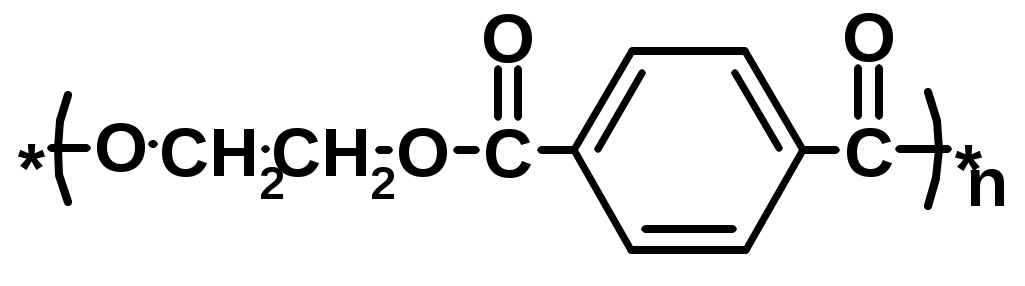
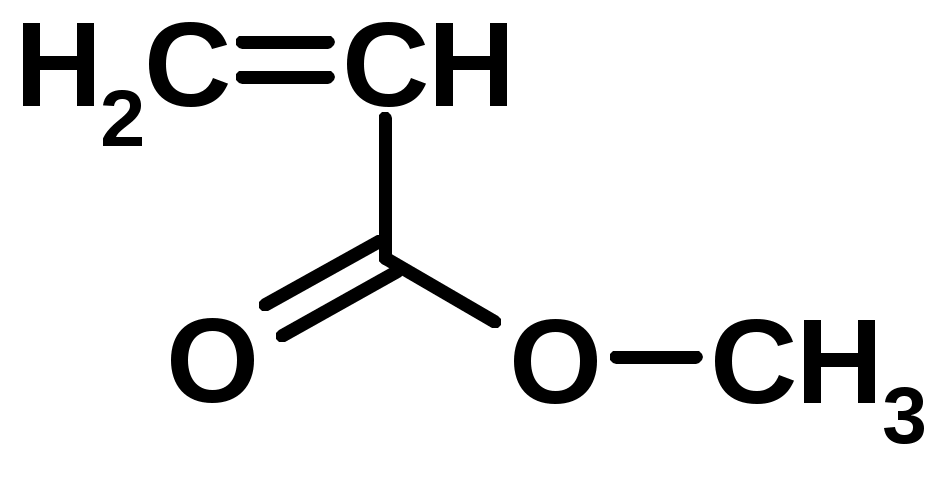
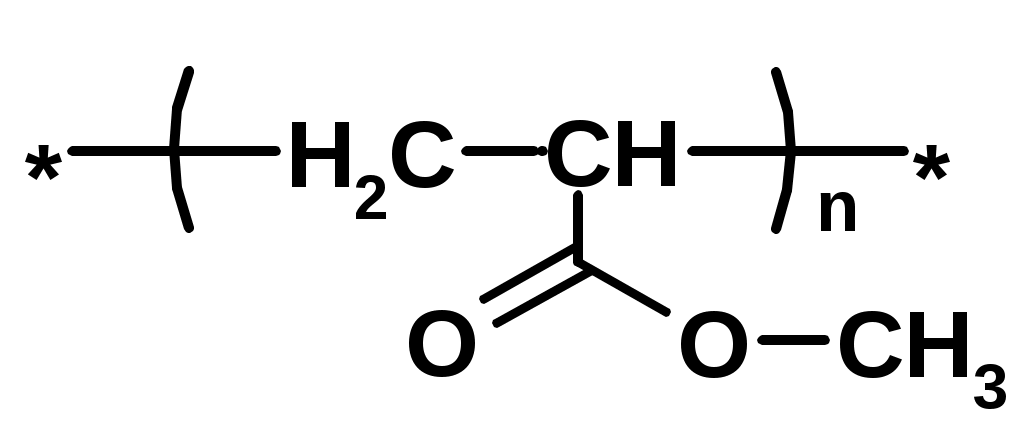
Хромофор – группа, вызывающая появление цвета (содержит -связь) 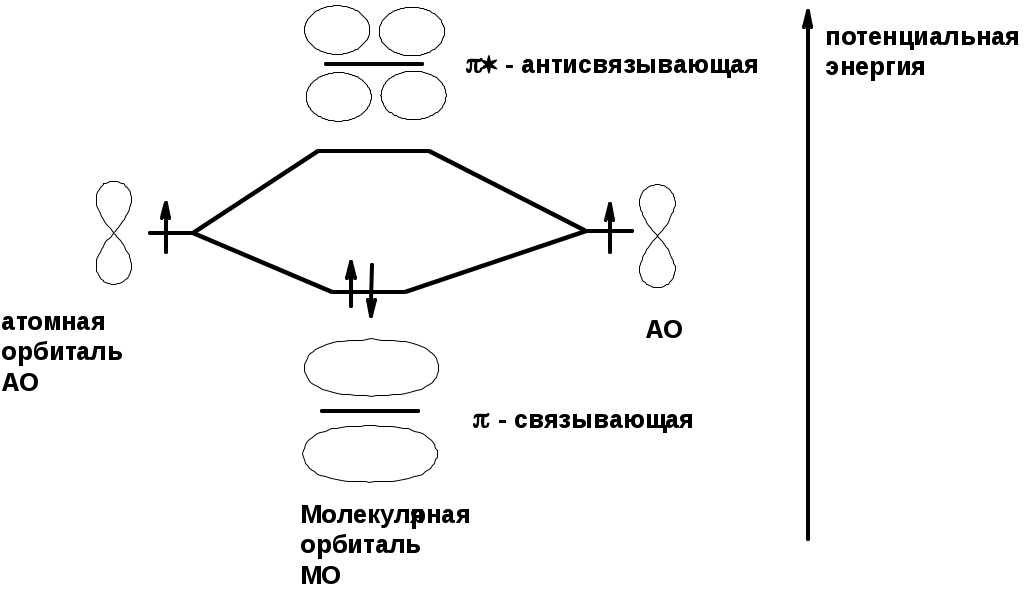 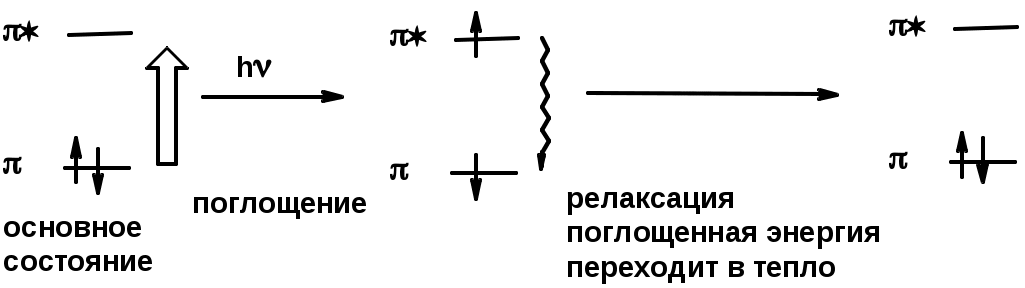  Синтетические полимерыПолимер – макромолекула, построенная из одинаковых повторяющихся фрагментов (мономерных единиц). Мономер – исходное для полимера низкомолекулярное вещество – определяет строение всего полимера. Полимерная цепь может состоять из повторяющихся фрагментов одного типа или нескольких разных типов. В последнем случае говорят о сополимере. 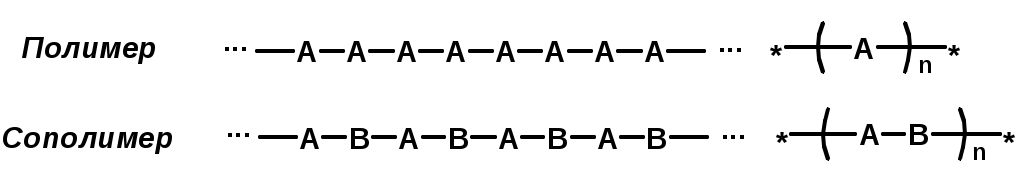 Типы полимеров: Термопласт – полимер, способный легко менять форму при нагревании (полиэтилен, полипропилен, полиэтилентерефталат, полистирол ….) Эластопласт – способен растягиваться в несколько раз и обратимо восстаннавливать форму после снятия деформирующего усилия (каучуки, резины) Реактопласт – полимер, в котором при обработке протекают необратимые реакции дополимеризации, что делает невозможность их дальнейшей термической деформации (обработки) Наиболее часто встречающиеся полимеры
Химия поверхностно-активных веществ (ПАВ)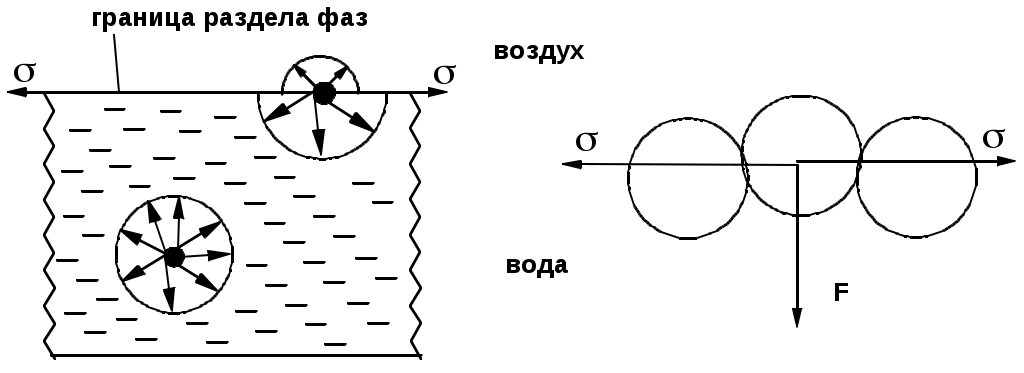 ПАВ – уменьшают поверхностное натяжение Молекула ПАВ – дифильная молекула, имеет гидрофобный (липофильный) неполярный хвост (нерастворим в воде) - длинная углеводородная цепочка (С12 - С18) и гидрофильную полярную голову (растворима в воде) – функциональная группа, обладающая сродством к воде. 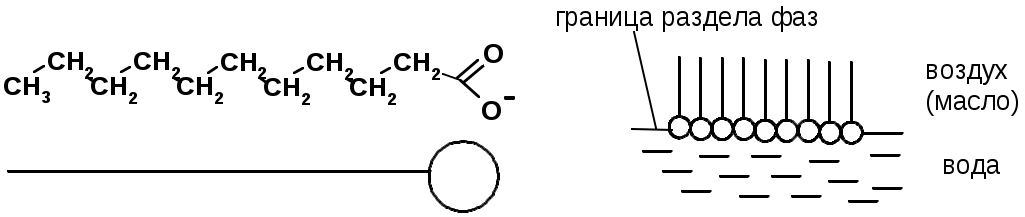 Типы ПАВ: Неионогенные – не диссоциируют на ионы 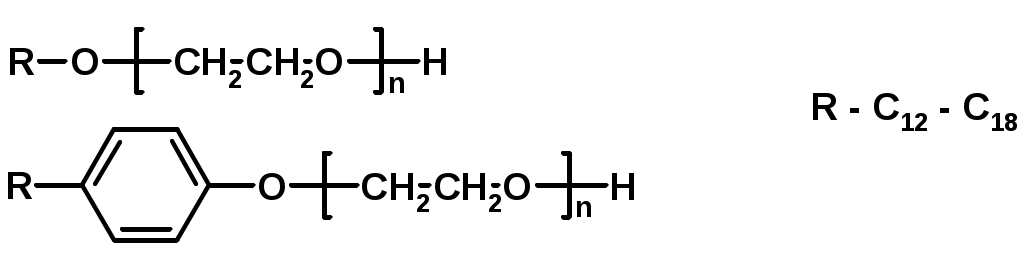 Ионогенные – диссоциируют в растворе на катионы и анионы: Анионные – образуют дифильные анионы  Катионные – образуют дифильные катионы 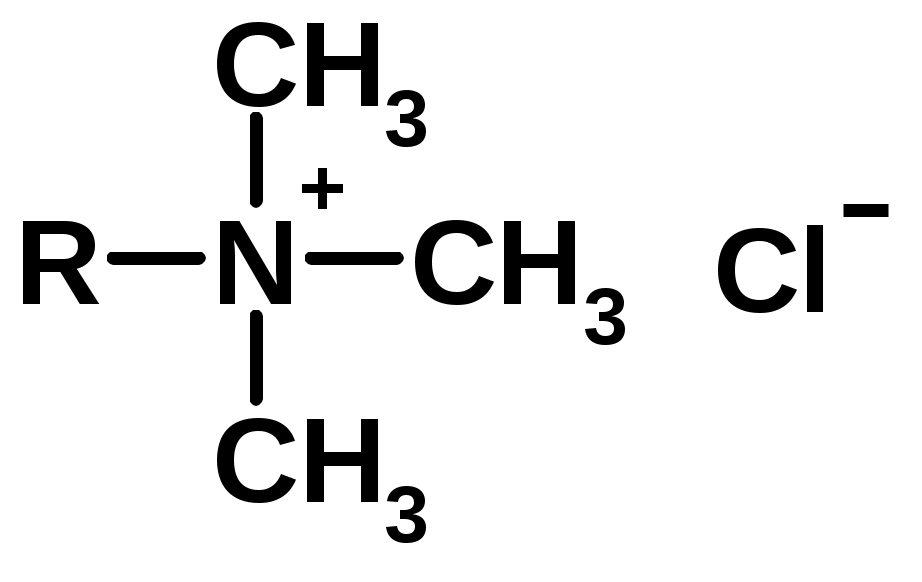 Амфолитные (амфотерные) 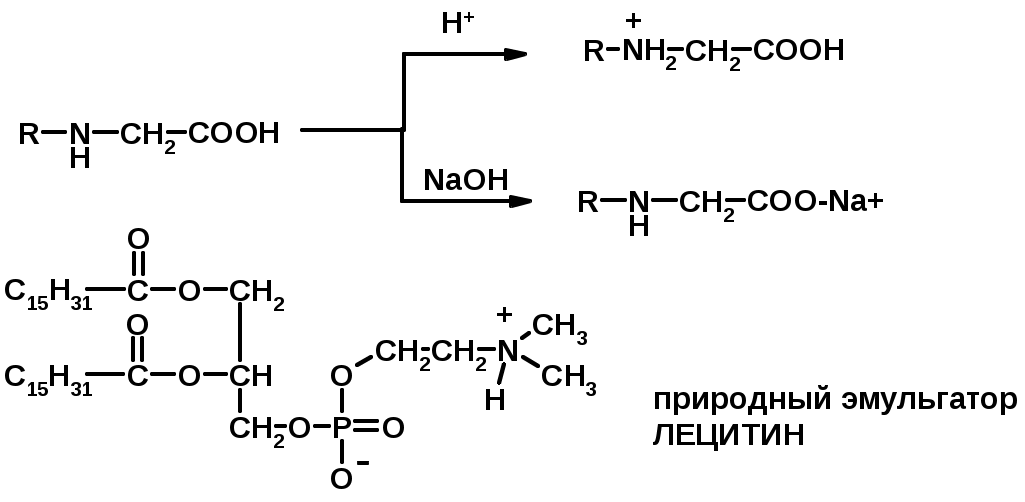 ПАВ – как моющие средства 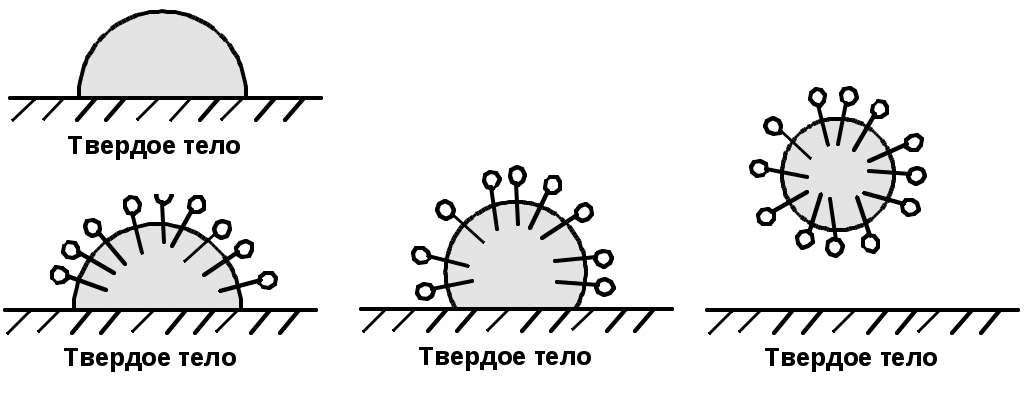 Образование эмульсий 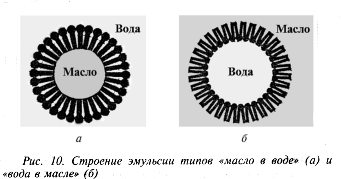 |