Лек 1. Лекции Введение 1 Формирование органической химии как науки
 Скачать 142.5 Kb. Скачать 142.5 Kb.
|
|
ЛЕКЦИЯ 1 Схема лекции 1. Введение 1.1 Формирование органической химии как науки 1.2 Теория химического строения 1.3 Органический синтез 2. Классификация органических соединений 2.1 Классификация органических соединений 2.2 Два принципа классификации органических соединений 1. ВВЕДЕНИЕ 1.1 Формирование органической химии как науки. Органическая химия изучает соединения углерода – углеводороды и их производные, в состав которых могут входить почти все элементы периодической системы. По определению немецкого химика Шорлеммера: органическая химия – это химия углеводородов и их производных. Выделение органической химии в самостоятельную научную дисциплину обусловлено большим числом и многообразием соединений углерода, наличием специфических свойств, отличающих их от соединений других элементов, и наконец, их исключительным значением в жизни человека. В настоящее время известно более 10 миллионов органических соединений, в то время как соединений неорганических всего около 700 тысяч. Превращения органических соединений управляются общими законами химии, а также специфическими закономерностями, характерными только для органических соединений. Органические соединения обычно менее стойки, чем неорганические, легче окисляются (горят), подавляющее большинство из них имеет только ковалентные связи между атомами. Особое положение органической химии в системе наук обусловлено ещё и тем, что она изучает более высокоорганизованную материю, чем неорганическая химия, и тесно связана с биологией: органические вещества появились на Земле позже неорганических, они являются носителями жизнедеятельности. Но не этим определяется исключительное значение органической химии. Органические соединения составляют основу многих отраслей химической промышленности (пластических масс, синтетического каучука и резины, моторного топлива и смазочных материалов, растворителей, лаков и пигментов, красителей для волокна, медикаментов, взрывчатых веществ, текстильных, кожевенных и пищевых материалов и т.д.) и широко используются в производстве. Открытие закона сохранения материи (М.В. Ломоносов и А.Л. Лавуазье), позволило химикам определить состав молекул органических веществ и выразить его в виде эмпирических (или молекулярных) формул, отражающих число атомов различных элементов, входящих в состав молекул. Во времена Ломоносова, Лавуазье и Берцелиуса химики полагали, органические вещества образуются только в живых организмах под действием «жизненной силы». Однако эксперименты показали ошибочность подобной концепции. В 1824г Фридрих Велер получил из дициана – неорганического вещества органическое вещество – щавелевую кислоту: 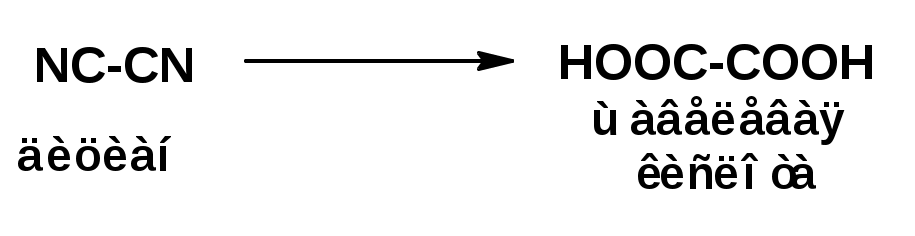 Далее тот же Фридрих Велер получил из явно неорганического вещества - аммонийной соли циановой кислоты явно органическое вещество – мочевину:  Дальнейшее развитие органической химии было связано с появлением теорий типов и радикалов. На основании их можно было вывести формулы многих органических соединений. Однако они не имели предсказательной силы. Первая треть ХIХ ознаменовалась подъемом органической химии. Но при этом химики заметили, что иногда вещества, обладающие одинаковыми эмпирическими формулами, обладают различными физическими и химическими свойствами. Объяснение данному факту дала теория химического строения. 1.2 Теория химического строения. В 1858 г шотландский химик А. Купер предложил обозначать черточками связи между атомами в молекулах органических соединений. В 1961 г русский химик А.М. Бутлеров сформулировал понятие «химическое строение». Развитие представлений о химическом строении привело к созданию А.М. Бутлеровым теории химического строения. Основные положения этой теории сводятся к следующему: 1. Химическая природа каждой молекулы определяется природой составляющих ее атомов, их количеством и химическим строением. 2. Химическое строение – это определенный порядок в чередовании атомов в молекуле и взаимное влияние атомов друг на друга. 3. Химическое строение веществ определяет их физические и химические свойства. 4. Изучение свойств веществ позволяет определить их химическое строение. Первым практическим следствием теории химического строения явились структурные формулы, с помощью которых можно отразить строение молекулы сочетанием символов атомов и черточек, обозначающих химические связи. При этом всегда следует придерживаться следующих правил: 1. Атомы углерода в молекулах органических соединений всегда четырехвалентены: 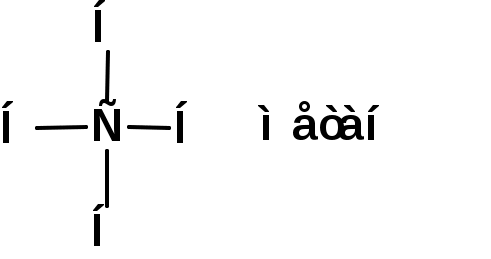 2. Атомы углерода в молекулах органических соединений способны образовывать цепи: 3. Атомы углерода в молекулах органических соединений могут быть соединены двумя и тремя связями: 4. Атомы углерода в молекулах органических соединений могут образовывать циклы: 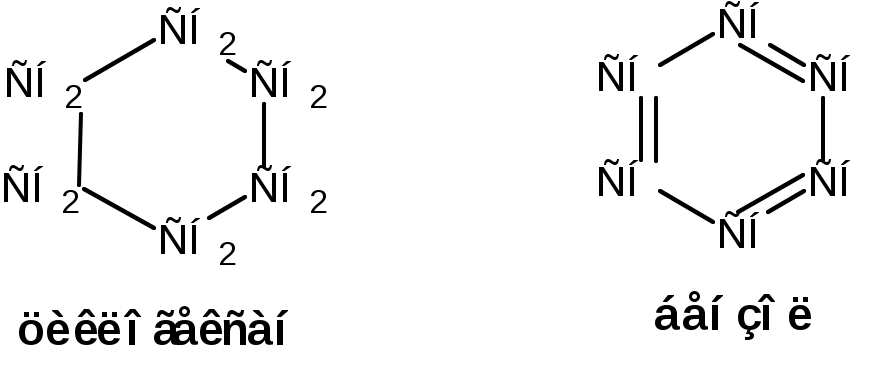 5. Атом или группа атомов, определенным образом соединенные друг с другом и придающие молекулам органических соединений характерные свойства называются функциональными группами. В 70-х годах XIX в. Теория стоения дополнилась теорией пространственного расположения атомов в молекулах – стериохимической теорией (Я. Вант-Гофф, Ж.Ле Бель). Она ввела представление о тетраэдрическом строении насыщенных соединений углерода и определила явление оптической изомирии как свойство соединений (оптических изомеров), в молекулах которых атом углерода связан с четырьмя различными заместителями.  В отличие от структурных изомеров оптические изомеры имеют одинаковые физические и химические свойства и одинаково реагируют с симметричными молекулами. В начале 20 века в органическую химию были введены электронные представления о химической связи и структуре соединений. Согласно им химическая связь – это совместное владение парой электронов двумя атомами, которые образуют эту связь. Были даны объяснения неполярным и полярным связям, смещению электронов, в последних вследствие разной электроотрицательности атомов, перераспределению этих смещений по всей молекуле. Были введены понятия об индукционном (±J) и конъюгационном (±С) механизмах перераспределения электронов, механизмах влияния заместителей на реакционную способность реакционного центра. В настоящее время разработаны два современных метода описания химической связи – метод валентных связей (ВС) и молекулярных орбиталей (МО). Оба метода исходят из одной отправной точки – в образовании химической связи участвуют атомные орбитали (s-, p-, d-, f- АО). Главное отличие этих методов заключается в том, что в методе ВС в атомные орбитали образующих связь атомов, помещают два электрона, а затем их приближают друг к другу до образования химической связи. В методе МО из атомных орбиталей составляют молекулярные орбитали, а затем их заполняют электронами. Оба метода используются для описания как локализованных (между двумя отомами) и делокализованных (между более чем двумя атомами) связей. Разработана современная теория химической реакции – теория возмущения МО. Она выясняет, что происходит с энергией системы, когда при образовании химической связи электроны донора переходят в свободные орбитали акцептора. Согласно этой теории многие химические реакции рассматриваются как одно- или двухсторонние донорно-акцепторные взаимодействия (ДАВ), которые протекают через ациклический или циклический интермедиаты:  1.3 Органический синтез С древнейших времён люди использовали природные органические вещества и получали из них различные продукты, например, спиртные напитки (вино, пиво, «мёд»), уксус, органические красители (пурпур, индиго, ализарин), эфирные масла, сахар и др. Затем научились видоизменять эти вещества и воспроизводить природные процессы в условиях, отличных от природы. И уже значительно позже стали получать не существующие в природе вещества и материалы и изучать механизмы химических процессов. Одним из первых методов переработки природных веществ была перегонка. С её помощью, например, из уксуса была получена уксусная кислота (IX в.) из бродящих жидкостей - этиловый спирт (XI в), а затем из спирта – перегонкой с серной кислотой – этиловый эфир (XVI в), из природных смол – янтарная и бензойная кислоты. Впоследствии научились выделять нужные вещества методами кристаллизации, перегонки с паром и др. Теория химического строения способствовала бурному развитию органического синтеза. Этим понятием химики стали определять последовательность превращений тех или иных органических веществ для получения целевого продукта. С применением бензола в качестве сырья во второй половине XIX в. Были получены многие полезные продукты: лекарства, красители, душистые вещества.    В 20-е годы прошлого века важное значение в качестве сырья для органического синтеза приобрели продукты переработки нефти. В частности этилен оказался ценным сырьём для производства полиэтилена, поливинилхлорида, этилового спирта, ацетальдегида, уксусной кислоты.  Из 1,3- бутадиена химики научились получать синтетический каучук.  Первые схемы органического синтеза были не очень сложны. Однако чтобы проводить и сравнительно простые синтезы, химики должны были анализировать органические вещества. Основоположником анализа органических веществ явился Ю. Либих. Предложенные им методы элементного анализа (1831 – 1833 гг.) в различных вариантах применяют в настоящее время. Все они основаны на сожжении навески вещества (порядка нескольких миллиграмм) измерения количеств образовавшихся продуктов (СО2, Н2О, N2). В последующем для установления строения органических соединений стали широко привлекать и спектральные методы. Спектральные методы оказались незаменимы, когда химики приступили к изучению витаминов, гормонов и других сложнейших структур, играющих важную роль в жизнедеятельности животных и растений. Например, из растений были выделены многие вещества, способные оказывать сильное действие на организм человека. Характерным примером является установление строений соединений, содержащихся в табаке: никотина, норникатина, анабазина.  Эти вещества были не только выделены, но и тщательно изучены. В небольших количествах никотин является наркотическим средством, действует как возбудитель центральной и периферической нервной системы. Установлено вместе с тем, что никотин и крайне токсичен: смертельная доза для человека составляет -40 мг. Его опасность особенно очевидна, если иметь, в виду, что некоторые сорта табака содержат в листьях от 2 до 8 мас. % никотина, а сам никотин при курении в значительном количестве присутствует в табачном дыме. Была установлена роль в организме человека и разработаны методы синтеза многочисленных витаминов и гормонов. Найдено, например, что гормоны – вещества, которые вырабатываются организмом или поступают в него извне в очень небольших количествах, но поддерживают его нормальное функционирование, действуя как носители информации и регуляторы биохимических процессов. В частности, половые гормоны обладают очень мощным физиологическим действием и обычно присутствуют в организме лишь в ничтожном количестве (в микрограммах).  Решение экологических проблем – проблем охраны окружающей среды – химики ищёт на пути создания новых, более избирательных и эффективных реагентов и новых, более селективных методов синтеза. Возможности органической химии в настоящее время практически неограниченны как в области синтеза сложнейших природных структур, так и в области расчёта и моделирования свойств органических молекул и макромолекул. 2. Классификация органических соединений 2.1 Классификация органических соединений К настоящему времени известно более 10 млн. органических соединений. Каждый год химики синтезируют и выделяют из природных источников сотни тысяч новых соединений. Чтобы ориентироваться в этом многообразии, органические соединения принято классифицировать. 2.2 Два принципа классификации органических соединений Имеются два принципа классификации: По родоночальной структуре (по строению главной цепи атомов), т.е. по строению углеродной цепочки – по расположению атомов в молекуле. По функциональным или характеристическим группам (по характерным элементам – заместители, связанные с атомами углерода и типы связей в цепи углеродных атомов), таким как:NO2, NO, N=N, RO, RS. Согласно первому принципу все органические соединения делятся на; а) ациклические, т.е. нециклические (CH2=CH2 – этилен, C2H5OH – этиловый спирт, этанол) б) циклические. Циклические в зависимости от природы атомов входящих в цикл делятся на: - карбоциклические: в цикле только атомы углерода. Например,  -гетероциклические – в гетероцикл входит хотя бы один не углеродный атом – гетероатом.  Карбоциклические соединения в свою очередь делятся на; - алициклические – это различные циклические углеводороды и их производные с различной величиной цикла и числом циклов и разным числом двойных связей, кроме шестичленных с тремя двойными связями.  - ароматические или арены – циклические углеводороды и их производные, построенные из шестичленных циклов с тремя двойными связями:  Согласно второму принципу классификации в зависимости от природы функциональной характеристической группы и по характеру связи углерод-углерод, органические соединения делятся на классы функциональная группа – это атом или группа атомов, которые определяет основные свойства группы соединений. В пределах класса, соединения конечно будут различаться по своей реакционной способности, но главные химические свойства будут одинаковыми.  Характеризуются подвижностью водорода в гидроксиле. Однако в зависимости от R или Ar подвижность будет различна: спирты очень слабые кислоты, фенолы – более сильные кислоты. По количеству функциональных групп можно разделить на следующие классы: а) монофункциональные – с одной функциональной характеристической группой б) полифункциональные – с двумя и более характеристическими группами. |
