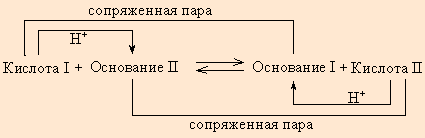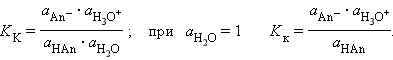Лекция 10 Кислотноосновные свойства органических соединений
 Скачать 69.82 Kb. Скачать 69.82 Kb.
|
|
Лекция № 10 Кислотно-основные свойства органических соединений. Для описания кислотно-основных свойств химических соединений, существует несколько теорий. Наиболее распространённой является теория Бредстена – Лоури или протолитическая теория. По теории Бредстена –Лоури кислотой называют вещество способное отдавать протон; а основанием – вещество, способное принимать протон. Теоретически любое соединение, в состав которого входит атом водорода, может его отдать в виде протона и следовательно, проявлять свойства кислоты. Способность отдавать протон могут не только нейтральные молекулы, но и заряженные частицы- катионы и анионы. Любое вещество в определенных условиях может проявлять свойства кислоты и основания по отношению к какому-либо другому веществу, включая и растворитель. Со времен Аррениуса, по определению которого кислоты в водных растворах диссоциирует на ионы водорода и анионы, а основания диссоциируют на гидроксид-ионы и катионы, круг веществ, участвующих в реакциях кислотно-основного равновесия, значительно расширился. Общепринятными считаются протонная теория Бренстеда–Лоури и электронная теория Льюиса. Протонная теория Бренстеда–Лоури применима лишь к протонсодержащим или протонприсоединяющим веществам. Согласно этой теории кислотой называется вещество, способное быть донором протонов, а основанием – вещество, которое может присоединить (акцептировать) протон:
По определению, HAn – кислота, An– – основание, сопряженное с этой кислотой. Любой кислоте соответствует сопряженное с ней основание.
Любое кислотно-основное равновесие включает взаимодействие двух пар сопряженных кислот и оснований.
В определенных условиях многие вещества могут вести себя как кислота или как основание. Эти два понятия неразделимы, а потому правильнее говорить о кислотно-основных свойствах данного вещества. В соответствии с законом действующих масс константы равновесия реакций протолиза сопряженных кислот и оснований в воде связаны между собой простым соотношением
Перемножив константы сопряженных кислот и оснований, получим
Заменив активности
Произведения констант диссоциации сопряженных кислот и оснований в водных растворах равно ионному произведению воды. По известным KK(Kосн) можно легко найти значения сопряженных KВ. Органические соединения с позиции кислотности описываются общими теориями, например Бредстена. В тоже время органические соединения, как кислоты и как основания, обладают многими специфическими свойствами. Одним из них является существенное изменение кислотности и основности в гомологическом ряду. Для органических соединений нельзя сделать однозначное утверждение, что все представители этого класса являются сильными кислотами, основаниями. Можно говорить лишь о возможности проявления кислотных свойств, например спиртов. Первые представители гомологического ряда спиртов проявляют заметные кислотные свойства, но при переходе к высшим гомологам эти свойства постепенно ослабевают. Другой особенностью является то, что в силу большого количества органических соединений, невозможно для каждого из них дать количественную характеристику кислотных и основных свойств. Поэтому в органической химии часто используют путь сравнения свойств одного соединения с другим, для которого такие количественные характеристики известны. Кислоты В органических соединениях атом водорода может быть связан с такими элементами как: S, O, N, C. Элемент и связанный с ним атом водорода называют – центром кислотности. По центрам кислотности органические соединения подразделяются: -SН, -OН, -NН, -CН кислоты.
Как правило, органические соединения проявляют слабые кислотные свойства. Это значит, что они не взаимодействуют с водой как с основанием по уравнению при растворении в воде не диссоциирует на ионы, а остается нейтральным соединениям. СН3СООН + Н2О = СН3СОО- + Н3О+ Для качественной оценки силы кислоты используются критерии – стабильность аниона сопряженного основания, образующегося в результате отрыва протона. Чем стабильней анион, тем сильнее кислота. Стабильность аниона определяется степенью делокализации заряда. При этом учитываются следующие факторы: Электроотрицательность элемента отдающего протон. Поляризуемость атома, отдающего протон Электронные эффекты УВ и заместителей в них Способность аниона к сольватации, т.е. взаимодействию с молекулами растворителя. Эти факторы рассматриваются в совокупности. Э.О. Чем больше э.о. элемента в кислотном центре, тем сильнее он притягивает к себе общую пару ионов и тем сильнее поляризована его связь с атомом водорода, тем больше вероятность гетеролитического разрыва связи с образованием Н+. Зависимость выполняется для элементов одного периода. Поляризуемость элемента кислотного центра большее значение, чем его э.о. Тиолы более сильные кислоты, т.к. атом S за счет большей по объему электронной оболочки (большей поляризуемости) легче распределяет (делокализует) заряд, чем атом О. Электронные эффекты радикала. УВ радикал, связанные с кислотным центром, будут способствовать делокализации отрицательного заряда, если они обладают электроноакцепторным действием.   рКа NO2 CH2COOH CH3 COOH 1,7 4,7 1,7 Электронный акцептор способствует делокализации отрицательного заряда, повышает кислотность. Способность аниона к сольватации.   Влияние растворителя на кислотность вещества может быть значительным. Очень часто растворитель вода. В процессе растворения происходит взаимодействие между растворителем и растворенным веществом. Влияние растворителя на кислотность вещества может быть значительным. Очень часто растворитель вода. В процессе растворения происходит взаимодействие между растворителем и растворенным веществом.   NaCl = Na+ + Cl- NaCl = Na+ + Cl- процесс гидратации (сольватации) Чем эффективнее сольватируется анион, тем более он устойчив. Небольшие по размеру анионы лучше, чем анионы с разветвлённым УВ радикалом.    Учитываются все факторы, можно сказать, что кислотность органических соединений падает в ряду: SH OH NH CH кислоты, в этом ряду не учитываются карбоновые кислоты, проявляющие самые сильные кислотные свойства. Учитываются все факторы, можно сказать, что кислотность органических соединений падает в ряду: SH OH NH CH кислоты, в этом ряду не учитываются карбоновые кислоты, проявляющие самые сильные кислотные свойства.Основания – органические соединения, содержащие атомы S, O, N могут выступать роли оснований, присоединённый протон, за счет пеподеленной пары электронов на внешней оболочке. Гетероатом в молекуле органического вещества, присоединяя протон, называется центром основности. В результате присоединения протона к нейтральной молекуле образуется ониевые соединения.   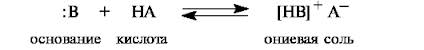 сопряженная система сопряженные основания
S, O, N– центр основности. Сила основания определяется стабильностью образующегося катиона (сопряженной кислоты). Чем стабильнее катион, тем сильнее основание. Стабильность катиона определяется суммой тех же факторов, что и стабильность аниона, но влияние этих факторов противоположно влиянию на кислотность. Например, наличие УВ радикала электродонорных заместителей будет способствовать стабилизации катиона и повышать силу основания. Электроакцепторные заместители будут дестабилизировать катион и уменьшать основность соединения. Исходя из природы атомов S, O, N, можно сделать вывод, что наиболее э.о. атом О (кислорода) за счет более прочного удерживания неподеленной пары электронов менее склонен присоединять протон по сравнению, например, с атомом N(азота). Амины – более сильные основания, чем спирты. Электроны атомов S и N, удерживаются ядром и более доступны для связи с протоном, однако у атома S электронная плотность рассредоточена в большем объеме по сравнению с атомом O и N. Плотность заряда становиться меньшей и атом S слабее связывает протон, поэтому тиолы более слабые основания, чем амины и спирты. Кислотные и основные свойства органических соединений будут неотъемлемым элементом при изучении химических свойств, различных классов и групп органических веществ. |