Лекция 13 Уравнение состояния идеального газа. Молярная газовая постоянная. Газовые законы
 Скачать 1.83 Mb. Скачать 1.83 Mb.
|
|
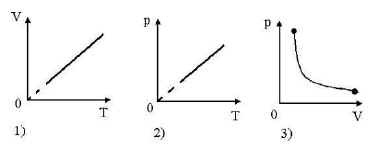
Лекция 13 Уравнение состояния идеального газа. Молярная газовая постоянная. Газовые законы.  Задание 1. Переписать лекцию 13 полностью. Задание 2. Используя материал в приложении 1 (см.ниже), заполните таблицу "Газовые законы. Изопроцессы"
Приложение 1 Изотермический процесс. Закон Бойля—Мариотта. Процесс, протекающий в газе, при котором температура остается постоянной, называется изотермическим («изос» — равный; «термос» — теплый). Почти одновременно в XVII в. французским ученым Э.Мариоттом и английским ученым Р.Бойлем была установлена зависимость давления газа от его объема при постоянной температуре. Закон Бойля—Мариотта: давление газа данной массы (m = const) при постоянной температуре изменяется обратно пропорционально его объему. Произведение давления газа на объем для данной массы газа при постоянной температуре есть величина постоянная: p1V1 = p2V2 Графически этот закон в координатах pV изображается линией, называемой изотермой . Для одной и той же массы газа разные изотермы соответствуют процессам, происходящим при различных температурах. 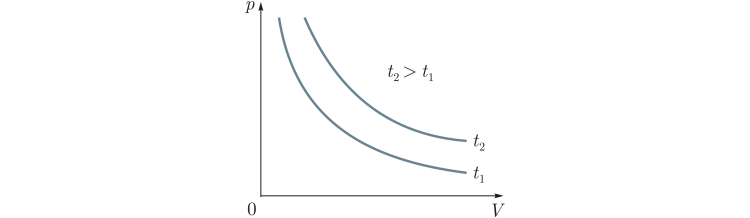 Изобарный процесс. Процесс, протекающий в газе, при котором давление остается постоянным, называется изобарным («барос» — тяжелый). Зависимость объема газа от его температуры при постоянном давлении была установлена французским физиком и химиком Л.Гей-Люссаком (1802г).Опыты, проведенные им, показали, что увеличение объема газа пропорционально приращению температуры. Закон Гей-Люссака: объем газа данной массы при постоянном давлении возрастает линейно с увеличением температуры: 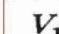 Графическая зависимость объема от температуры изображается прямой линией — изобарой. При очень низких температурах (близких к -273°С) закон Гей-Люссака не выполняется, поэтому сплошная линия на графике заменена пунктиром. 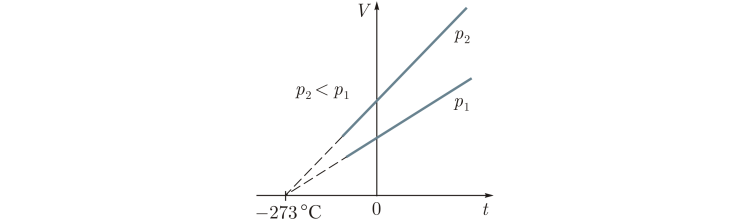 Изохорный процесс. Процесс, протекающий в газе, при котором объем остается постоянным, называется изохорным («хорема» — вместимость). Исследования зависимости давления данной массы газа от температуры при неизменном объеме были впервые проведены в 1787 г. французским физиком Ж.Шарлем. Закон Шарля: давление газа данной массы при постоянном объеме возрастает линейно с увеличением температуры  Графическая зависимость давления от температуры изображается прямой линией — изохорой 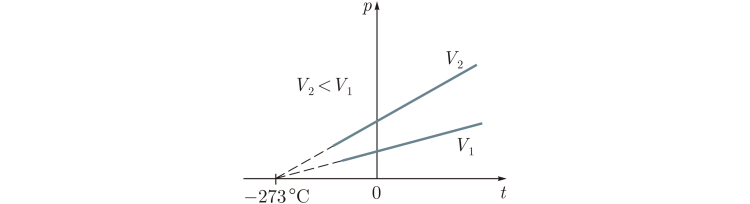 Практическая работа № 19-20 Решение задач по теме «Газовые законы»
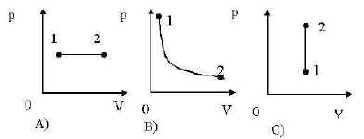
Контрольная работа № 4 по теме «Основы МКТ» Критерии оценок 9-10 правильных заданий-оценка 5 7-8 правильных заданий - оценка 4 5-6 правильных заданий-оценка 3 А1. Два газа находятся в тепловом равновесии, при этом у них имеются одинаковые физические параметры: … только температура; только средняя квадратичная скорость молекул; температура и средняя квадратичная скорость молекул; температура, давление и средняя квадратичная скорость молекул А2. Из предложенных ответов выберите уравнение состояния идеального газа… ; 2) 3) ; 4) . А3. Количество молекул в 1 моль вещества определяет… Число Авогадро; Универсальная газовая постоянная; Постоянная Больцмана. А4. Единица измерения физической величины, определяемой выражением , в международной системе… Па; 2) м3; 3) кг/моль; 4) К. А5. Для изохорного процесса в идеальном газе справедлива зависимость… 2) ; 3) ; 4) . А6. Опередите изменения термодинамических параметров при переходе идеального газа из состояния 1 в состояние 2.
А7. Определите по графику изменение объема идеального газа при переходе 1-2 и 2-3.
В1. Установите соответствие между физическими величинами и единицами их измерения:
С1. Какой объем занимает углекислый газ (М=44•10-3кг/моль) массой 88 кг при давлении 3•105 Па и температуре 270 С ? С2. Какое число молекул содержится в гелии массой 8 г? (М=4•10-3кг/моль) Лекция 14 Внутренняя энергия. Работа и теплота как формы передачи энергии. Теплоемкость. Уравнение теплового баланса. Внутренняя энергияЛюбое тело (газ, жидкость или твердое) обладает энергией, даже если кинетическая и потенциальные энергии самого тела нулевые. То есть тело не имеет скорости и находится на Земле. Эта энергия называется внутренней, обусловлена она движением и взаимодействием частиц, из которых состоит тело. Внутренняя энергия состоит из кинетической и потенциальной энергии частиц поступательного и колебательного движений, из энергии электронных оболочек атомов, из внутриядерной энергии и энергии электромагнитного излучения. 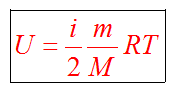  Внутренняя энергия зависит от температуры. Если изменяется температура, значит, изменяется внутренняя энергия. Количество теплотыЭто энергия, которую получает или отдает система в процессе теплообмена. Обозначается символом Q, измеряется, как любая энергия, в Джоулях. В результате различных процессов теплообмена энергия, которая передается, определяется по-своему. Нагревание и охлаждение Этот процесс характеризуется изменением температуры системы. Количество теплоты определяется по формуле 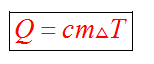 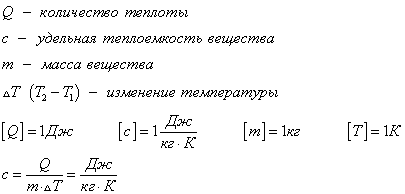 Удельная теплоемкость вещества с измеряется количеством теплоты, которое необходимо для нагревания единицы массы данного вещества на 1К. Для нагревания 1кг стекла или 1кг воды требуется различное количество энергии. Удельная теплоемкость - известная, уже вычисленная для всех веществ величина, значение смотреть в физических таблицах. Теплоемкость вещества С - это количество теплоты, которое необходимо для нагревания тела без учета его массы на 1К. 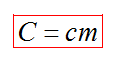 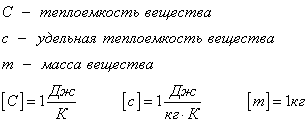 Плавление и кристаллизация Плавление - переход вещества из твердого состояния в жидкое. Обратный переход называется кристаллизацией. Энергия, которая тратится на разрушение кристаллической решетки вещества, определяется по формуле 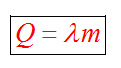 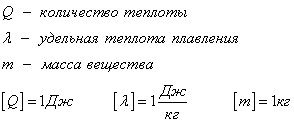 Удельная теплота плавления известная для каждого вещества величина, значение смотреть в физических таблицах. Парообразование (испарение или кипение) и конденсация Парообразование - это переход вещества из жидкого (твердого) состояния в газообразное. Обратный процесс называется конденсацией. 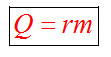 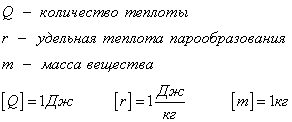 Удельная теплота парообразования известная для каждого вещества величина, значение смотреть в физических таблицах. Горение Количество теплоты, которое выделяется при сгорании вещества 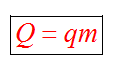 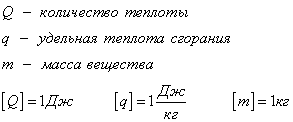 Удельная теплота сгорания известная для каждого вещества величина, значение смотреть в физических таблицах. Уравнение теплового баланса. Алгебраическая сумма количеств теплоты, отданных и полученных всеми телами, участвующим в теплообмене, равна нулю:Q1+Q2+...+Qn=0 РаботаВ термодинамике работа - это взаимодействие системы с внешними объектами, в результате чего изменяются параметры системы Рассмотрим цилиндр с идеальным газом, который находится под подвижным поршнем. Пусть внешняя сила, действующая на поршень, перемещает его из состояния 1 в состояние 2 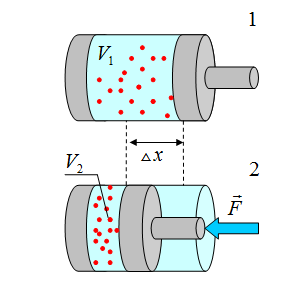 Работа силы равна 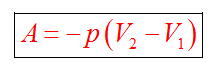 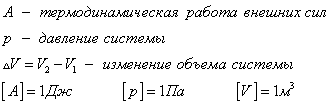 Знак "-" в формуле означает, что при уменьшении объема (как в нашем примере, Графическое определение работыСтроим график процесса p(V). Определяем на графике точки, которые соответствуют состоянию системы в 1 и 2 состояниях. Площадь фигуры под графиком - есть термодинамическая работа самой системы. Внешняя работа над системой равна работе системы, но с противоположным знаком 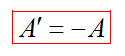 Работа термодинамической системы при изобарном процессе A=∆U-Q 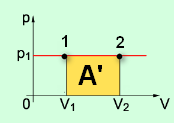 Работа термодинамической системы при изотермическом процессе Q=A' 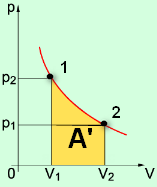 При изохорном процессе объем не изменяется, работа равна нулю A=0. Задание 1. Изучить лекцию 14 . Задание 2. Используя материал лекции 14, ответить письменно на вопросы: Когда тело обладает внутренней энергией? Формула для расчета внтутреней энергии, с пояснением каждой величины. Физический смысл и математическая запись уравнения теплового баланса? Что означает «работа» в термодинамике? Формула для расчета работы, с пояснением каждой величины? Задание 3. Используя материал лекции 14, заполните таблицу "Количество теплоты"
Задание 4. Используя материал лекции 14, заполните таблицу "Графическое определение работы"
Лекция 15. Первое начало термодинамики. Адиабатный процесс. Тепловые машины. К середине XIX в. многочисленные опыты доказали, что механическая энергия никогда не пропадает бесследно. Падает, например, молот на кусок свинца, и свинец нагревается вполне определенным образом. Силы трения тормозя тела, которые при этом разогреваются На основании множества подобных наблюдений и обобщения опытных фактов был сформулирован закон сохранения энергии: Энергия в природе не возникает из ничего и не исчезает: количество энергии неизменно, она только переходит из одной формы в другую. Закон сохранения энергии управляет всеми явлениями природы и связывает их воедино. Он всегда выполняется абсолютно точно, неизвестно ни одного случая, когда бы этот великий закон не выполнялся. Этот закон был открыт в середине XIX в. немецким ученым, врачом по образованию Р. Майером (1814—1878), английским ученым Д. Джоулем (1818—1889) и получил наиболее точную формулировку в трудах немецкого ученого Г. Гельмгольца (1821 — 1894). Закон сохранения и превращения энергии, распространенный на тепловые явления, носит название первого закона термодинамики. В термодинамике рассматриваются тела, положение центра тяжести которых практически не меняется. Механическая энергия таких тел остается постоянной, изменяться может лишь внутренняя энергия каждого тела. Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе: ∆U=A+Q. Часто вместо работы А внешних тел над системой рассматривают работу А' системы над внешними телами. Учитывая, что А'=-А,первый закон термодинамики можно записать так: Q=∆U+A′ Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами. Адиабатный процесс. Рассмотрим процесс, протекающий в системе, которая не обменивается теплотой с окружающими телами. Процесс в теплоизолированной системе называют адиабатным. При адиабатном процессе Q=0 и согласно уравнению изменение внутренней энергии происходит только за счет совершения работы: ∆U=A. Конечно, нельзя окружить систему оболочкой, абсолютно не допускающей теплопередачу. Но в ряде случаев можно считать реальные процессы очень близкими к адиабатным. Для этого они должны протекать достаточно быстро, так, чтобы за время процесса не произошло заметного теплообмена между системой и окружающими телами. Тепловые машины Жизнь людей невозможна без использования различных видов энергии. Источниками энергии являются различные виды топлива, энергии ветра, солнечная энергия, энергия приливов и отливов. Поэтому существуют различные типы машин, которые реализуют в своей работе превращение одного вида энергии в другой. Использовать внутреннюю энергию - значит совершит за счет нее полезную работу, например, поднять груз, перевести вагоны и т. д. А это в свою очередь, означает, что внутреннюю энергию необходимо превратить в механическую. Машины в которых внутренняя энергия топлива превращается в механическую энергию называют тепловым. Электрические двигатели преобразуют электрическую энергию в механическую, генераторы преобразуют механическую в электрическую и так далее. Тепловые машины преобразуют внутреннюю энергию в механическую. Внутренняя энергия тепловых машин образуется за счет энергии топлива. К ним относятся: паровая и газовая турбины, двигатель внутреннего сгорания, дизель, паровая машина, реактивный двигатель. Задание 1. Написать конспект лекции 15 ( под запись выделенно цветным) Задание 2. Решите качественную задачу: В сосуд, на дне которого была вода, накачали воздух. Когда открыли кран и сжатый воздух вырвался наружу, сосуд заполнился водяным туманом. Почему это произошло? Задание 3. Используя дополнительный материал, заполните таблицу "Виды тепловых машин"
Задание 4. Каковы экологические последствия работы тепловых двигателей. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||