Лекция 2 (для ФТ). Лекция 2 алканы и циклоалканы химические реакции метана лекция 2 алкены, диены
 Скачать 287.5 Kb. Скачать 287.5 Kb.
|
|
Лекция № 2 АЛКАНЫ И ЦИКЛОАЛКАНЫ ХИМИЧЕСКИЕ РЕАКЦИИ МЕТАНА  Лекция № 2 АЛКЕНЫ, ДИЕНЫ НОМЕНКЛАТУРА ГЕОМЕТРИЧЕСКИХ ИЗОМЕРОВ Цис-транс-номенклатура Цис-изомеры – геометрические изомеры, в которых заместители, образующие главную углеродную цепь в молекуле вещества, расположены по одну сторону относительно двойной связи (или плоскости цикла).  цис-гептен-3 цис-1,2-диметилциклопропан Транс-изомеры – геометрические изомеры, в которых заместители, образующие главную углеродную цепь в молекуле вещества, расположены по разные стороны относительно двойной связи (или плоскости цикла).  транс-2-метилгексен-3 транс-1,2-диметилциклопентан Лекция № 2 I. ЭЛЕКТРОФИЛЬНОЕ ПРИСОЕДИНЕНИЕ ПО ДВОЙНОЙ СВЯЗИ Гидробромирование бутена-1: С2H5–CH=CH2 + HBr ─→ С2H5–CHBr–CH3 Механизм АЕ :   вторичный катион устойчивей, чем первичный СH3(CH2)2CH2+ Взаимодействие несимметричного реагента  Лекция № 2 II. РАДИКАЛЬНОЕ ГИДРОБРОМИРОВАНИЕ АЛКЕНОВ (эффект Хараша) Протекает в присутствии пероксидов протекает (механизм AR) :  вторичный радикал более устойчив, чем первичный радикал С2H5CHBrCH2. Следует подчеркнуть, что только HBr присоединяется по механизму AR против правила Марковникова; остальные галогеноводороды не реагируют по пероксидному эффекту: HCl имеет слишком полярную связь и не расщепляется гомолитически, а HI сильный восстановитель и разрушает пероксиды. Лекция № 2 ХИМИЧЕСКИЕ РЕАКЦИИ НЕПРЕДЕЛЬНЫХ УГЛЕВОДОРОДОВ 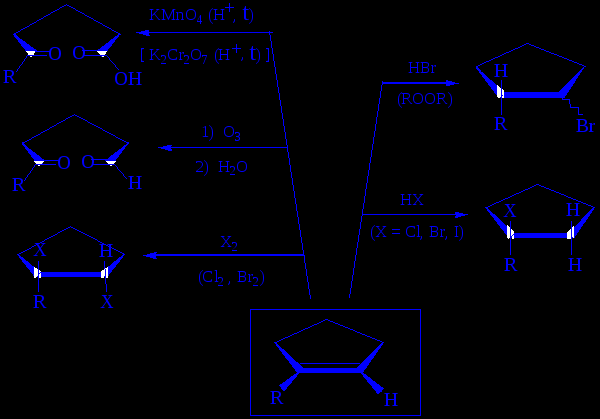 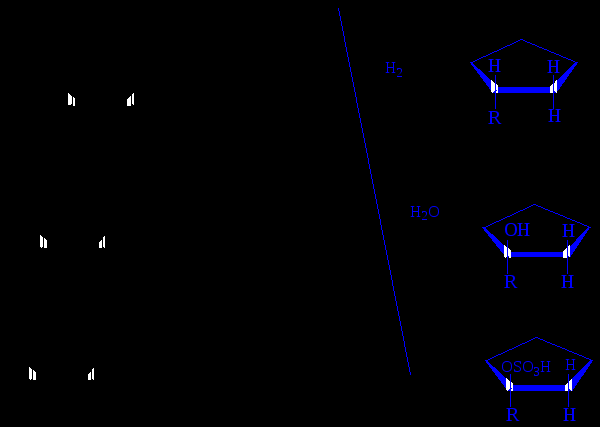 Лекция № 2 ПРОМЫШЛЕННОЕ ИСПОЛЬЗОВАНИЕ ЭТИЛЕНА  Лекция № 2 ПРОМЫШЛЕННОЕ ИСПОЛЬЗОВАНИЕ ПРОПИЛЕНА  Лекция № 2 ПОЛИМЕРИЗАЦИЯ Полимеризация процесс получения высокомолекулярных соединений (полимеров), при котором макромолекула образуется путем последовательного присоединения молекул низкомолекулярного ненасыщенного вещества (мономера) к активному центру, находящемуся в конце растущей цепи. Полимеризация алкенов и диенов протекает по схеме:  , где n степень полимеризации; , где n степень полимеризации; СОПОЛИМЕРИЗАЦИЯ В сополимеризации участвуют два различных мономера:    Лекция № 2 МЕХАНИЗМЫ ПРОЦЕССОВ ПОЛИМЕРИЗАЦИИ РАДИКАЛЬНАЯ ПОЛИМЕРИЗАЦИЯ ХЛОРВИНИЛА   КАТИОННАЯ ПОЛИМЕРИЗАЦИЯ ПРОПИЛЕНА (в прис. H2SO4)   АНИОННАЯ ПОЛИМЕРИЗАЦИЯ АКРИЛОНИТРИЛА   Лекция № 2 1,2- и 1,4-ПРИСОЕДИНЕНИЕ К БУТАДИЕНУ-1,3  Двойные связи дивинила реагируют не каждая сама по себе, а как единая -система; атака мезомерного катиона нуклеофилом Вr приводит к продуктам 1,2- и 1,4-присоединения, поскольку именно второй и четвертый атомы углерода сопряженной системы двойных связей несут в этом катионе положительный заряд:  Лекция № 2 АЛКИНЫ МЕТОДЫ СИНТЕЗА АЛКИНОВ 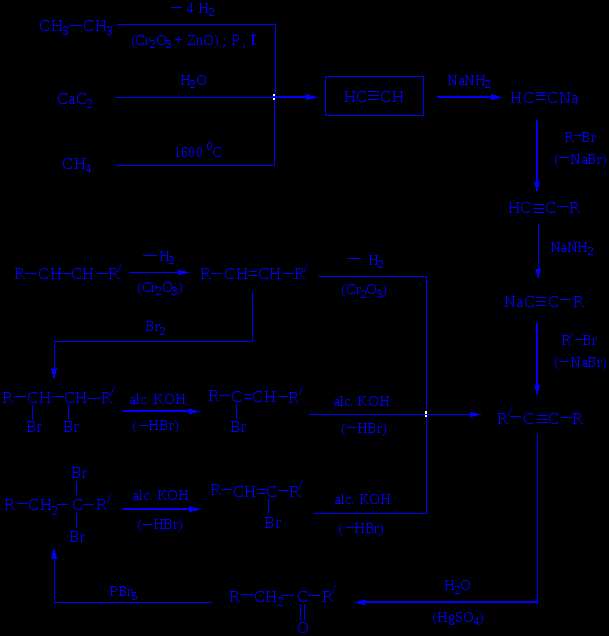 Лекция № 2 АЦЕТИЛЕН НС≡СН, этин Получение – взаимодействие карбида кальция с водой СaC2 + 2 H2O → Ca(OH)2 + НС≡СН пиролиз или электрокрекинг природного газа (1500 ºС) 2 CH4 → НС≡СН + 3 H2 Димеризация ацетилена - дает винилацетилен; линейная тримеризация – дивинилацетилен; циклотримеризация (акт. С; р, t) – бензол. Основные химические превращения ацетилена (реакции присоединения по тройной связи и замещение атома водорода):  |
