|
Лекция 3 Ферменты. Строение, механизм действия, классификация
Лекция 3
Ферменты. Строение, механизм действия, классификация.
3.1. Энергия активации. Катализаторы
Рассмотрим популяцию молекул D, находящихся в ограниченном замкнутом пространстве. В такой популяции индивидуальные молекулы при постоянной температуре сильно различаются по количеству содержащейся (внутренней) в них энергии:
молекулы с высокой энергией (Еmax), незначительное количество;
молекулы со средним значением энергии (Еmid), большинство молекул;
молекулы с низкой энергией (Еmin), незначительное количество.
Химическая реакция X→Y (CO2 + H2O → H2CO3) протекает потому, что в любой момент времени некоторая доля молекул D обладает большей внутренней энергией (Еmax) по сравнению с другими молекулами данной популяции, и этой энергии оказывается достаточно для достижения ими вершины энергетического барьера и перехода в активную форму, называемую активным состоянием: (Рис. 3.1):

Рис. 3.1. Катализаторы снижают энергию активации (энергетический, или активационный, барьер) химических реакций, не влияя при этом на полное изменение свободной энергии в ходе реакции.
Энергией активации называется количество энергии необходимое для того, чтобы все молекулы вещества при определённой температуре перешли в активированное состояние, соответствующее вершине активационного барьера.
В ходе реакции молекулы приобретают энергию, достаточную для их активации, и оказываются в переходном состоянии; далее происходит образование продуктов.
При графическом изображении (Рис. 3.1) энергия активации (Еа) – это высота энергетического барьера, которая должна быть преодолена молекулами для осуществления химической реакции.
Достижение переходного состояния реагирующими молекулами (субстрата) возможно двумя путями:
1) придать реагирующим молекулам избыточную энергию за счёт увеличения температуры;
2) снизить энергию активации соответствующей реакции.
Для снижения энергии активации используются специальные вещества – катализаторы.
Основная функция катализатора — образовывать с исходными веществами более реакционноспособные промежуточные соединения, позволяющие снизить энергию активации.
Катализатор — вещество, принимающее участие в ходе реакции, но остающееся неизменным в конце реакции.
Все без исключения химические процессы в клетке катализируются специальными биологическими катализаторами, которые называются ферментами.
3.1.1. Ферменты как биологические катализаторы
Ферменты – специфические белки всех живых клеток, играющие роль биологических катализаторов.
!!! С их помощью осуществляется обмен веществ и энергии в организме.
В настоящее время известно более 3200 ферментов.
3.2. Отличие ферментов от неорганических катализаторов
Ферменты имеют следующие общие свойства с катализаторами неорганической природы:
1) увеличивают скорость химической реакции за счёт снижения энергии активации;
2) не изменяют направления реакции;
3) не расходуются в процессе реакции.
Вместе с тем ферменты обладают рядом свойств, отличающих их от химических катализаторов:
1) каталитическая активность ферментов проявляется при нормальных условиях - ферменты по сравнению с катализаторами неорганической природы действуют в очень «мягких» условиях организма (белки при неблагоприятных условиях денатурируют);
2) абсолютная специфичность действия - большинство ферментов отличается специфичностью действия, так как практически каждая реакция превращения исходных веществ в продукты реакции в клетке катализируется специальным ферментом;
3) высокая эффективность действия - ферменты самые эффективные из всех катализаторов, так как очень малые (микромолярные - 10-8–10-6 М) количества ферментов могут в очень большой степени ускорять реакцию.
Действительно, большинство реакций в клетке протекают примерно в миллион раз быстрее, чем, если бы они протекали в отсутствие ферментов. Например, реакцию образования угольной кислоты (в легких)
CO2 + H2O → H2CO3
катализирует фермент карбоксиангидраза, активность которой составляет 32 000 000 оборота в минуту, т.е. образуется 32 млн молекул H2CO3 в минуту.
3.3. Условия действия ферментов в клетке
В принципе клетка использует те же самые химические реакции, что и химик в своей лаборатории.
Однако на условия протекания реакций в клетке накладываются жесткие ограничения:
1) все реакции в клетке протекают в водном растворе;
2) при постоянной температуре (37°С);
3) при постоянном давлении (1 атм.);
4) при значениях pH, близких к нейтральным (pH 6,5 - 7,5).
Именно поэтому очень часто реакции, которые в лабораторных условиях можно провести в одну стадию, в живой клетке протекают через множество стадий.
Например, проведение в естественных условиях реакции образования воды из водорода и кислорода:
2H2 + O2 → 2H2O + взрыв (гремучий газ);
сопровождается взрывом из-за огромного количества выделившейся энергии. Избежать взрыва можно при проведении реакции в следующих условиях:
- в несколько стадий,
- в присутствии катализаторов;
- и при постоянном отведении теплоты от системы.
Это позволяет в значительной мере снизить энергию активации и провести реакцию при нормальных условиях.
Именно благодаря разделению на стадии в клетке эта же реакция протекает при постоянной температуре (37°С). При этом выделяющаяся энергия реакции запасается в виде молекул АТФ.
3.4. Строение ферментов
Для ферментов характерны все закономерности строения, присущие белкам.
Все ферменты относятся к глобулярным белкам, причём, они могут иметь как третичную, так и четвертичную структуру.
По составу молекулы ферменты могут быть простыми и сложными.
Простые ферменты состоят только из полипептидной цепи, характеризующейся наличием третичной глобулярной структуры.
Сложные ферменты состоят из белкового и небелкового компонента.
Белковая часть сложного фермента называется апоферментом.
По характеру связи небелковой части с апоферментом небелковые компоненты сложных ферментов подразделяются на коферменты и простетические группы.
Коферментом называется небелковая часть, которая соединяется с белковой частью фермента посредством слабых нековалентных взаимодействий: гидрофобных, ионных и водородных связей.
Простетической группой называется небелковая часть, прочно связанная с белком ковалентной связью.
Коферменты и простетические группы принимают непосредственное участие в процессе ферментативного катализа.
Роль коферментов выполняют:
- большинство водорастворимых витаминов (или их химически модифицированные производные);
- соединения, построенные с участием витаминов;
- нуклеотиды и их производные;
- фосфорные эфиры некоторых моносахаридов;
- ионы металлов железа, меди, магния, марганца, кальция, цинка.
Характерной особенностью сложных ферментов является то, что ни белковая часть, ни кофермент или простетическая группа в отдельности часто не обладают заметной каталитической активностью.
!!!! Только их комплекс проявляет ферментативные свойства.
3.5. Активный центр ферментов
Ферментативный катализ идёт на поверхности фермента (Рис. 3.2):

Рис. 3.2. Относительные размеры молекулы фермента (мол. масса 100 000 Da, диаметр 7 нм) и типичной молекулы субстрата (мол. масса 250 Da, диаметр 0,8 нм). Активный центр занимает лишь незначительную часть поверхности молекулы фермента. Для сравнения показана также молекула воды.
Введём понятие «субстрата» и «активного центра» фермента.
Субстратом называется вещество, которое подвергается превращению в результате ферментативной реакции.
Активным центром называется область ферментативной молекулы, в которой происходит связывание и превращение субстрата.
3.5.1. Особенности функционирования активного центра
1) Связывание субстрата с активным центром осуществляется в результате образования слабых нековалентных взаимодействий, таких как ионные, гидрофобные и водородные связи.
2) Существование активного центра обусловлено наличием у молекулы белков глобулярной структуры.
3) В процессе формирования третичной структуры белка происходит сближение и стабилизация радикалов аминокислот, принимающих участие в формировании активного центра, при помощи дисульфидных связей и множественных слабых нековалентных взаимодействий.
!!! Денатурация нарушает связи, стабилизирующие третичную структуру, активный центр разрушается, и каталитические свойства фермента полностью или частично подавляются.
В активном центре выделяют две части: центр связывания (связывающий участок) и каталитический центр (каталитический участок) (Рис. 3.3):

Рис. 3.3. Структура активного центра фермента
Функция центра связывания: радикалы аминокислот, входящие в центр связывания, обеспечивают фиксацию субстрата, подвергающегося ферментативному воздействию.
!!! Связывание ферментом субстрата - это именно тот процесс, благодаря которому реализуется принцип специфичности действия ферментов.
5) Функция каталитического центра: радикалы аминокислот и (или) коферменты, входящие в каталитический центр, обеспечивают непосредственно протекание каталитической реакции.
На рисунке 3.4 представлен активный центр рибонуклеазы А – фермента, гидролизующего молекулу РНК:
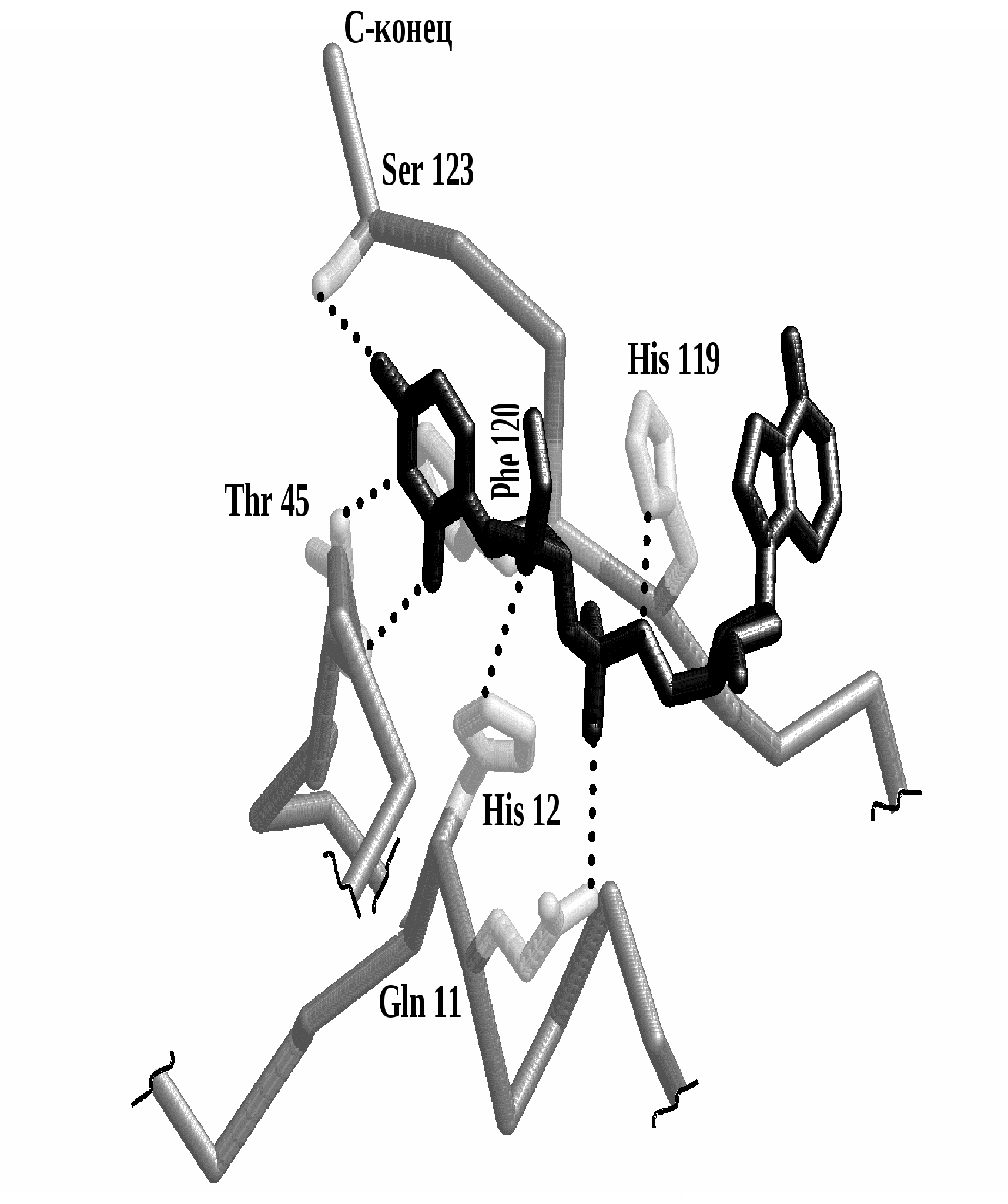
Рис. 3.4. Трехмерная структура активного центра рибонуклеазы А по данным рентгено-структурного анализа. Для удобства показаны лишь участки полипептидной цепи несущие связывающие и каталитические группы. Полипептидые цепи представлены ходом пептидного остов (темно-серые), связывающие и каталитические группы — палочковыми моделями (светло-серые), модель субстрата [уридилил-(3'→5')-аденозин] — черной палочковой моделью. Водородные связи обозначены пунктиром.
Молекула РНК состоит из множества мононуклеотидов, связанных фосфодиэфирной связью.
а) аминокислотные остатки, формирующие центр связования: аминокислотные остатки: Гли 11, Тир 45 и Сер 123, которые образуют водородные связи с атомами мононуклеотида и тем самым фиксируют молекулу субстрата.
б) аминокислотные остатки, формирующие активный центр: Гис 12 и Гис 119.
Оба эти гистидина участвуют в процессе катализа, причём Гис 12 образует связь с гидроксильной группой рибозы, а Гис 119 взаимодействует с соседним фосфатом.
!!! Связь между гидроксильной группой рибозы и остатком фосфорной кислоты при этом разрывается.
3.5.2. Особенности состава и структуры активного центра
1) В состав активных центров многих ферментов входит ограниченное количество аминокислотных остатков.
К ним относятся только аминокислоты, содержащие полярные и заряженные группы: гистидин, серин, тирозин, цистеин, лизин и некоторые другие аминокислоты.
2) В состав активных центров сложных ферментов всегда входят простетические группы или коферменты.
Иными словами, у сложных ферментов активный центр также является сложным по составу – двухкомпонентным, состоящим из аминокислотных остатков, соединённых с небелковой частью молекулы.
3.6. Механизм действия ферментов
3.6.1. Ферменты понижают энергию активации химической реакции
1) Как и любые катализаторы, ферменты повышают скорость химической реакции за счёт снижения энергии активации реакции (энергетического барьера) реакции.
2) Снижение энергии активации при ферментативном катализе обусловлено увеличением числа стадий химического процесса.
Индуцирование рядапромежуточных стадий приводит к тому, что исходный барьер энергии активации (Еа) дробится на несколько более низких барьеров энергии активации, преодолеть которые реагирующие молекулы могут гораздо быстрее, чем основной.
3) Ферменты помогают субстратам принять переходное состояние за счет энергии связывания при образовании фермент-субстратного комплекса. Так, при образовании водородных связей между субстратом и ферментом при фиксации субстрата на поверхности фермента выделяется энергия (Еа), которая затрачивается на перевод молекул субстрата в активное состояние.
Условная запись реакции образования и функционирования фермент-субстратного комплекса выглядит следующим образом:
E + S ↔ ES → EP → E + P
При взаимодействии фермента с субстратом можно выделить три стадии:
1. Первая стадия: образование фермент-субстратного комплекса,
т. е. присоединение субстрата к макромолекуле фермента.
2. Вторая стадия: непосредственно ферментативная реакция.
3. Третья стадия: отделение продуктов превращения субстрата от фермента.
Первая стадия - образование фермент-субстратного комплекса
(E + S ↔ ES):

1) Взаимодействию фермента с субстратом предшествует сближение и ориентация субстрата по отношению к активному центру фермента.
2) Затем образуются фермент-субстратные (ES) комплексы.
Тонкий механизм формирования фермент-субстратного комплекса:
а) при формировании фермент-субстратного комплекса обратимо меняется третичная структура (конформация) фермента, что способствует наилучшему пространственному соответствию молекул фермента и субстрата (рис. 3.5):
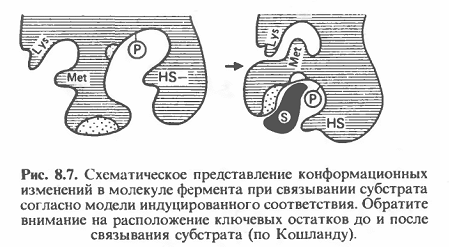
Рис. 3.5. Схематическое изображение конформационных изменений в ферменте, индуцированных субстратом.
б) взаимодействие фермента с субстратом вызывает локальное конформационное изменение некоторых сайтов белковой макромолекулы фермента (Рис. 3.6):

Рис. 3.6. Индуцированное соответствие между активным центром фермента и напряженной формой молекулы субстрата
в) в результате чего комплементарность его активного центра к субстрату резко повышается и обеспечивает возможность осуществления каталитического процесса.
Вторая стадия – непосредственно ферментативная реакция.
а) ускорение реакции достигается за счёт двух факторов:
- сближения и правильной ориентации субстратов относительно друг друга;
- увеличения их эффективной концентрации (поскольку в растворе их концентрации случайны).
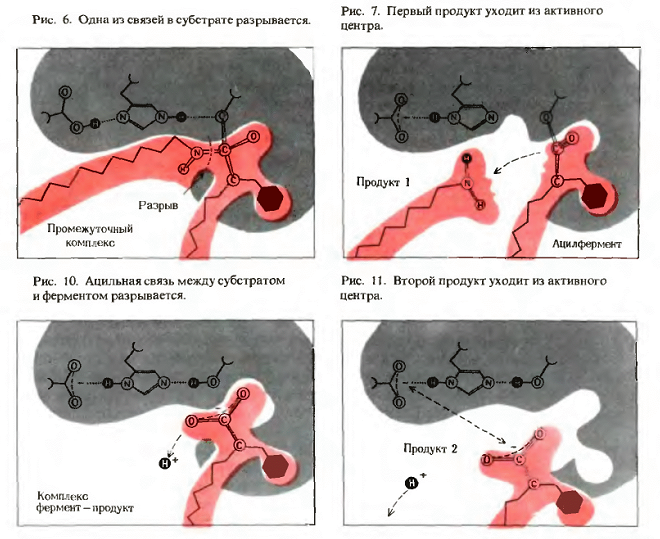
б) на этой стадии происходит химическая реакция через возникновение переходного состояния (EP) с образованием продукта реакции на поверхности фермента:
ES → EP
!!! На данной стадии фермент, в свою очередь, оказывает значительное влияние на субстрат.
а) под влиянием фермента структура субстрата изменяется: сначала образуется переходное состояние, а затем продукты (P) ферментативной реакции.
!!! Именно в этот момент (EP) происходит одновременный разрыв старых и образование новых связей.
б) субстрат вступает в промежуточные реакции с определёнными функциональными группами активного центра фермента, в результате чего реакция требует более низкой энергии активации.
в) при образовании фермент-субстратного комплекса происходит обмен электронами и протонами между ферментом и субстратом.
(1) Если фермент отдаёт электронную пару субстрату, т. е. фермент является донором электронов, осуществляющим нуклеофильную атаку, то имеет место нуклеофильный катализ.
(2) В электрофильном катализе, напротив, фермент принимает (акцептирует) пару электронов от субстрата, т. е. является акцептором электронной пары.
Третья стадия - отделение продуктов превращения субстрата от фермента.
На заключительной стадии фермент освобождается и вступает во взаимодействие с новыми молекулами субстрата, совершая множество «оборотов» данной химической реакции (EP → E + P):

3.7. Внутриклеточное распределение ферментов
С современной точки зрения клетка является высокоупорядоченной системой, в отдельных частях которой осуществляются строго определенные биохимические процессы.
Это объясняется тем, что в клеточном содержимом ферменты распределены не хаотически, а строго упорядоченно в виде систем ферментов - мультиферментных комплексов, обеспечивающих каталитические превращения всех участников единого метаболического цикла - в клетках с большой скоростью осуществляются многостадийные процессы, как распада, так и синтеза органических молекул.
Ферментативный катализ в многостадийных реакциях идет без выделения промежуточных продуктов: только возникнув, они тут же подвергаются дальнейшим преобразованиям.
Например, разнообразные гидролазы и лиазы сосредоточены преимущественно в лизосомах. Внутри этих сравнительно небольших (несколько нанометров в диаметре) пузырьков, ограниченных мембраной от цитоплазмы клетки, протекают процессы разрушения различных органических соединений до тех простейших структурных единиц, из которых они построены.
Ферменты локализованы во всех органеллах клеток (Рис. 3.9):

Рис. 3.9. Органеллы клетки: 2 – ядро; 3 – рибосома; 5 – эндоплазматический ретикулум; 6 – аппарат Гольджи; 7 – внешняя мембрана; 9 – митохондрия;
12 – лизосома
1. Ферменты, локализованные в ядре, катализируют синтез молекул ДНК и РНК, а также процессы их функционирования и распада.
2. В митохондриях действую ферменты энергетического обмена.
3. Рибосомальные ферменты катализирует биосинтез белка.
4. В аппарате Гольджи – ферменты, катализирующие созревание белков.
5. В лизосомах – гидролитические ферменты.
6. Значительное число ферментов ассоциировано с внешней и внутренними мембранами.
3.8. Классификация и номенклатура ферментов
Катализируемая химическая реакция является тем признаком, по которому можно отличить один фермент от другого.
Некоторые, ранее описанные ферменты сохранили тривиальные названия, такие как трипсин, пепсин, каталаза.
Однако большинство названий ферментов образовано с помощью суффикса –аза:
- от названия типа реакции, которую они катализируют: так, дегидрогеназа катализирует отрыв водорода, гидролаза катализирует гидролиз, трансфераза переносит химические группы и т. д.
- от названия субстратов, участвующих в ферментативной реакции: так аргиназа катализирует гидролиз аргинина, фосфатаза катализирует гидролиз фосфорных эфиров и т. д.
В 1961 году Международная комиссия по номенклатуре ферментов разработала современную номенклатуру ферментов, основанную на типе катализируемой реакции.
!!!! Согласно этой номенклатуре название фермента составляют из химического названия субстрата и названия той реакции, которую катализирует фермент.
Например, фермент, который катализирует окисление глюкозы, получил название глюкозооксидаза.
Согласно рекомендациям комиссии ферменты делят на классы, подклассы, и подподклассы и т. д. вплоть до десяти разрядов.
В соответствии с типом катализируемой химической реакции все ферменты делят на шесть классов:
1. Оксидоредуктазы – ускоряют реакции окисления-восстановления. Окисление протекает как процесс удаления атомов водорода (или электронов) от субстрата, а восстановление – как присоединение атомов водорода (или электронов) к акцептору.
2. Трансферазы - ферменты, ускоряющие реакции переноса органических радикалов или целых молекулярных остатков с одного соединения на другое.
Их названия включают в себя химическое название субстрата, акцептора и названия той реакции, которую они катализируют:
АТФ: глюкозо-6-фосфотрансфераза – фермент, ускоряющий перенос остатка фосфорной кислоты с молекулы АТФ на глюкозу.
В зависимости от характера переносимых атомных группировок различают:
- фосфотрансферазы (переносят остаток фосфорной кислоты);
- ацилтрансферазы (переносят карбоксильную группу);
- аминотрансферазы (переносят аминогруппу) и др.
3. Гидролазы - ферменты катализируют расщепление внутримолекулярных связей при помощи молекул воды:
- эстеразы катализируют гидролиз сложноэфирных связей в липидах;
- гликозидазы – гликозидных связей в полисахаридах;
- нуклеазы – фосфодиэфирных связей в молекулах нуклеиновых кислот;
- пептидазы – пептидных связей в пептидах и белках.
4. Лиазы - катализируют разрыв связей C-C, C-N, C-O, C-S с сообразованием двойных связей.
5. Лигазы (синтетазы) – катализируют процессы конденсации молекул за счёт энергии АТФ.
Название их включает названия соединяющихся веществ и лигазу: аспартат- аммиак-лигаза.
Лигазы, катализирующие синтез связей C-O, принадлежит важнейшая роль в синтезе белков.
6. Изомеразы - катализирующие самые различные процессы изомеризации.
Название изомераза включает название субстрата и тип изомеризации.
Изомеризация может заключаться во внутримолекулярном:
- переносе атомов водорода, фосфатных и ацильных групп;
- в изменении пространственного расположения атомных группировок (цис-транс-изомеразы);
- перемещении двойных связей и т. д.
|
|
|
 Скачать 2.28 Mb.
Скачать 2.28 Mb.








