Лекция 8. Лекция 8 Оксосоединения План Общая характеристика оксосоединений (карбоксильных соединений)
 Скачать 0.59 Mb. Скачать 0.59 Mb.
|
|
Лекция № 8 Оксосоединения План 8.1. Общая характеристика оксосоединений (карбоксильных соединений) 8.2. Реакции нуклеофильного присоединения в ряду альдегидов и кетонов 8.3. Реакции окисления и восстановления органических соединений 8.1. Общая характеристика оксосоединений К карбоксильным соединениям относят соединения, содержащие группу  С  = О: альдегиды, кетоны, карбоновые кислоты. = О: альдегиды, кетоны, карбоновые кислоты.В альдегидах карбонильняа группа связана по крайней мере с одним атомом водорода 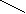 R — C R — C 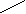 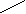 Н, в кетонах – с двумя радикалами R — C — R′, в карбоновых кислотах она входит в состав карбоксильной группы Н, в кетонах – с двумя радикалами R — C — R′, в карбоновых кислотах она входит в состав карбоксильной группы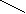 R — С R — С ОН Альдегиды. Классификация. В зависимости от радикала различают предельные и ароматические альдегиды. 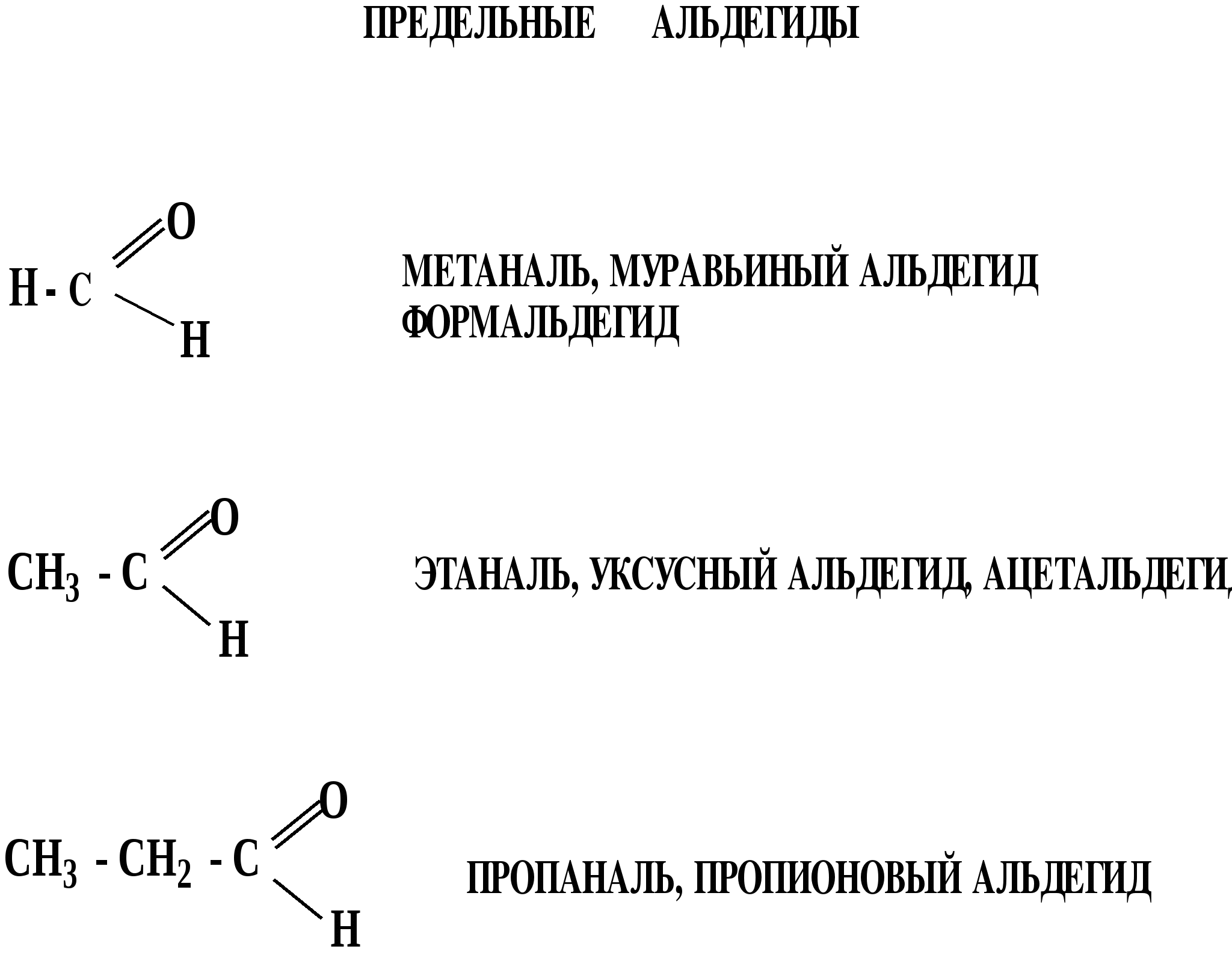 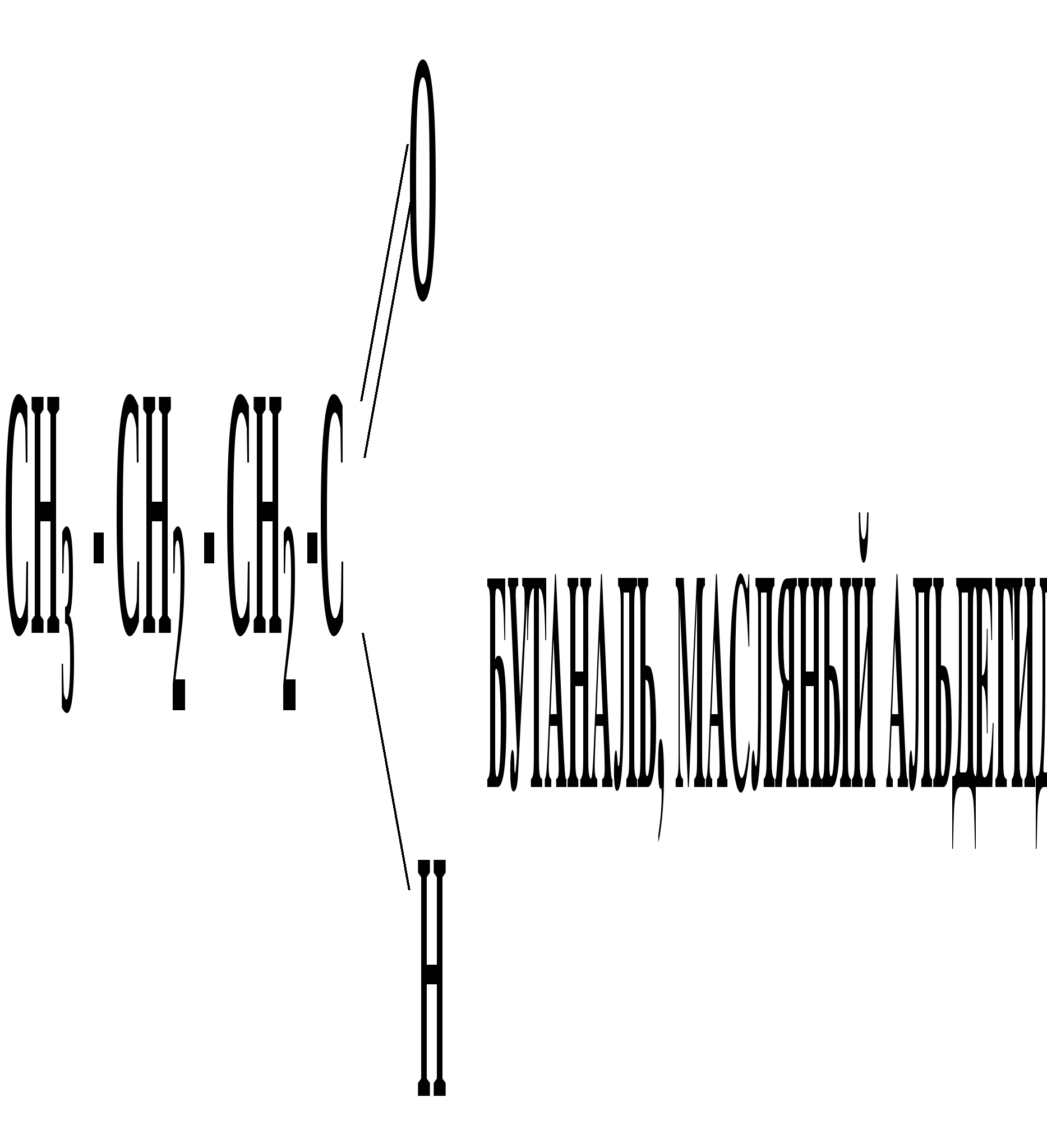 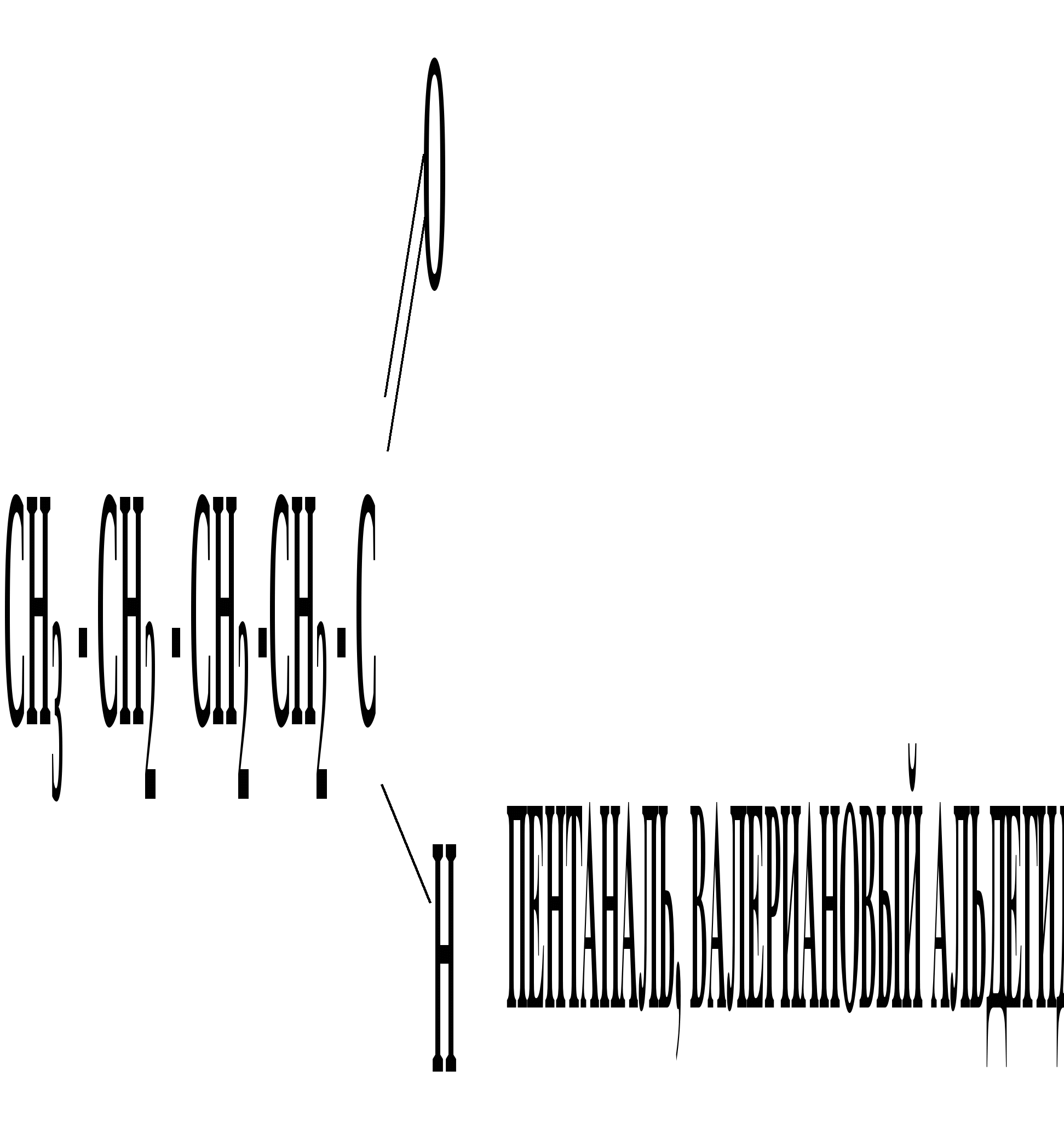 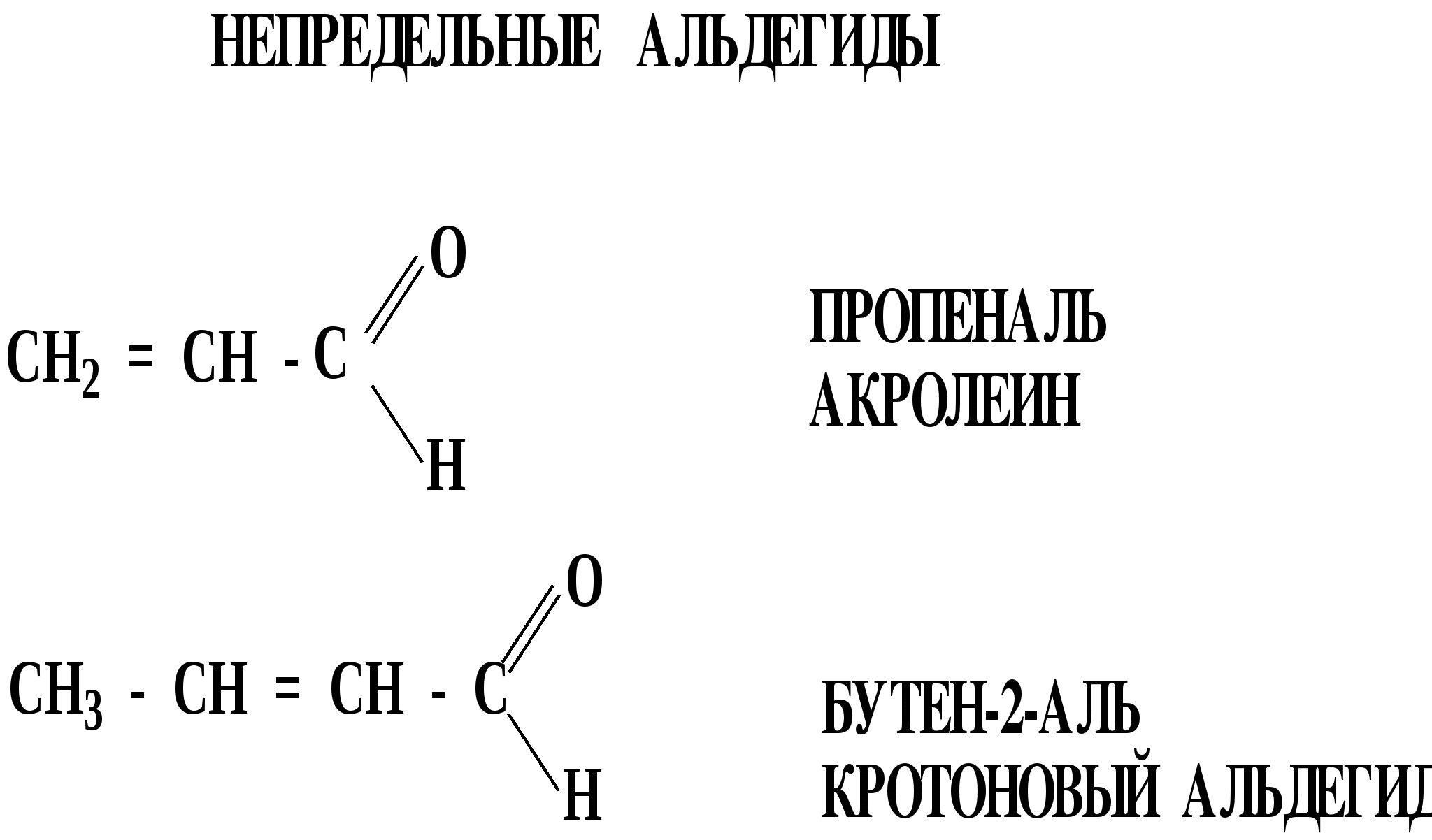   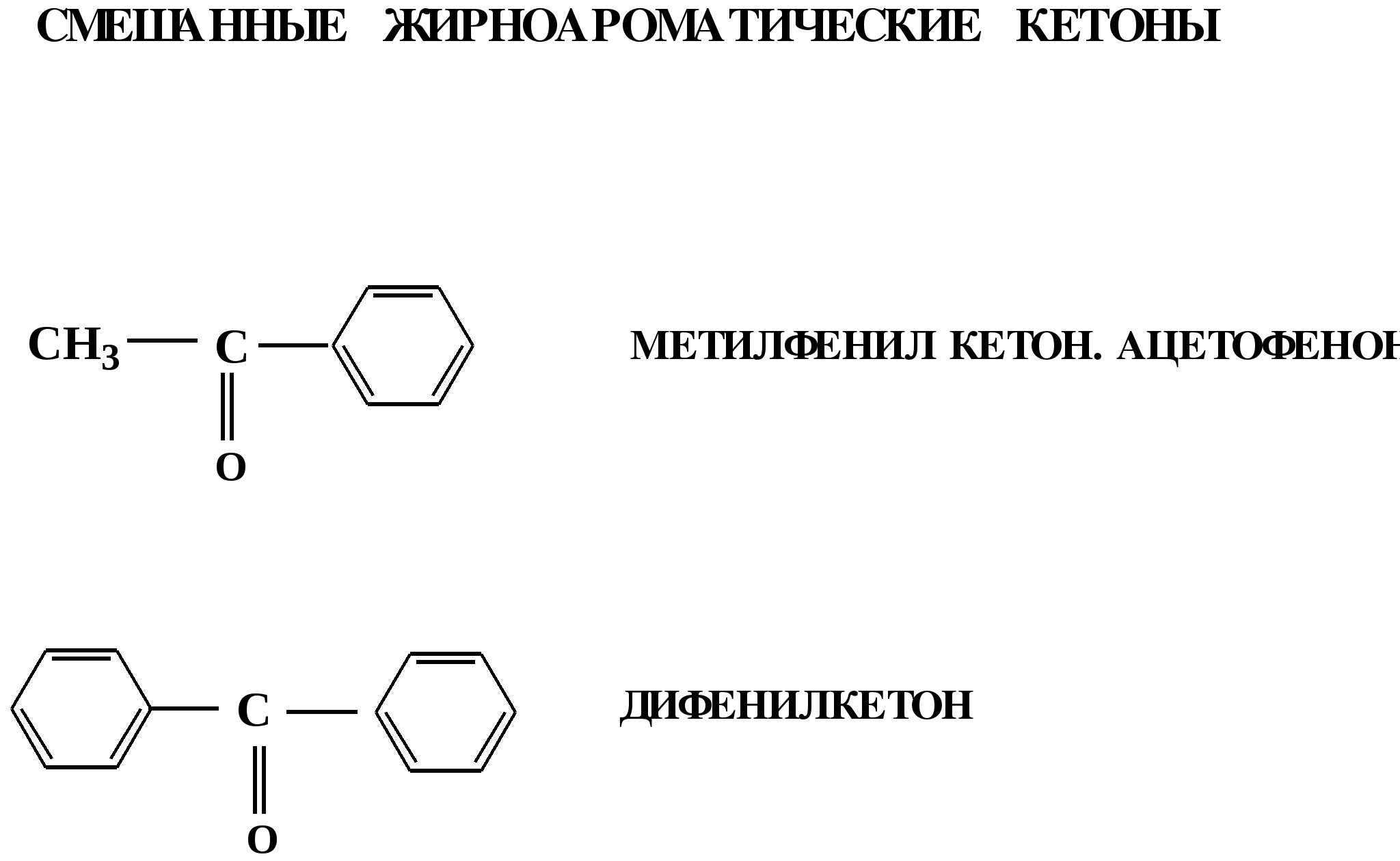 Электронное строение карбонильной группы характеризуется наличием 3δ и 1π связи. Двойная связь в оксогруппе существенно отличается от двойной связи в алкенах тем, что она сильно поляризована. Для альдегидов и кетонов, имеющих атом углерода в sр2-гибридизации характерны реакции АN. Рассмотрим реакционные центры в молекулах альдегидов и кетонов. 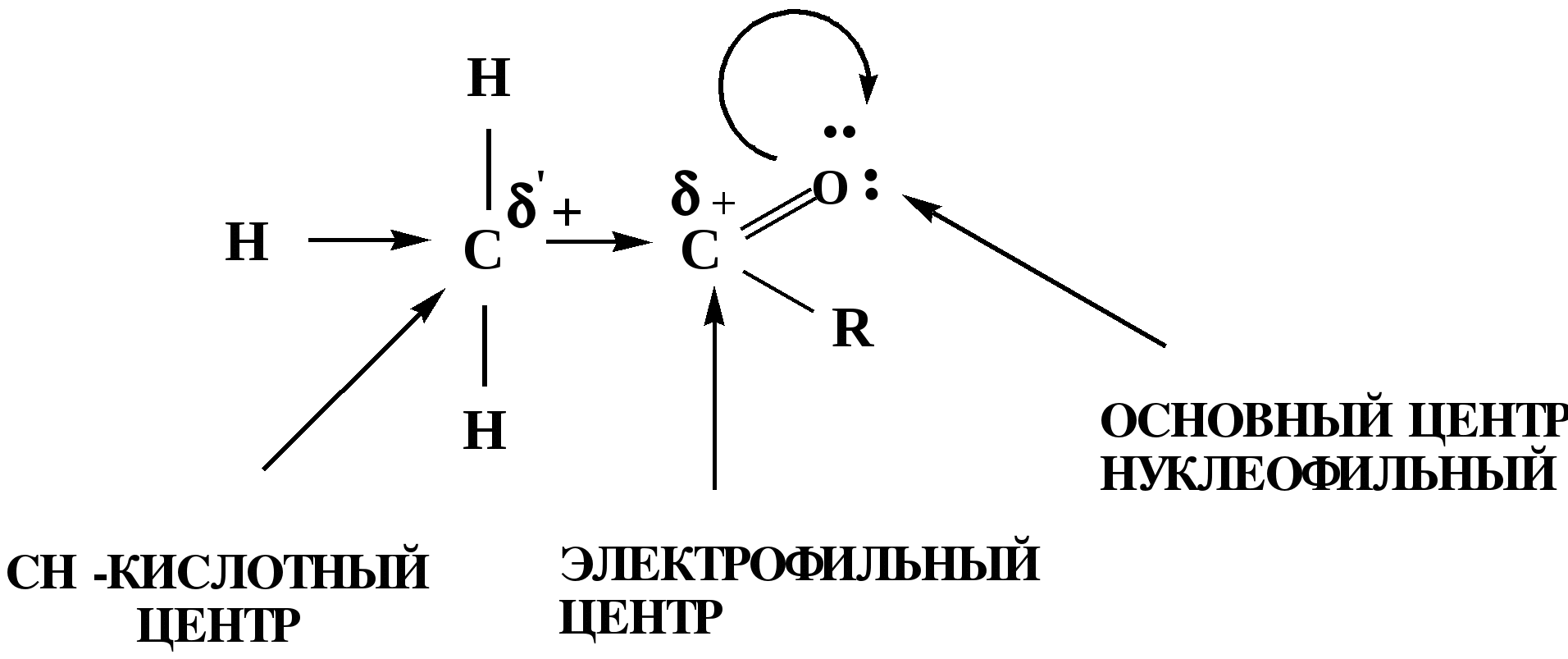 Атом углерода карбонильной группы является электрофильным центром и представляет собой удобный центр для атаки нуклеофилом. Легкость нуклеофильной атаки зависит: 1) от величины эффективного положительного заряда на карбонильном атоме углерода; 2) от пространственной доступности атома углерода в карбонильной группе; 3) от кислотно-основных свойств среды.   Исходя из этого понятно, что легче вступают в реакции АN альдегиды, а из них – формальдегид. 8.2. Реакции АN в ряду альдегидов и кетонов 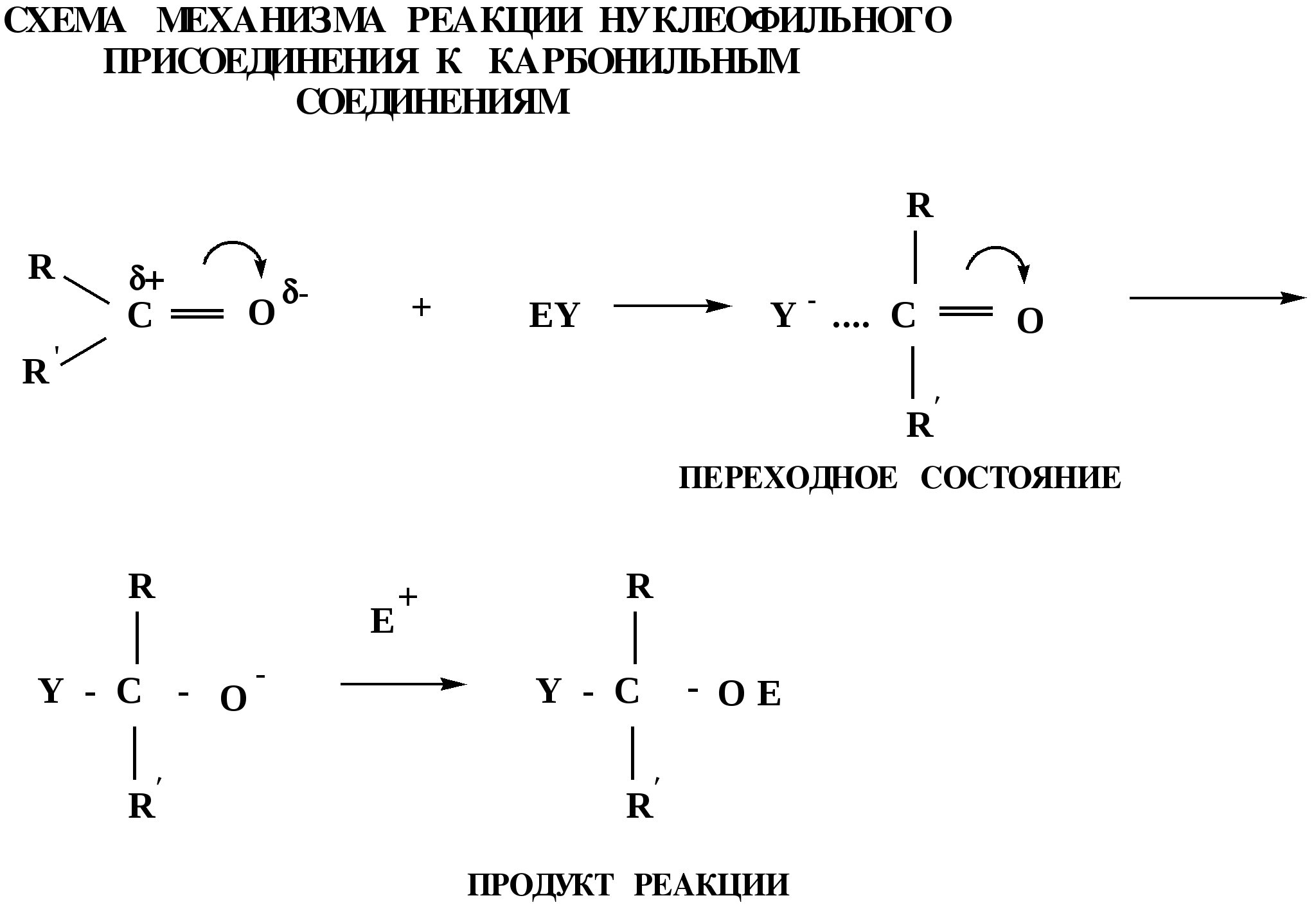 Примеры реакции АN 1) Гидратация 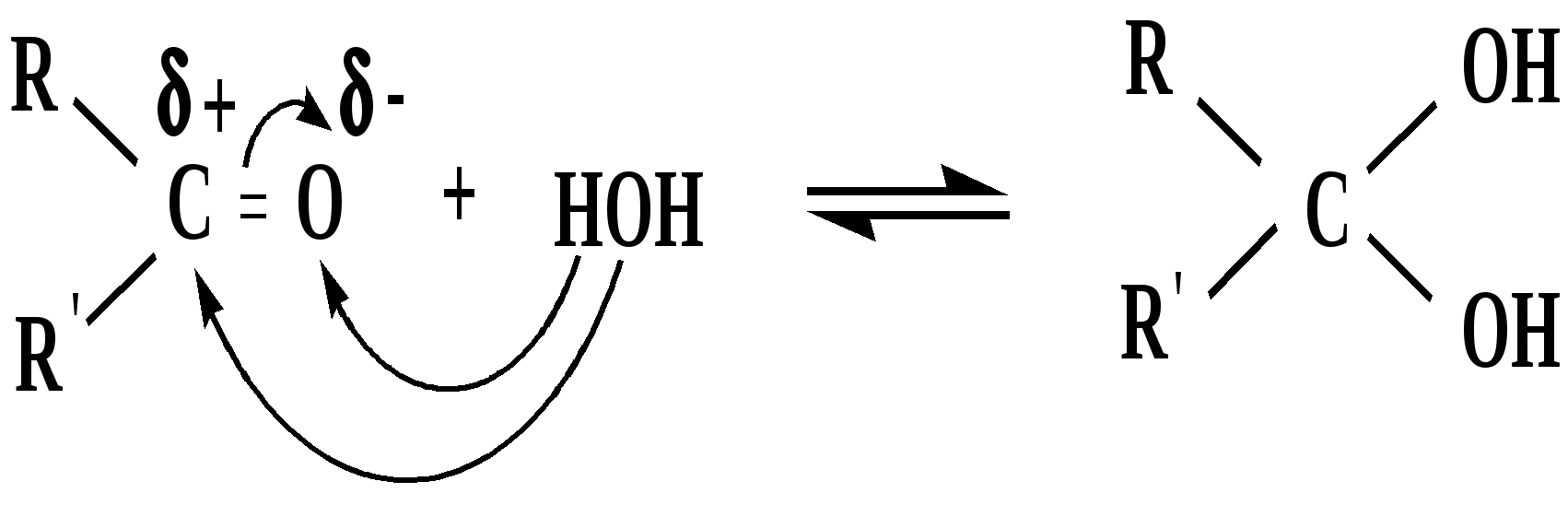 гидраты альдегидов и кетонов Гидраты альдегидов и кетонов в свободном виде выделить, как правило, не удается, т.к. равновесие этой реакции сдвинуто влево. Однако, такой альдегид, как трихлоруксусный альдегид удалось прогидратировать. 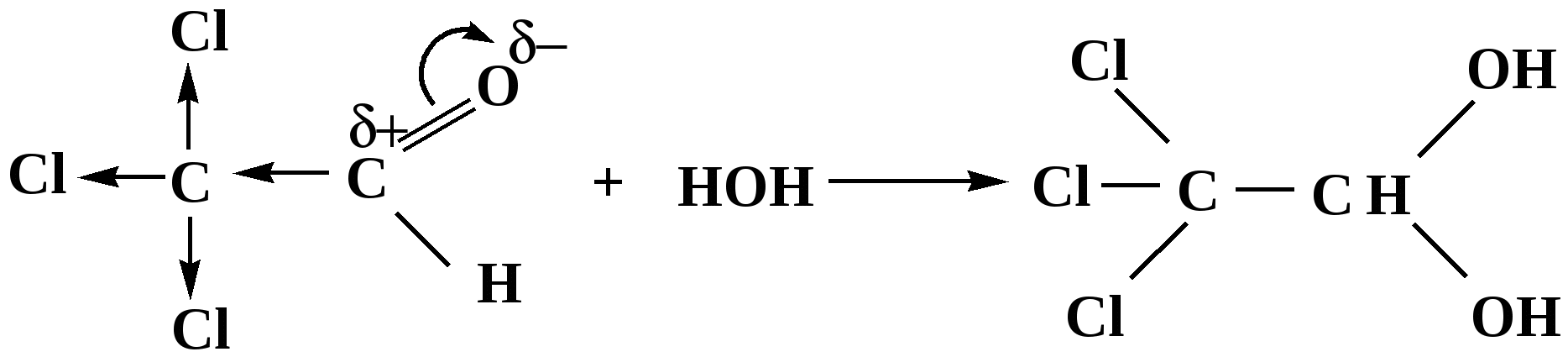 Хлораль Хлораль гидрат используется в медицине в качестве успокаивающего, снотворного средства. Аналогично возможно образование стабильного гидрата – нингидрина, который используется для обнаружения аминокислот, пептидов, белков в медико-биологических исследованиях. 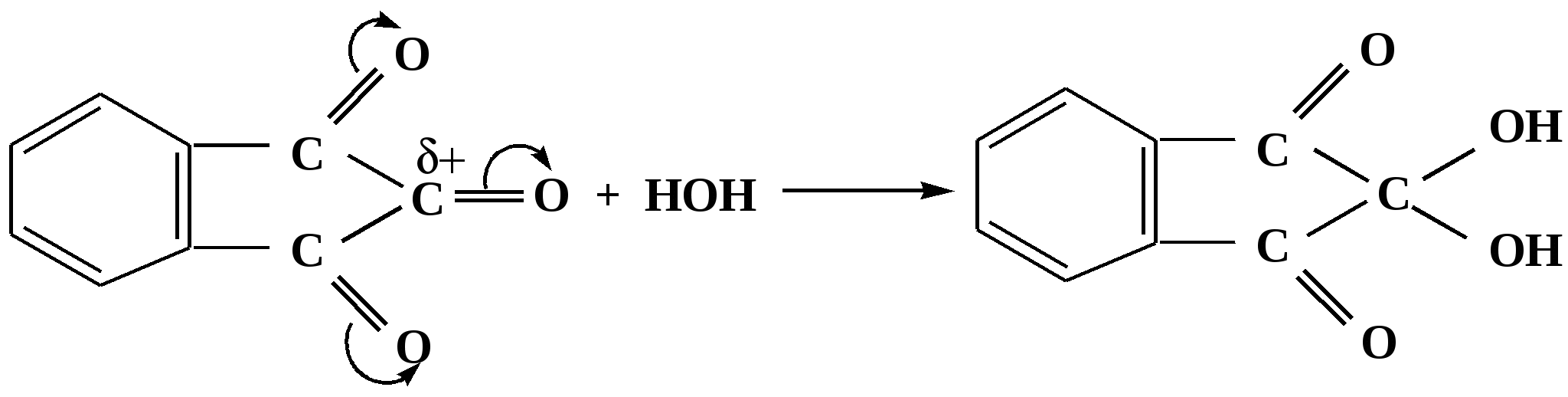 Индантрион-1,2,3 Нингидрин 2) Ацетализация – присоединение спиртов. Реакция протекает в кислой среде с образованием полуацеталей, при избытке спирта образуются ацетали. 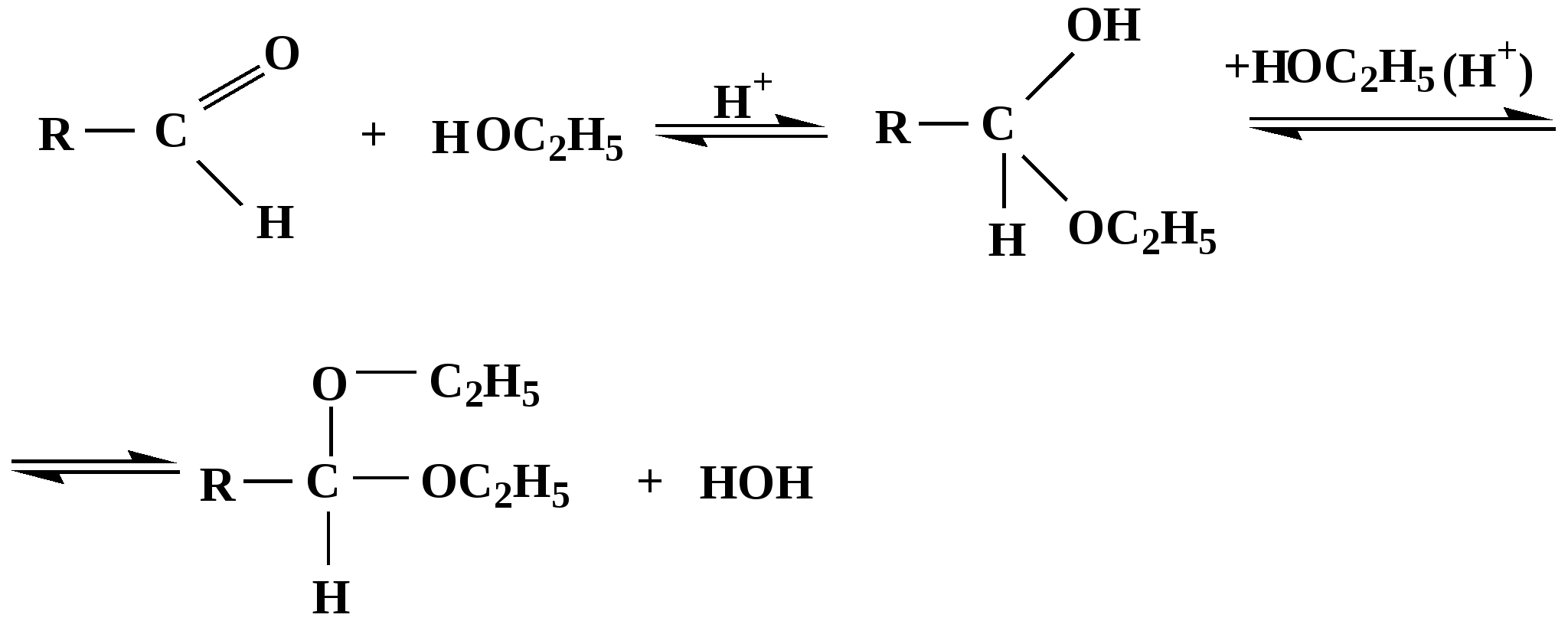 Ацеталь АцетальМеханизм реакции образования полуацеталей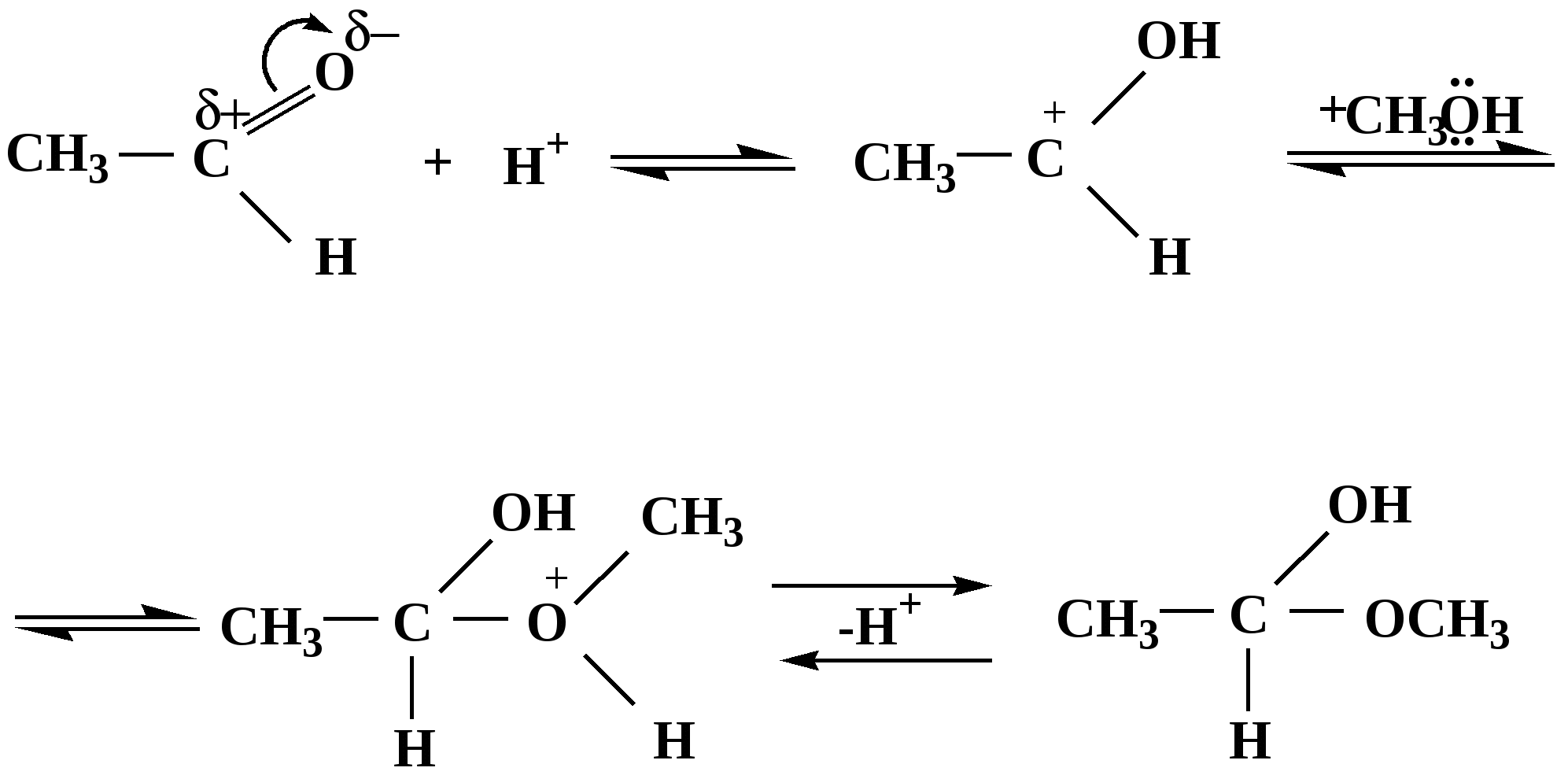 оксонитовый катион метилацеталь уксусного альдегида механизм реакции образования ацеталей диметилацеталь уксусного альдегида диметилацеталь уксусного альдегида1,1-диметоксиэтан Реакция образования полуацеталей и ацеталей обратима в кислой среде. В щелочной среде R – О― – с. 8… ион более трудноуходящая группа, чем гидроксид ион. Гидролиз полуацеталей и ацеталей в кислой средемеханизм реакции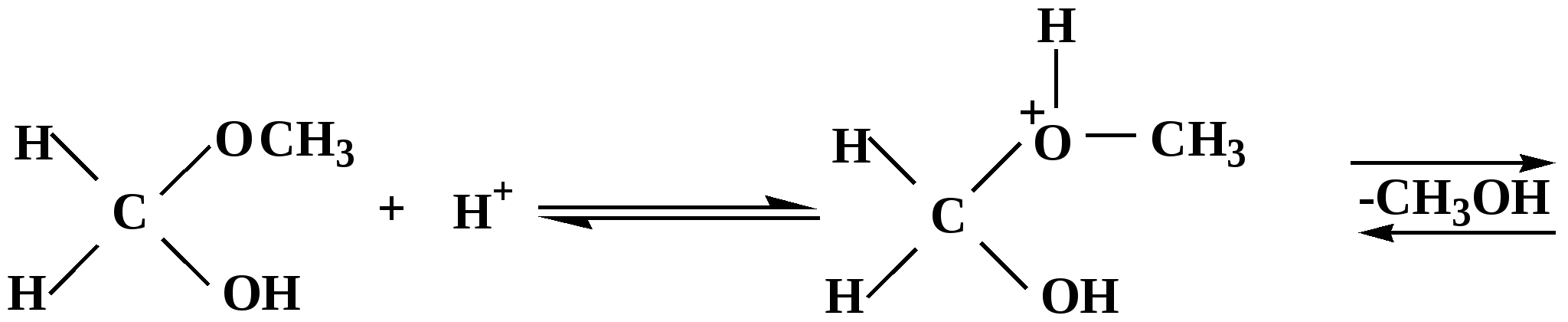 метилацеталь муравьиного альдегида 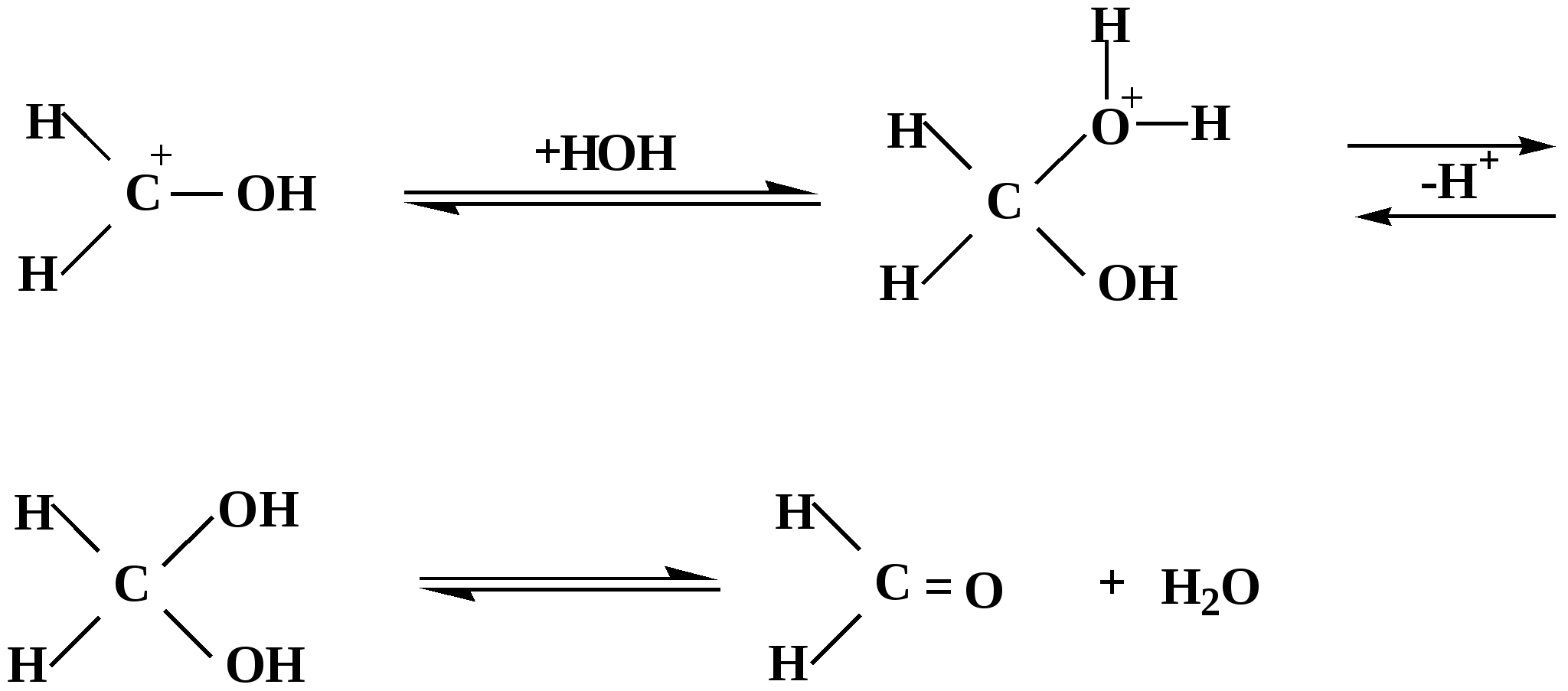 гидратная форма, очень неустойчива Если альдегидная и спиртовая группы находятся в одной молекуле, то за счет внутримолекулярной реакции может образовываться циклический полуацеталь. 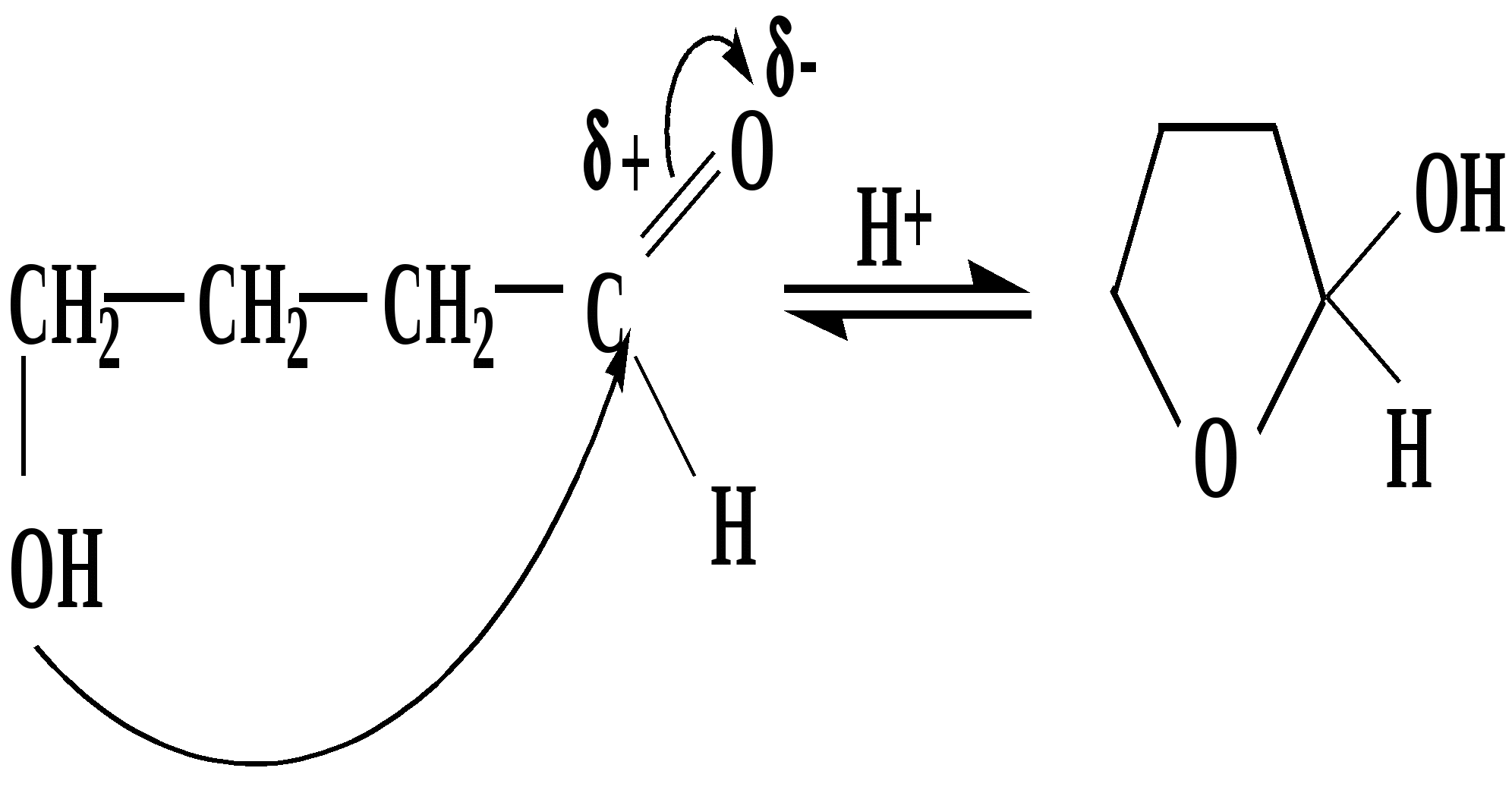 циклический полуацеталь 4-оксибутаналя Эта реакция имеет большое значение в химии углеводов. 3. Присоединение тиолов  полуацеталь тиоацеталь 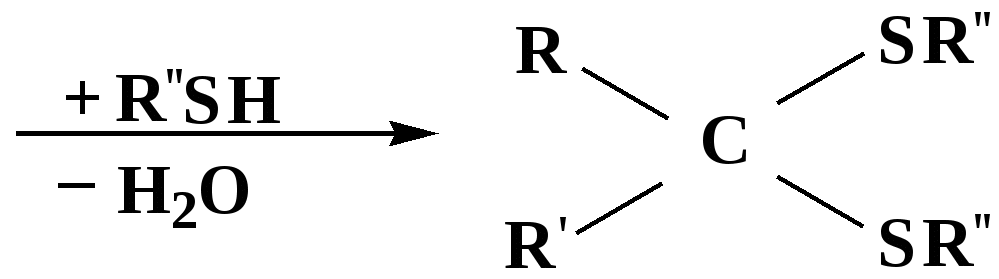 меркаптиль дитиоацеталь 4. Присоединение аммиака, аминов и их производных протекает в 2 стадии: 1 стадия – нуклеофильное присоединение по карбонильной группе. 2 стадия – отщепление воды. Поэтому эти реакции получили название – реакции присоединения отщепления. 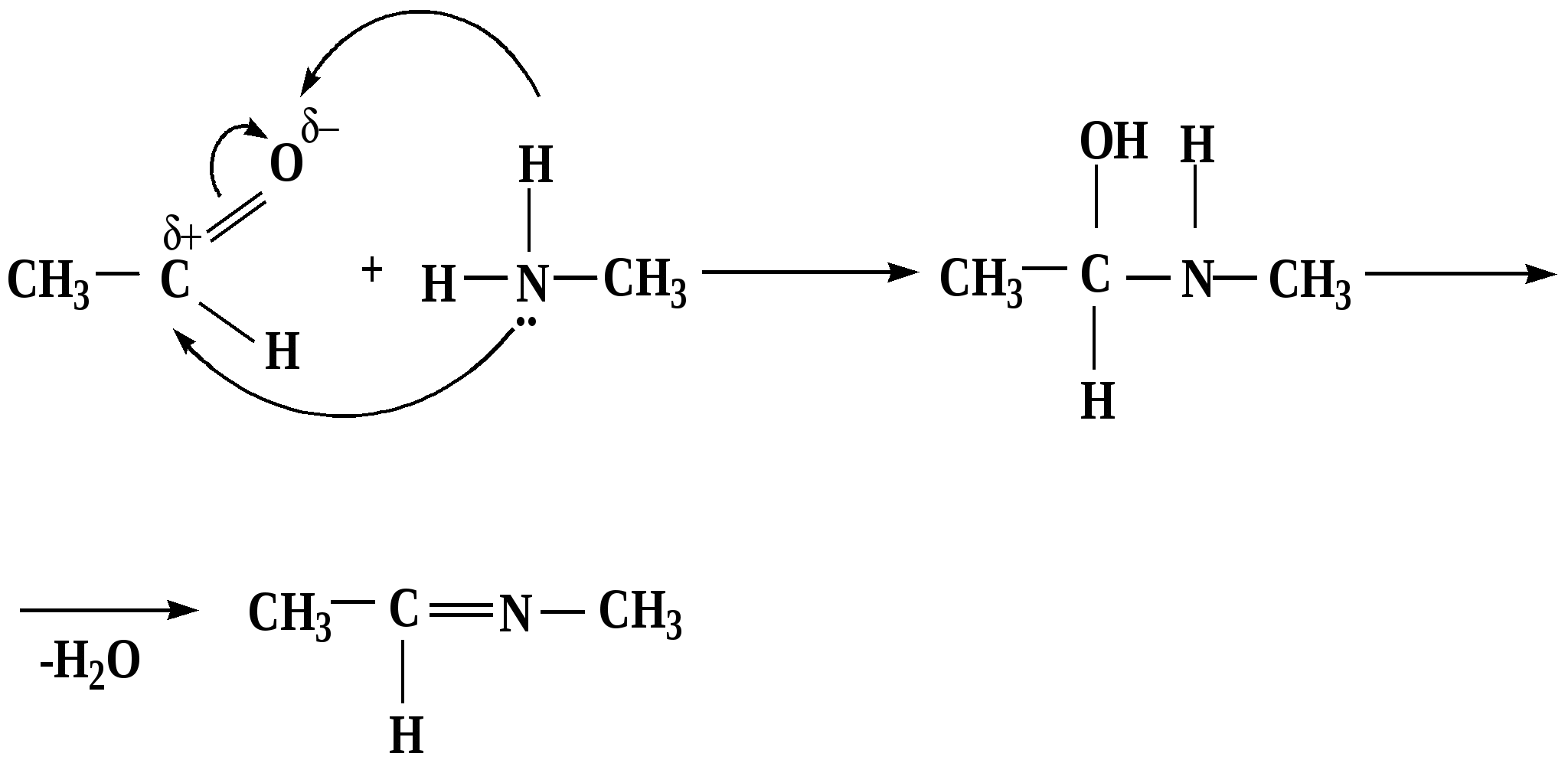 замещенный имин метилимин уксусного альдегида механизм реакции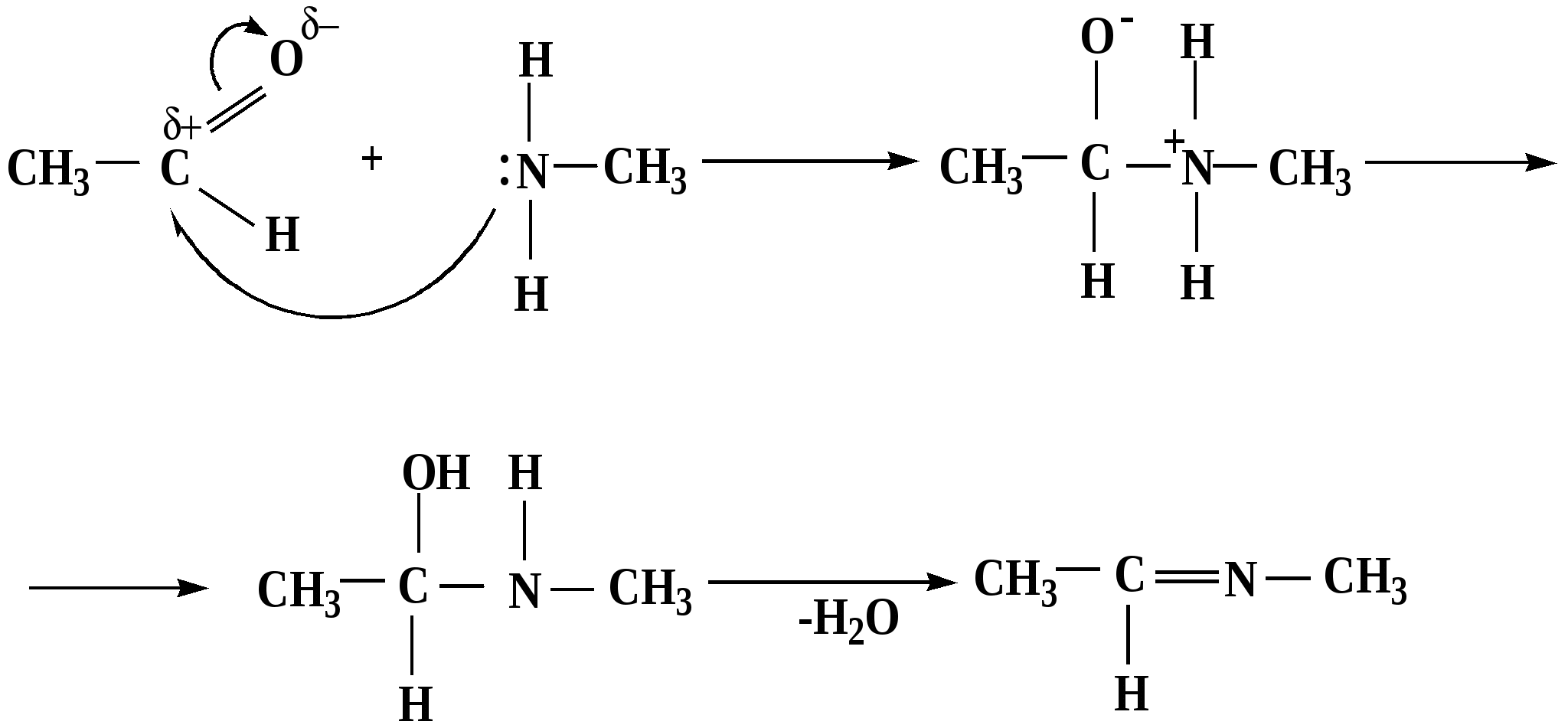 Аналогично взаимодействуют и производные аминов – гидроксиламин, гидразин, фенилгидразины и т.д. Одной из качественных реакций на ацетон является образование оксима ацетона. 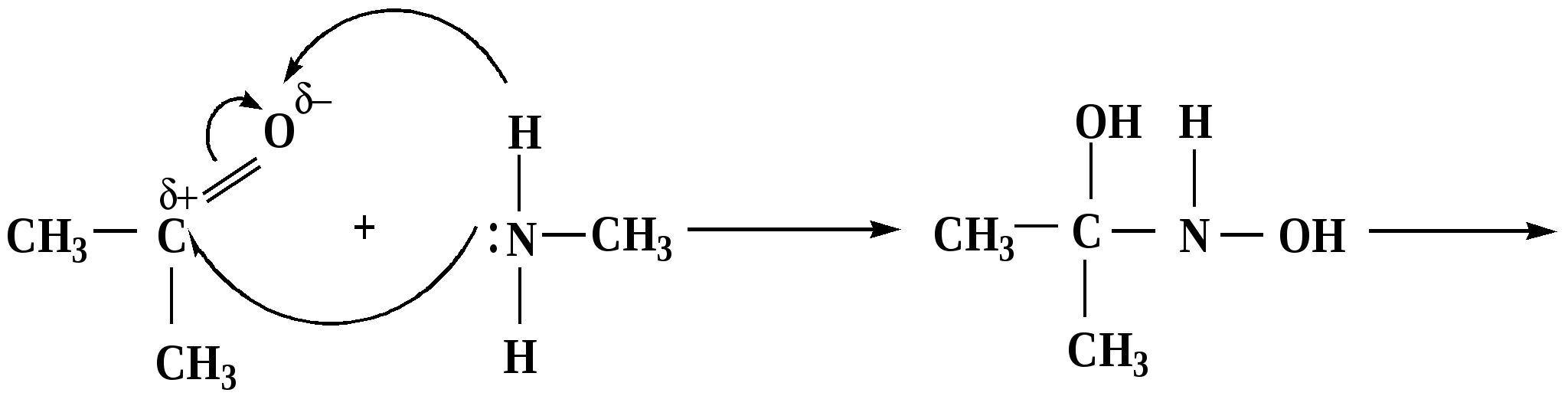 ацетон гидроксил амин ацетон гидроксил амин оксим ацетона Взаимодействие с фенилгидразином  фенилгидразин фенилгидразин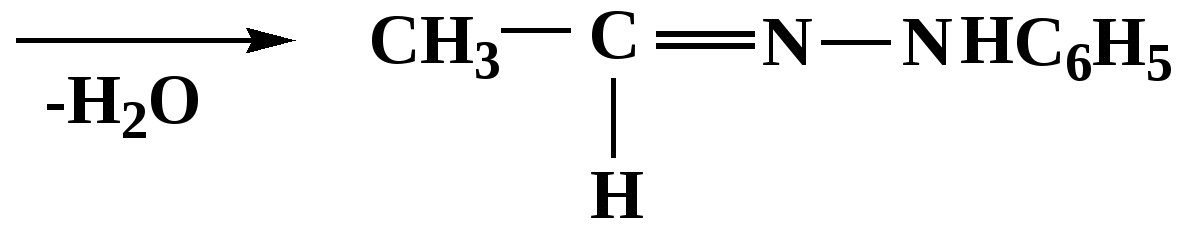 фенилгидразин уксусного альдегида Большое значение в биологическом плане имеет реакция карбонильных соединений (альдегидов и кетонов) с аммиаком, при этом образуются имины (основания Шиффа), очень неустойчивые, легкогидролизующиеся соединения. Имины являются промежуточными продуктами в некотоорых ферментативных реакциях, при синтезе аминов из альдегидов и кетонов.  имин 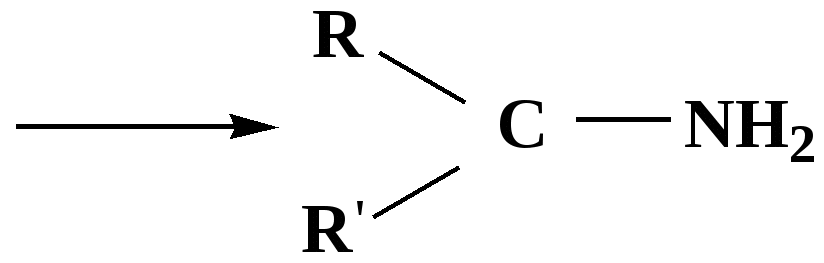 амин Например, в организме по такой схеме синтезируются некоторые α-аминокислоты. Взаимодействие аммиака с альдегидами может осложняться возможной циклизацией. Так, из формальдегида А.М. Бутлеров впервые получил медицинский препарат – гексаметилентетраамин (уротропин), получивший широкое применение в качестве антисептического средства. 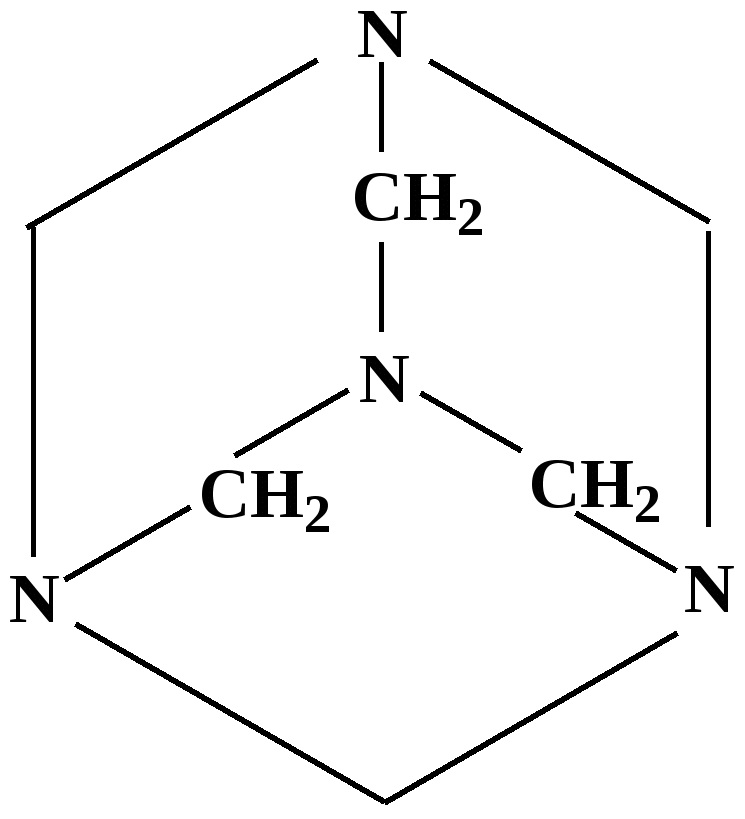 уротропин 5. Присоединение синильной кислоты (НCN) механизм реакции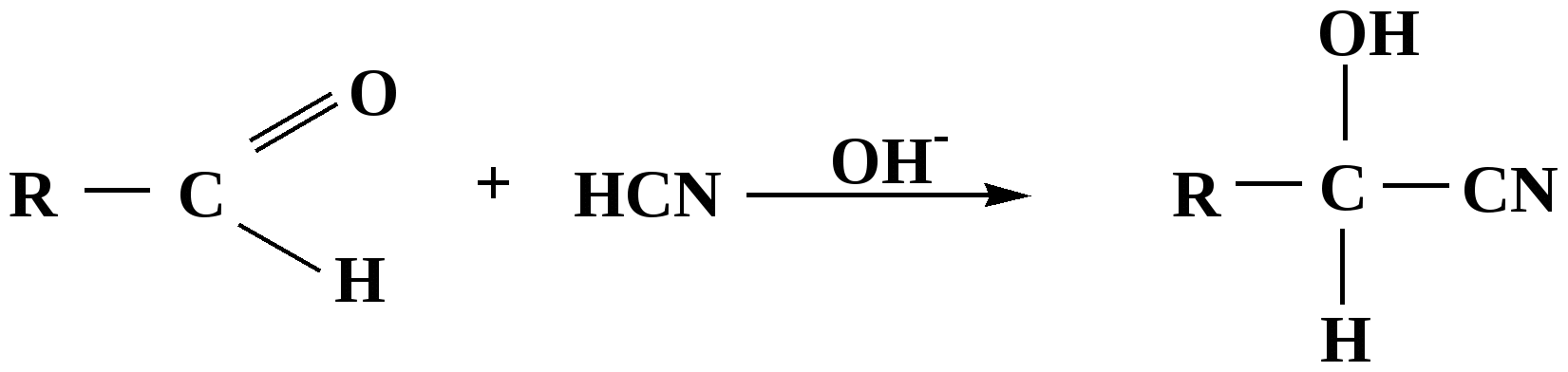  возврат катализатора 6. Реакция альдольной конденсации возможна только для тех карбонильных соединений, молекулах которых имеется α-СН-кислотный центр (подвижные атомы водорода у α-углеродного атома). В присутствии оснований на первой стадии реакции происходит кислотно-основное взаимодействие, поэтому в реакцию могут вступать две молекулы размеченных альдегидов, кетонов.  альдоль 3-гидроксибутаналь 1 стадия 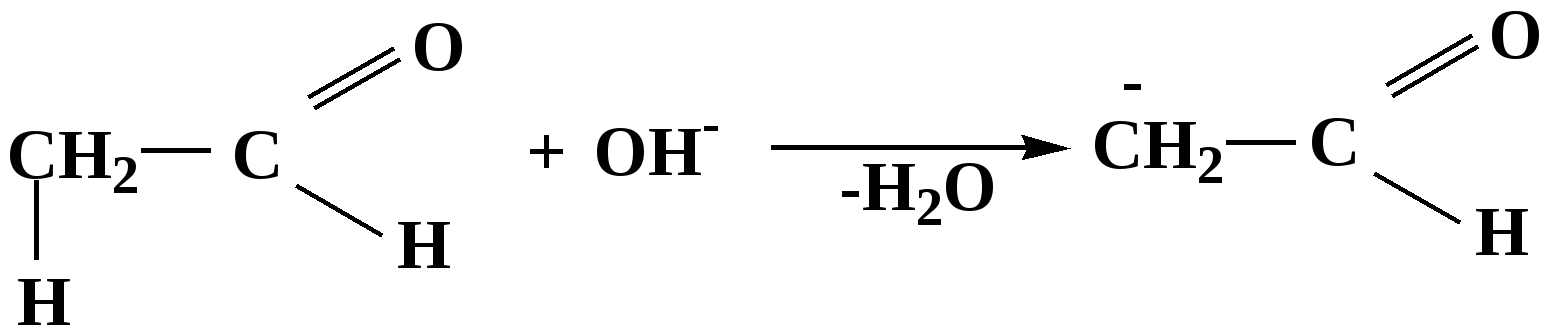 2 стадия 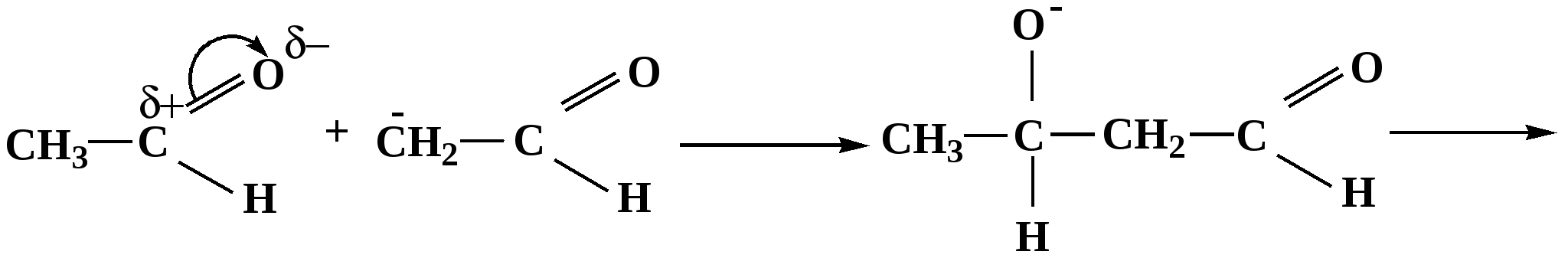  Реакция альдольной конденсации часто сопровождается дальнейшим отщеплением молекулы воды с образованием α,β-ненасыщенных карбонильных соединений (устойчивые сопряженные системы). Эта конденсация получила название кротоновой конденсации. 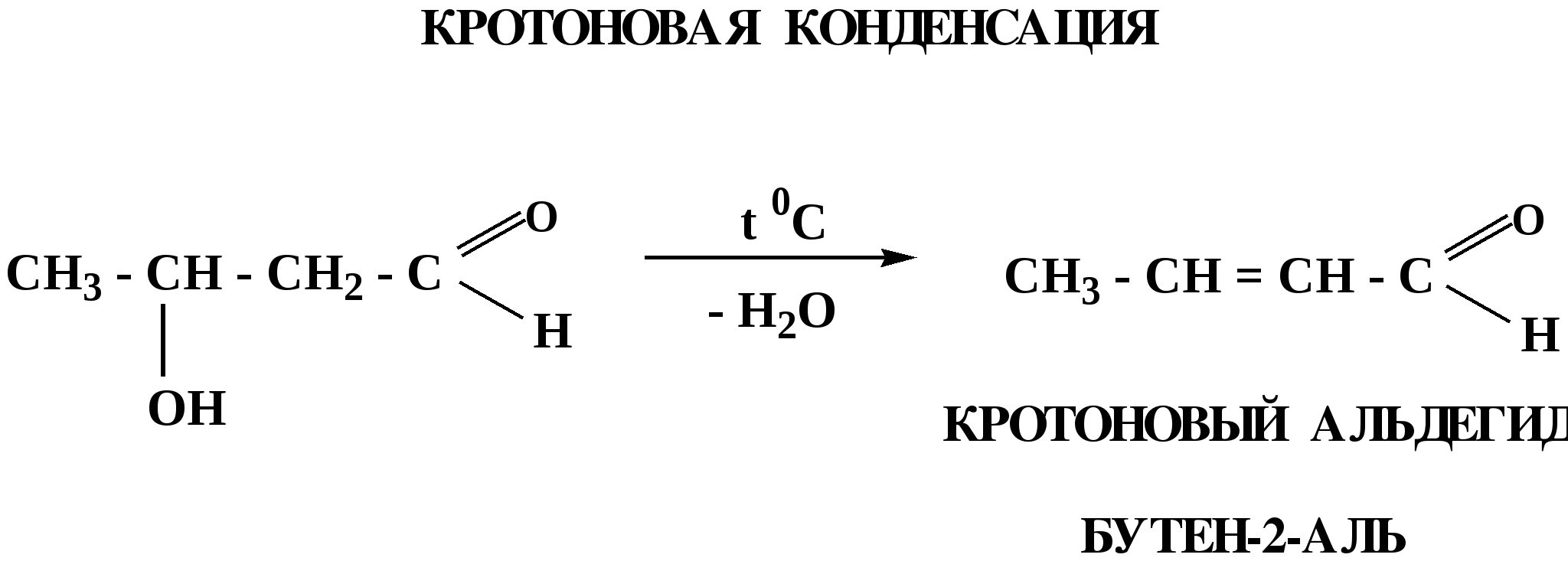 Рассмотрим альдольную конденсацию для пропионового альдегида. 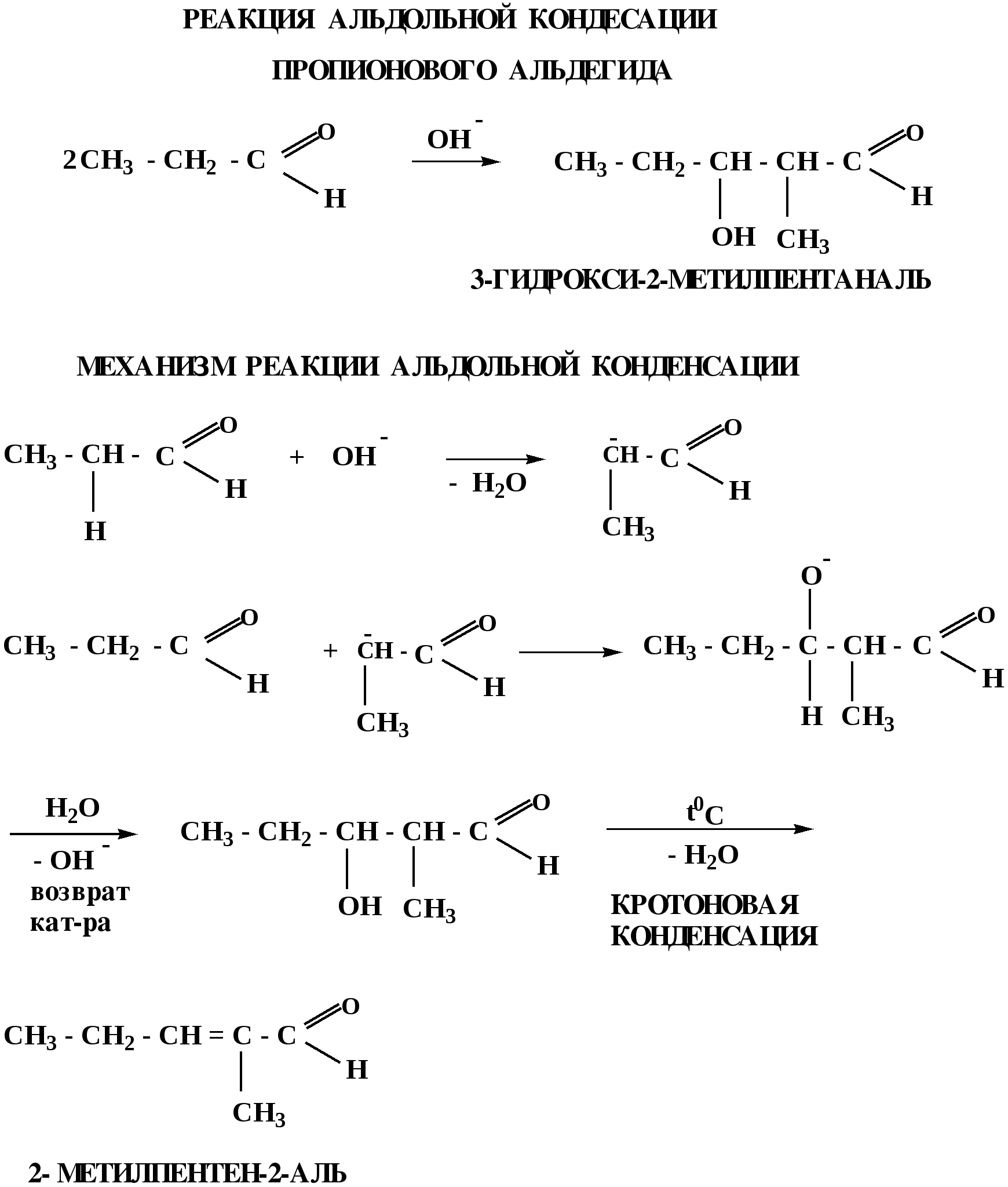 Реакция альдольной конденсации, а также обратная ее реакция - альдольное расщепление в клетках растений и животных осуществляются при участии ферментов. По типу альдольной конденсации в организме происходит взаимодействие α-кетокислот с ацетилферментом А. 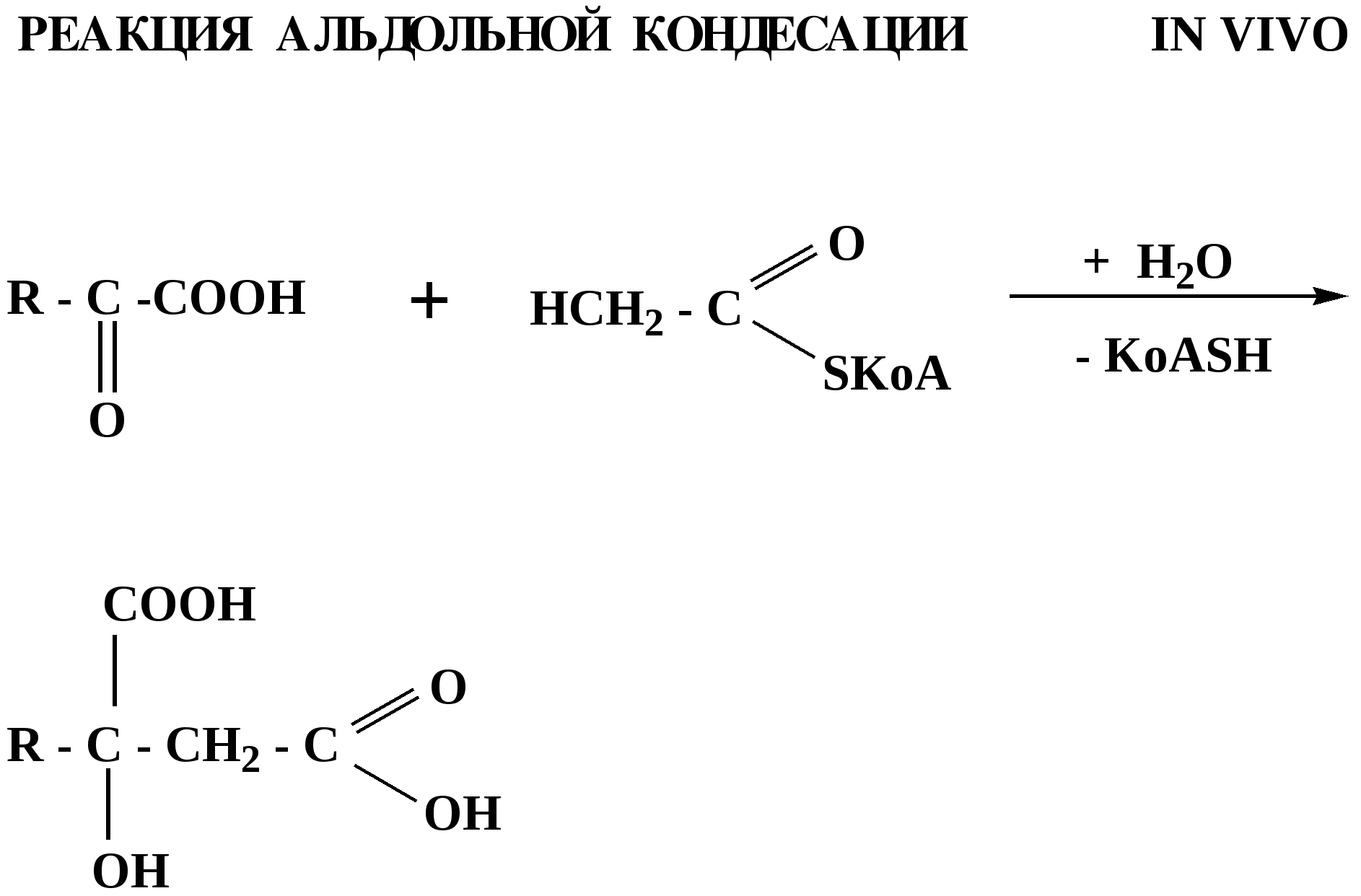 Примером такой реакции является образование лимонной кислоты из ЩУК и ацетилКоА. 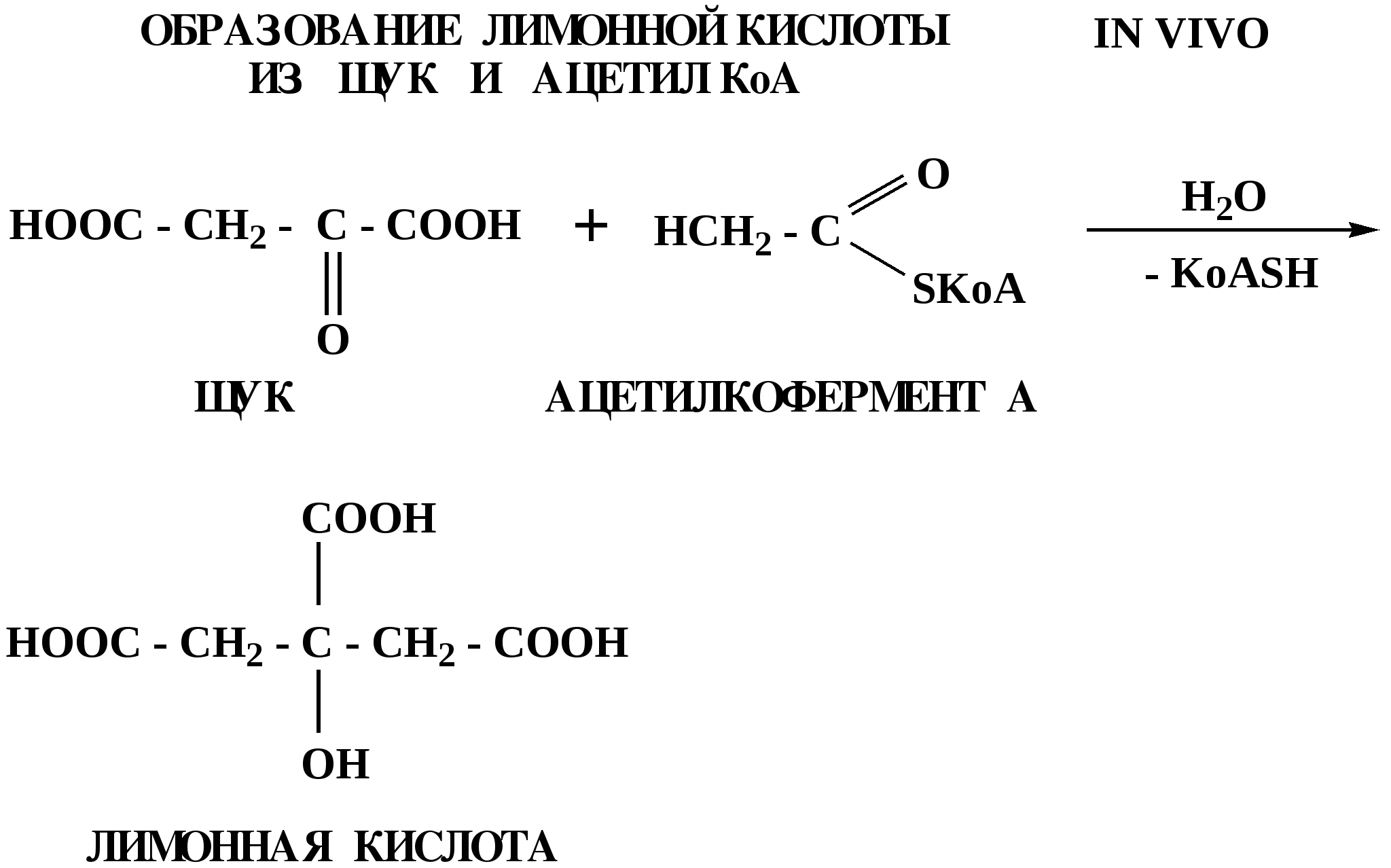 Альдольная конденсация протекает в клетках растений в процессе фотосинтеза, в присутствии основных катализаторов при взаимодействии фосфорилированного диоксиацетона и глицеринового альдегида. Результатом является образование гексозы, а далее поликонденсацией – полисахаридов. 7. Окислительно-восстановительная реакция альдегидов (реакция диспропорционирования или реакция дисмутации). В результате этой реакции одна молекула альдегида окисляется за счет восстановления другой. В органической химии эта реакция именная – Канниццаро-Тищенко. 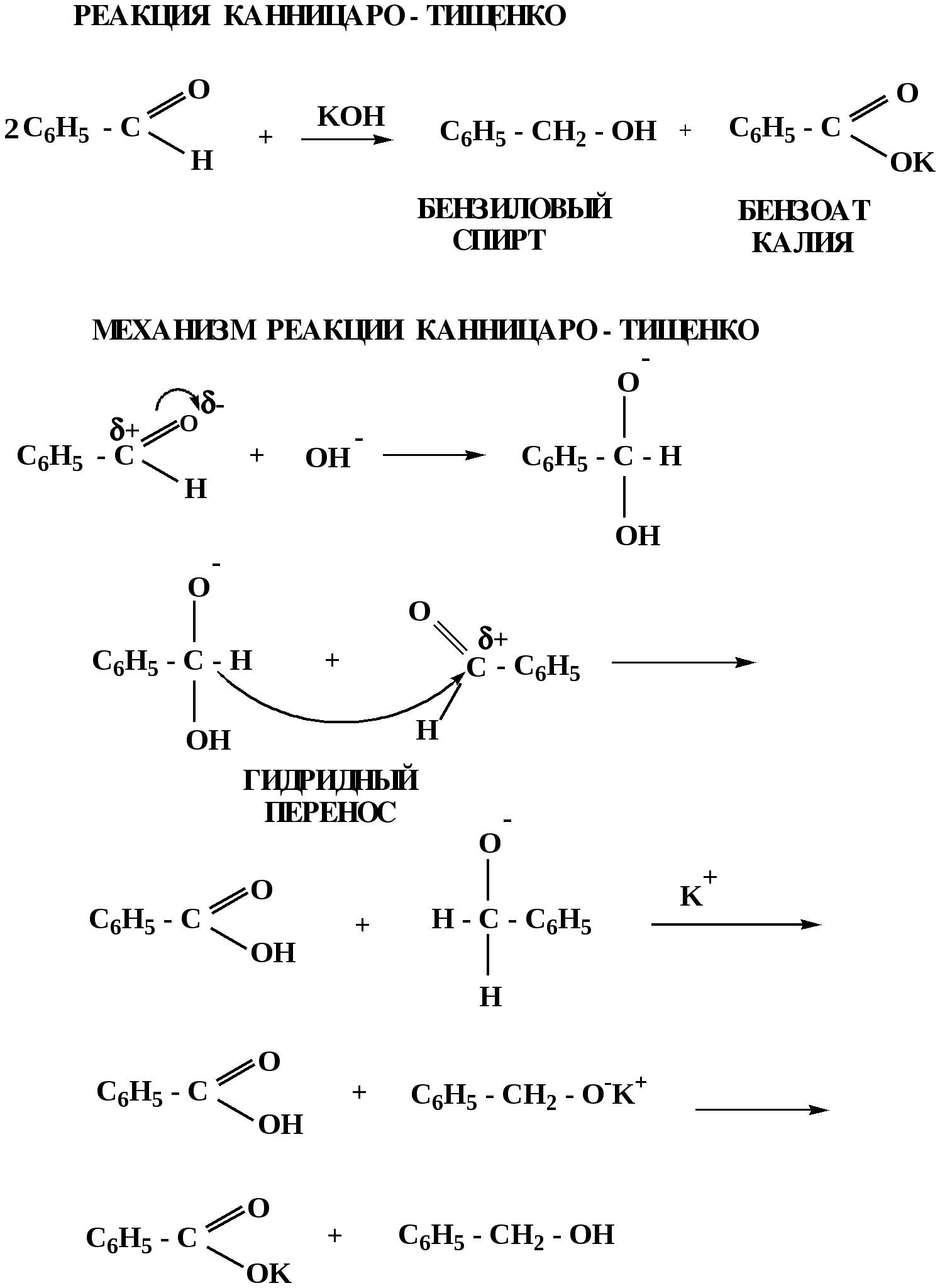 В реакцию Канниццаро-Тищенко вступают альдегиды, не имеющие водородного атома у α-углеродного атома, т.е. ароматические альдегиды, формальдегид и альдегиды, имеющие в α-положении четвертичный атом углерода типа: 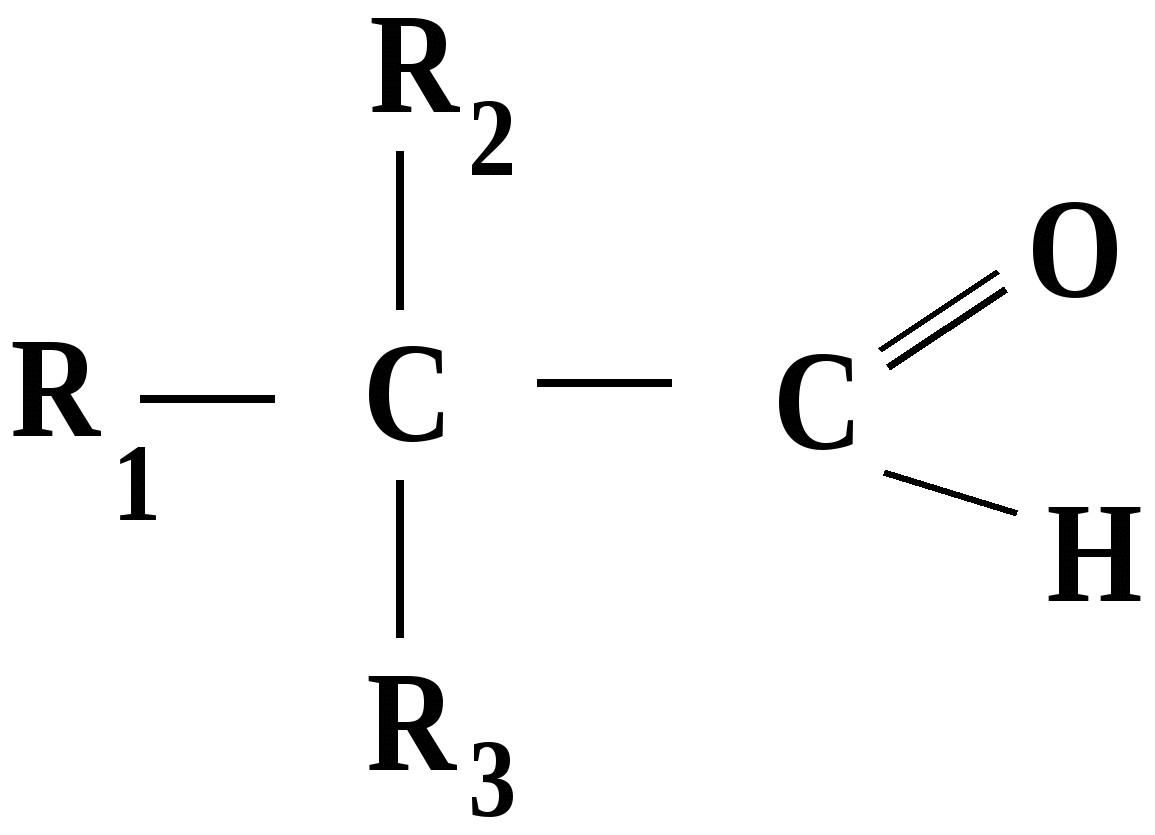 8. Реакции полимеризации характерны для альдегидов. Образование полимеров можно рассматривать как результат нуклеофильной атаки кислородным атомом одной молекулы альдегида карбонильного атома углерода другой молекулы альдегида. 40% формалин при стоянии полимеризуется в полиформальдегид – парафин. 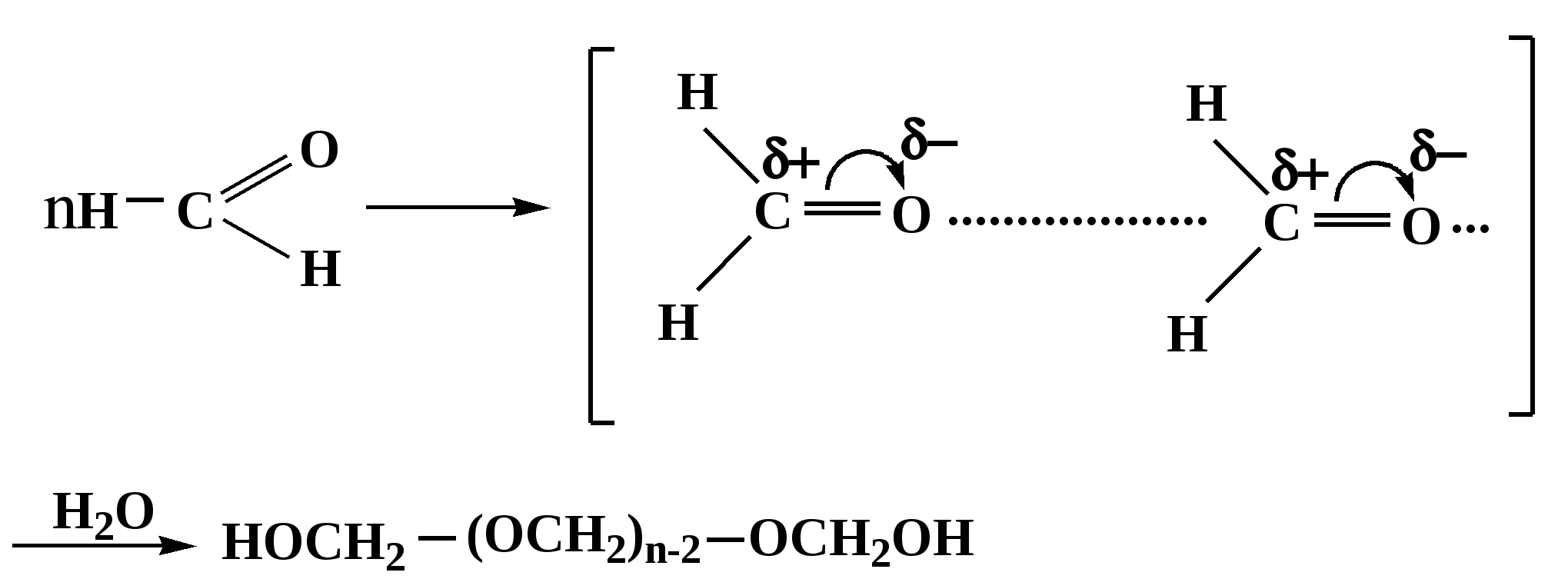 Реакции окисления и восстановления органических соединений Реакции окисления и восстановления имеют большое значение в процессе метаболизма (катаболизма), в цепи переноса электронов и окислительном фосфорилировании, что составляет основу клеточного дыхания. В результате окисления веществ выделяется энергия, которая запасается в форме высокоэнергетических соединений, таких как АТФ, а затем расходуется в процессе анаболизма. Реакция окисления способствует детоксикации и выведению ксенобиотиков. Химические реакции, в процессе которых происходит перенос электронов от одной молекулы к другой, называются окислительно-восстановительными. Под окислением понимают процесс отдачи электронов молекулой, а под восстановлением – приобретение электронов. Восстановители – доноры электронов, окислители – акцепторы электронов. В органической химии под окислением понимают реакции, при которых происходит удаление из молекулы атомов водорода или образование более полярных связей из менее полярных. Пример такого ОВ ряда. 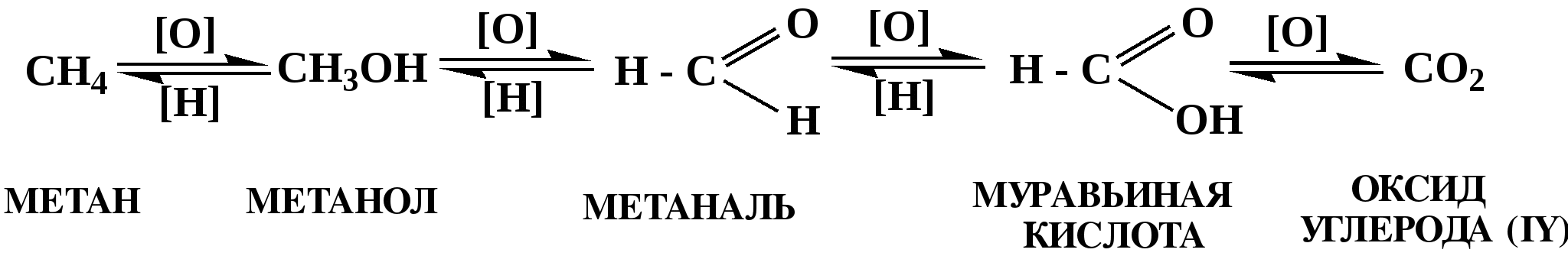 Примерами реакций окисления и восстановления являются реакции дегидрирования и гидрирования. Например, на одной из стадий ЦТК происходит окисление янтарной кислоты до фумаровой 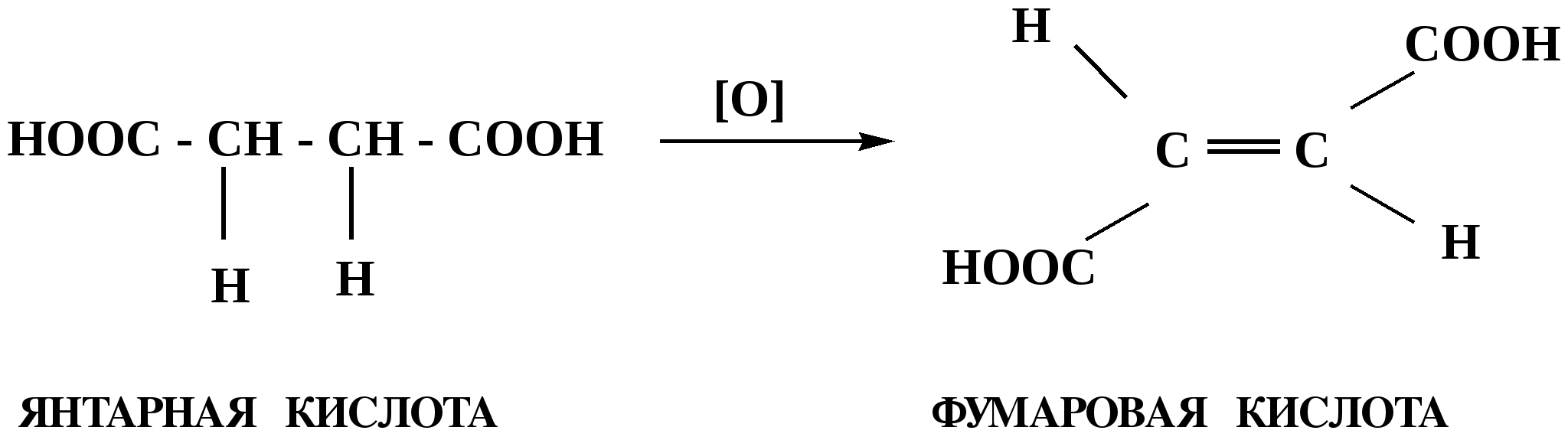 Реакция катализируется ферментом, а коферментом этой реакции является ФАД (флавинадениндинуклеотид). ФАД принимает два атома водорода и превращается в ФАД·Н2. Механизмы окисления и восстановленияСуществуют несколько способов передачи электронов от одной молекулы к другой. 1. Прямой перенос ē (одноэлектронный перенос) Fе2+– ē → Fе3+. Эта ОВ пара может отдавать свои электроны любому восстанавливающемуся соединению. 2. Перенос атома водорода (свободнорадикальный разрыв связи R ÷ Н). 3. Перенос электронов от донора к акцептору в форме гидрид-иона Н –. 4. Перенос путем прямого взаимодействия органического восстановителя с кислородом, приводящего к продукту с ковалентно-связанным кислородом. Примером последней реакции могут служить алифатическое гидроксилирование – один из путей биотрансформации лекарственных средств (ЛС) в организме, приводящий к повышению полярности и гидрофильности ЛС, что способствует их выведению из организма. При этом происходит взаимодействие ЛС с кислородом в митохондриях. Алифатическое гидроксилирование встречается для многих ЛС: бутамида, хрорпамида, диазепама и других ксенобиотиков. Окисление гидроксильных и оксогрупп Спирты обладают большой способностью к окислению, чем насыщенные углеводороды. 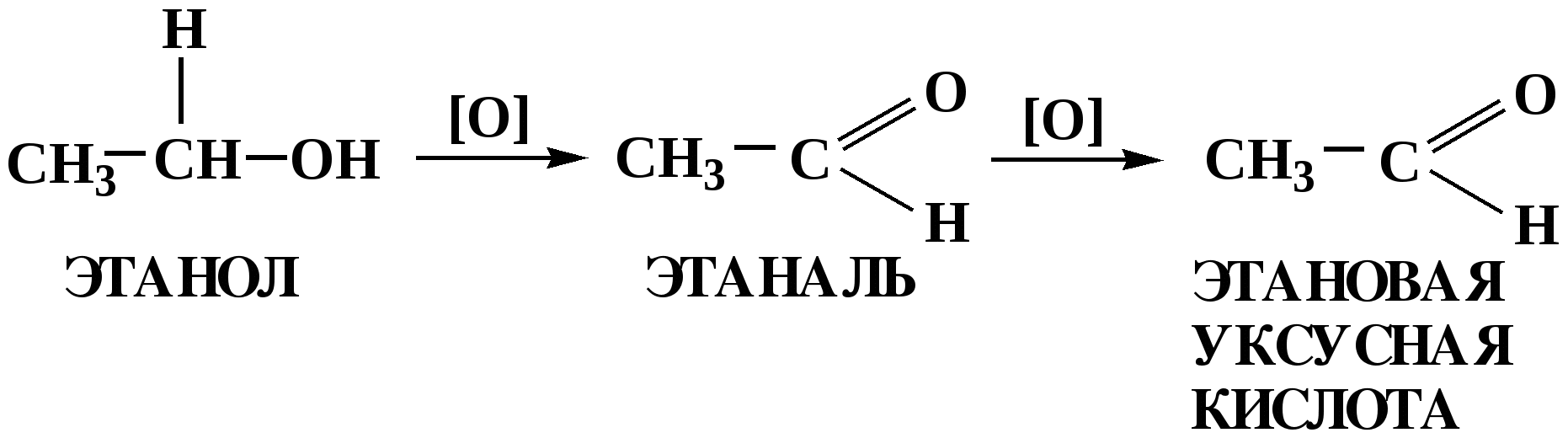  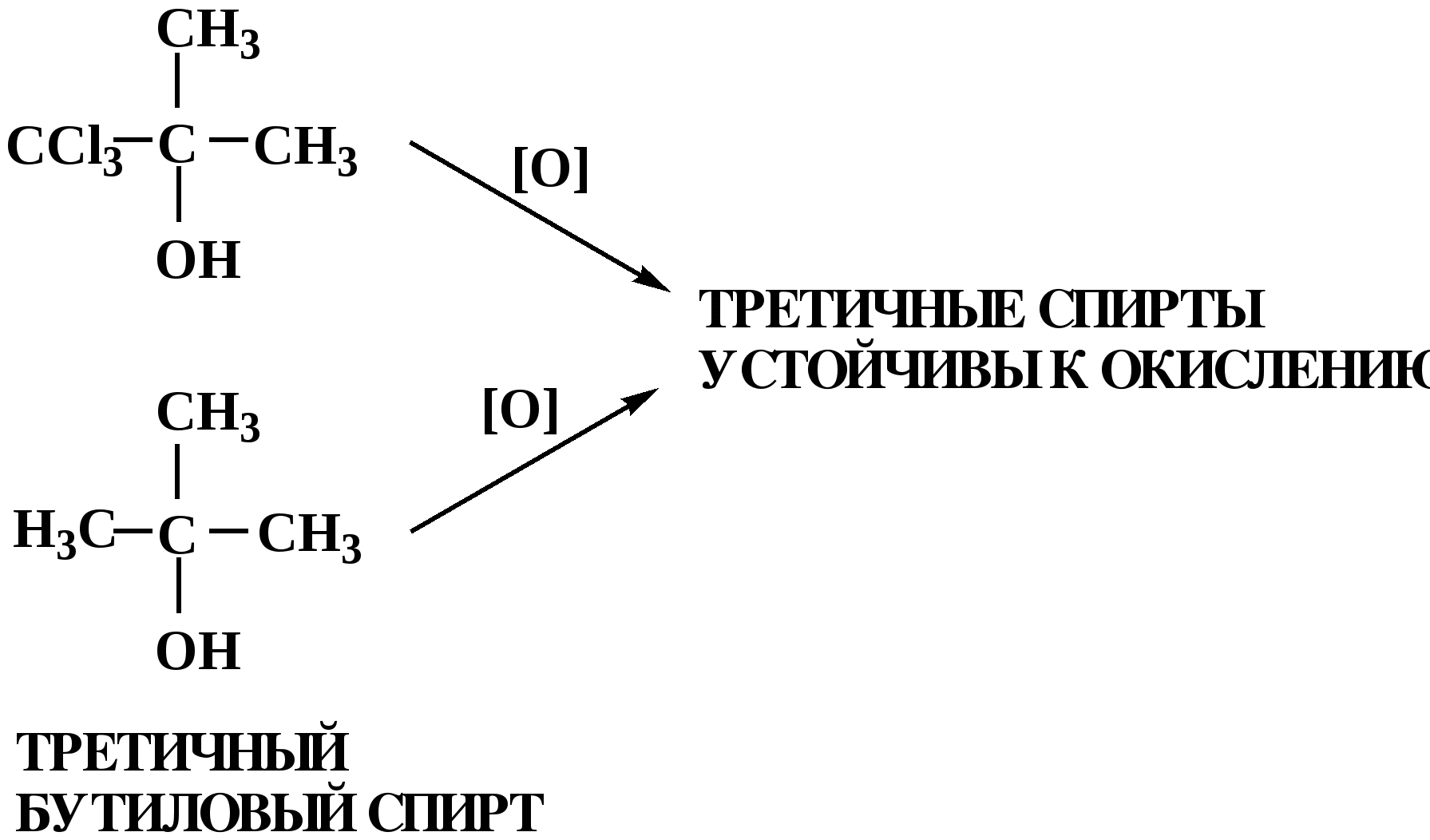 Первичные и вторичные спирты легко окисляются до альдегидов и кетонов соответственно, третичные спирты к окислению устойчивы. Альдегиды окисляются в более мягких условиях, чем спирты, реакция окисления альдегидов до соответствующих кислот является качественной на альдегиды (серебряного зеркала и с Сu(ОН)2). В организме окисление спиртов – ферментативная реакция, катализируется НАД(Ф) – зависимыми дегидрогеназами, коферментом которых является НАД+ ил НАД+, которые выступают в качестве акцептора электронов. 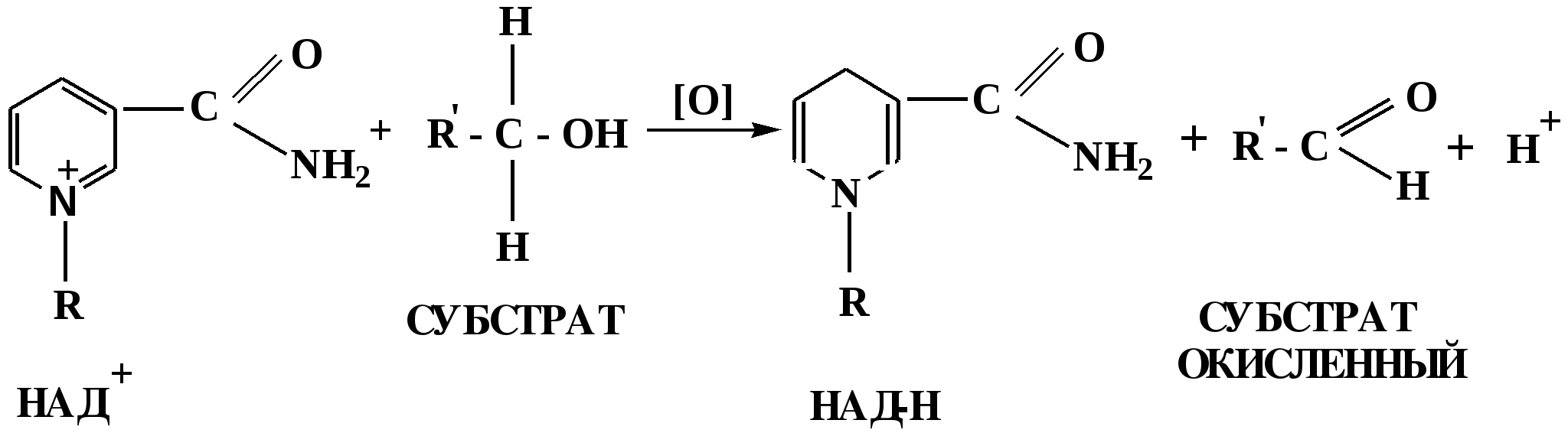 Реакция окисления с участием НАД+ происходит по механизму гидридного переноса. Присоединение гидрид-иона приводит к образованию восстановленной формы НАД·Н. Очевидно, что НАД·Н может в свою очередь выступать в роли поставщика гидрид-иона и тем самым участвовать в реакциях восстановления. Окислительное дезаминирование – пример биологически важной реакции окисления с участием НАД+ зависимых ферментов оксидаз. С помощью этой реакции снижается избыток α-аминокислот в организме, высвобождающийся аммиак включается в цикл мочевины. 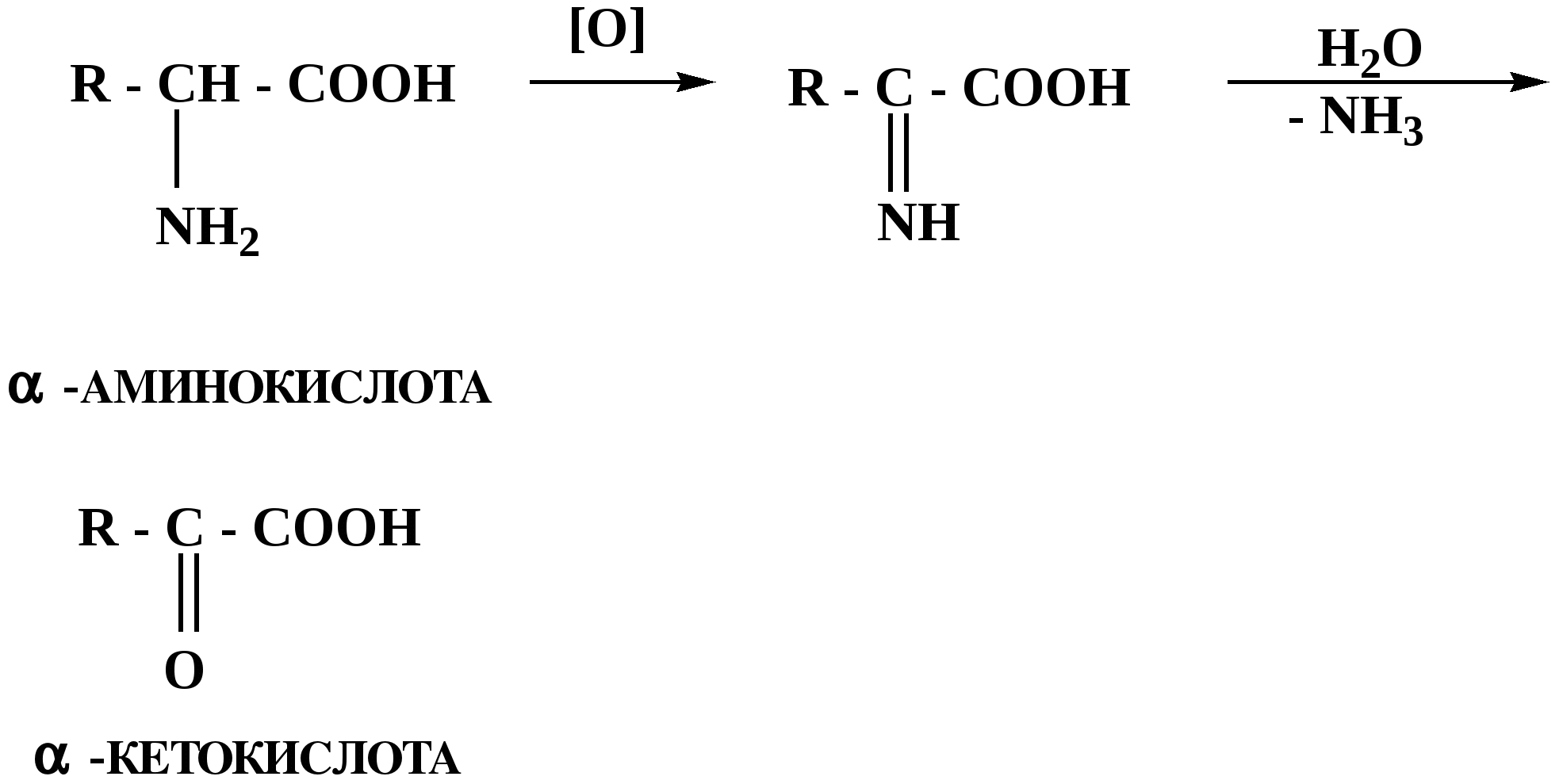 Окисление непредельных и ароматических соединений Микросомальное окисление кислородом двойных связей приводит к образованию эпоксидов. Кислород при этом восстанавливается до Н2О. Эпоксиды конденсированных ароматических соединений канцерогенны. Образование эпоксидов является промежуточным этапом реакцииароматического гидроксилирования. Так, гидроксилирование незаменимой α-аминокислоты – фенилаланина приводит к получению заменимой α-АМК – тирозина. 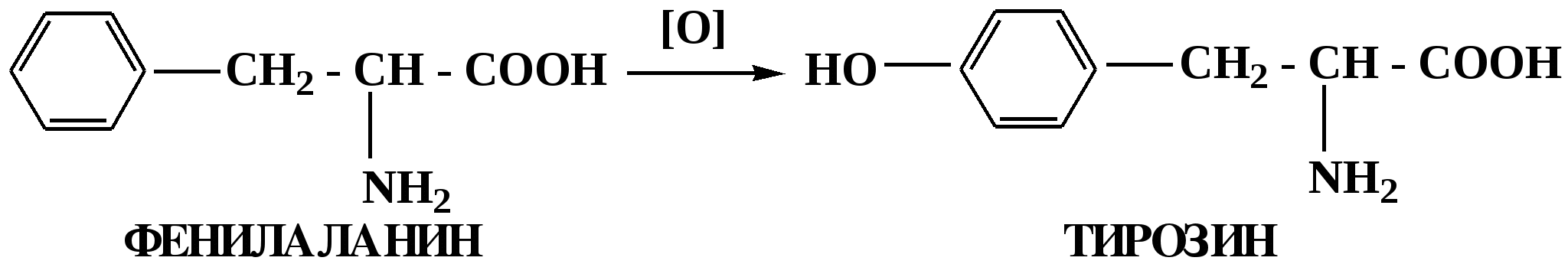 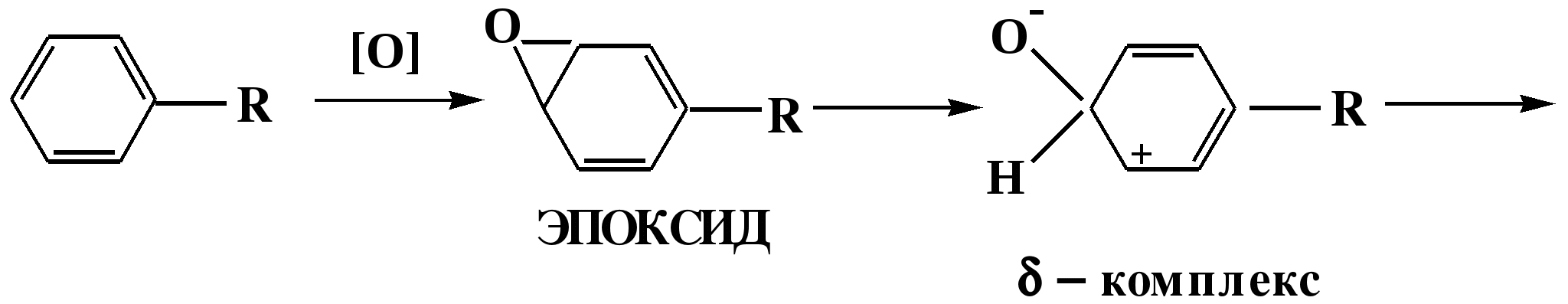  В целом ароматическое кольцо довольно устойциво к окислению, однако у соединений, имеющих алифатические боковые цепи окислению подвергается α-углеродный атом боковой цепи. 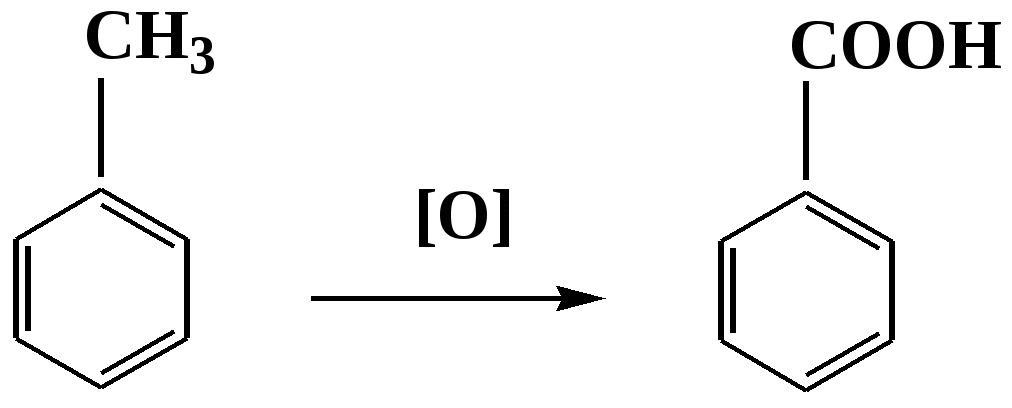 Поэтому толуол менее токсичен, чем бензол, т.к. в организме толуол окисляется в бензойную кислоту, которая в виду высокой полярности сравнительно быстро выводится из организма. Реакции восстановления Реакции восстановления обратны рассмотренным реакциям окисления: восстановление альдегидов приводит к образованию первичных спиртов; кетонов – вторичных спиртов. В качестве восстанавливающего … in vitro используют алюмогидрид лития либо гидриды щелочных металлов. 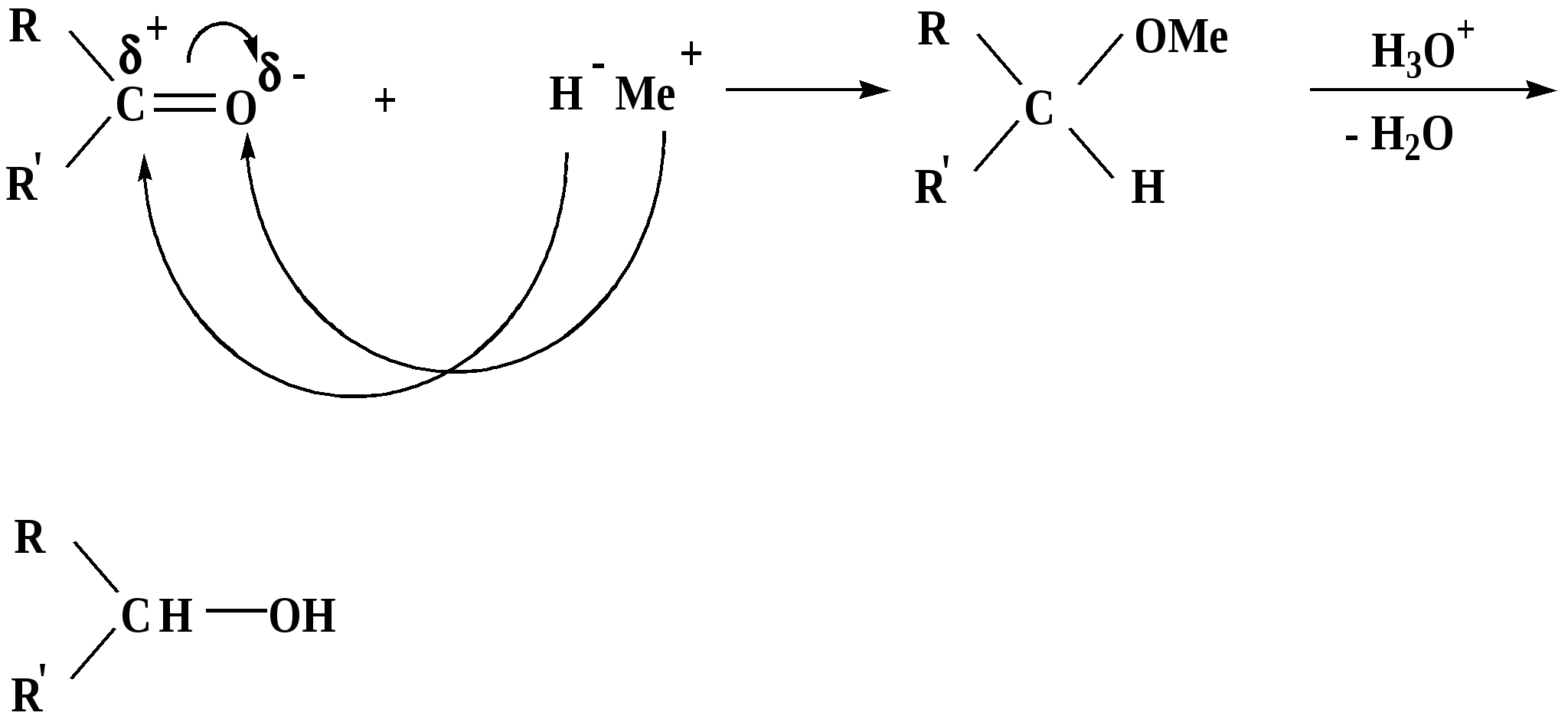 In vivo восстановление карбонильной группы происходит с участием ферментов и коферментом которых является НАД·Н, который поставляет гидрид-ион. 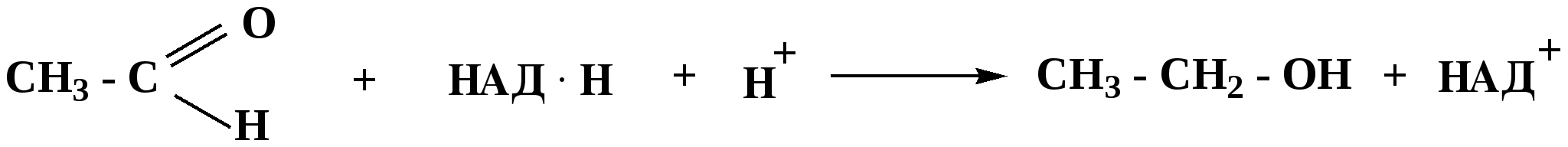 Несколько отличным путем происходит восстановление нитросоединений. Эта процедура характерна для лекарственных средств производных ряда нитрофурана, в которых, в результате биотрансформации происходит восстановление нитрогруппы до аминогруппы через нитрозо- и гидроксиламинное производное.  Обратимые ОВ системы организма К ним относятся системы – гидрохинон, хинон и сульфид-дисульфид. Легкость перехода из окисленной в восстановленную форму и обратимость таких реакций служат основой для их участия в биологически важных процессах.  Система гидрохинон-хинон входит в состав кофермента Q-убихинон, который участвует в переносе электронов. Хинон в митохондриях и дыхательной цепи. 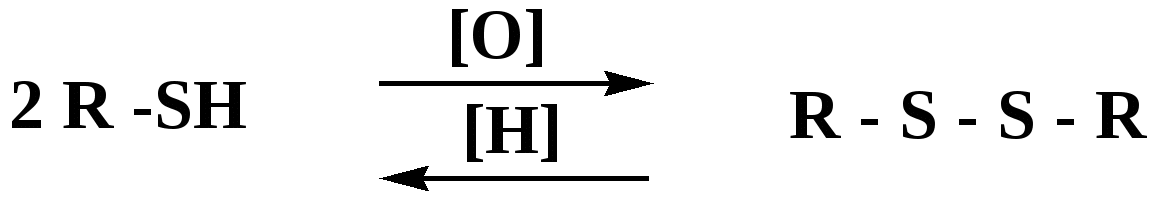 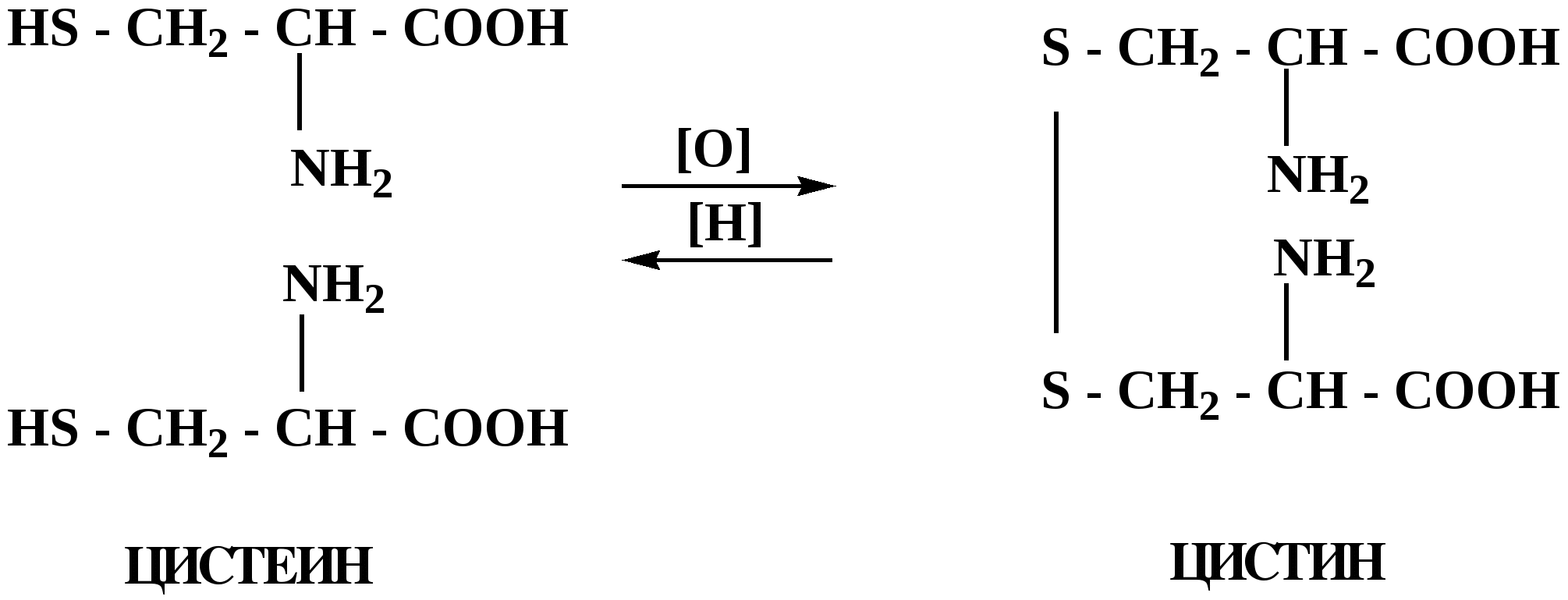 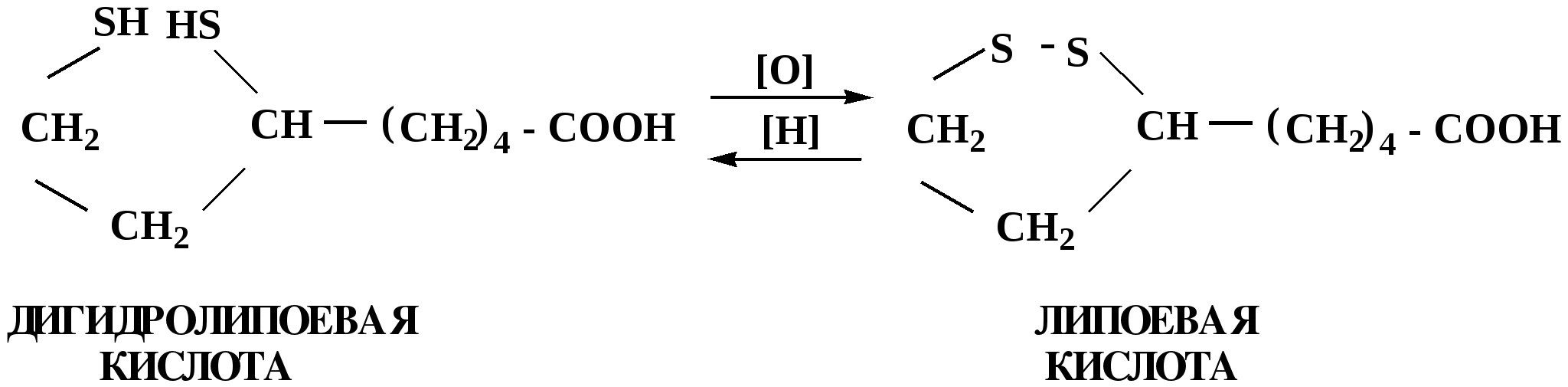 Легкость и обратимость реакций окисления-восстановления в системе тиолдисульфид играют важную роль в формировании пространственной структуры белков. Тиолы легко подвергаются окислению, причем в отличие от спиртов расщепляется не С–Н связь, а ρ–Н связь. Из двух молекул цистеина образуется цистин. Дисульфидная связь содержится во многих пептидах и белках и участвует в создании третичной структуры. Особенно много цистеиновых звеньев в белке волос и шерсти – кератин. Превращение дигидролипоевой кислоты в липоевую играет важную роль в регулировании углеводного и липидного обмена. Радикальные реакции окисления происходят при пероксидном окислении липидов в клеточных мембранах. |
