лекция 5. 5 лекция. Лекция адсорбционная жидкостная хроматография жидкостная хроматография (ЖХ) метод разделения и анализа сложных смесей веществ, в котором подвижной фазой является жидкость. Функции пф
 Скачать 75.34 Kb. Скачать 75.34 Kb.
|
|
5 лекция АДСОРБЦИОННАЯ ЖИДКОСТНАЯ ХРОМАТОГРАФИЯ Жидкостная хроматография (ЖХ) - метод разделения и анализа сложных смесей веществ, в котором подвижной фазой является жидкость. Функции ПФ: перенос десорбированных молекул по колонке; 2) регуляция константы равновесия и удерживание в результате взаимодействия с неподвижной фазой (сорбируясь на поверхности) и с молекулами разделяемых веществ. В ЖХ природа подвижной фазы имеет существенно большее значение. По механизму взаимодействия анализируемого вещества с хроматографической системой современную ЖХ подразделяют: – адсорбционную; – распределительную; – ионообменную; – эксклюзионную; – аффинную и др. Достоинства ЖХ: 1) высокая разделительная способность многокомпонентной смеси; 2) высокая скорость движения хроматографической зоны, позволяющая проводить анализ в небольшой промежуток времени; 3) проведение хроматографического процесса в мягких условиях, обычно при комнатной температуре (термолабильных и нелетучих компонентов), 4) высокая избирательность. Недостатки ЖХ: 1. Недостаточная чувствительностью для определения малых уровней концентрации, особенно в клиническом фармакокинетическом анализе. 2. Некоторые вещества не могут быть детектированы обычно применяемыми в ЖХ фотометрическими методами, если они не поглощают свет в интервале от 190 нм до 80 нм. 3. Методы ЖХ требуют применения большого количества высоко токсичных и пожароопасных органических растворителей. Очистка этих растворителей является трудоемким процессом, а очищенные для целей хроматографии высокого давления спектрально чистые растворители дороги и не всегда доступны. 4. Аппаратура для ЖХ в среднем более дорогая и более сложная в обслуживании. 5. Наполнители для ЖХ дороже, наполнение колонок намного сложнее и может быть выполнено с применением специального дорогостоящего оборудования. АДСОРБЦИОННАЯ ЖИДКОСТНАЯ ХРОМАТОГРАФИЯ В основе сорбции на сорбентах лежит специфическое взаимодействие между полярной поверхностью адсорбента и полярными группами адсорбирующихся молекул. На хроматографическое разделение влияет взаимодействие адсорбента, пробы и элюента. Адсорбенты и их свойства полярные адсорбенты (силикагель и окись алюминия) - пористые либо поверхностно-пористые материалы (ППМ). Это типичные окисные полярные адсорбенты с одинаковым рядом элюирования. Однако селективность их различается. Например, окись алюминия более чем силикагель пригодна для разделения многоядерных ароматических углеводородов. химически модифицированные сорбенты. Неподвижные неполярные фазы называют «обращенными фазами» (ОФ). Силикагель В ЖХ применяют силикагели с большой удельной поверхностью (> 200 м2/г), большим удельным объемом пор (> 0,7 мл/г) и средним диаметром пор (80–150 А°). Окись алюминия относят к полярным адсорбентам. По хроматографическим свойствам она очень напоминает силикагель, но молекулы насыщенных веществ удерживаются на ней, как правило, сильнее. Осложнения, обусловленные необратимой адсорбцией (хемосорбцией) при разделении на окиси алюминия наблюдаются чаще, чем на силикагеле. В окиси алюминия, полученной из байерита, сохраняется остаточное количество байерита в форме алюмината натрия. рН водных соединений такой окиси алюминия равен 9, и поэтому ее называют «основной». При обработке основной окиси алюминия сильными кислотами, например, соляной, протекает следующая реакция: AlO–Na+ + 2HCl > Al – Cl + NaCl + H2O. Обработанная окись алюминия дает водную суспензию с рН 3,0, и поэтому ее называют «кислой» солью алюминия; она является анионным обменником. При осторожной нейтрализации получают «нейтральную» окись алюминия, не проявляющую ни катионо-, ни анионообменных свойств. Требования к элюентам: 1. позволяет опознать пробу. 2. должен растворять пробу. 3. легко и количественно удаляем 4. с низкой вязкостью. 5. Недопустимы необратимые взаимодействия элюента ни с пробой, ни с адсорбентом. Элюотропный ряд - экспериментально установленная последовательность растворителей, расположенных в соответствии с увеличивающейся элюирующей силой. Чем меньше время удерживания пробы, тем больше полярность растворителя. Последовательность растворителей в ряду всегда такова, что адсорбция, из стоящих в начале ряда, для данной пробы является наибольшей (больше всего время удерживания). Чем ниже стоит элюент в ряду, тем меньше время удерживания и тем больше его элюирующая сила, которая в конце концов становится такой большой, что проба больше вообще не удерживается. В таблице 1 приведены важнейшие органические растворители. Таблица 1 - Элюотропный ряд важнейших растворителей для адсорбционной хроматографии 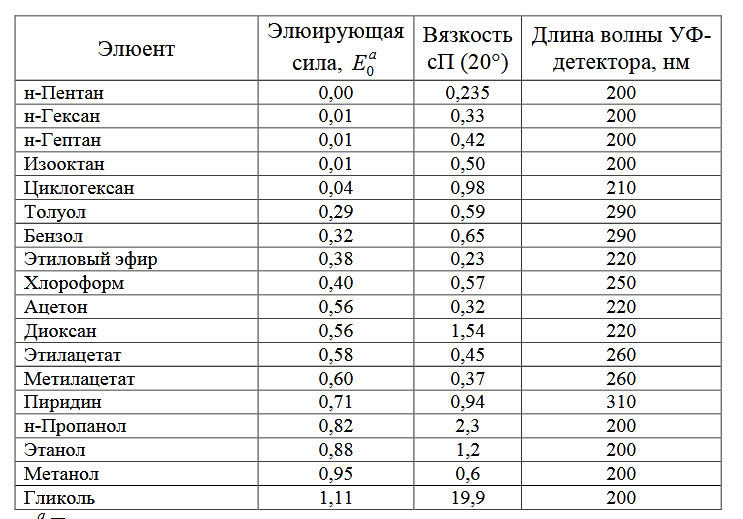 Элюирующая сила элюентов должна быть такой, чтобы значения К' (отношение времен удерживания в неподвижной и подвижной фазах) были меньше 10. Молекулярная структура и состав вещества влияет на выбор пробы твердой неподвижной фазы и элюента. Сила удерживания зависит почти исключительно от вида и числа функциональных групп в молекуле. Так, среди членов гомологического ряда удерживание усиливается с увеличением молекулярной массы. При этом взаимодействие функциональной группы с поверхностью адсорбента должно быть беспрепятственнымоно не должно быть затруднено стерически. Если функциональные группы в подобных молекулах вступают во взаимодействие друг с другом, например, образование водородной связи, то в результате этого меняются сила и вид взаимодействия с поверхностью адсорбента. Пример: орто- и пара-нитрофенолы: время удерживания орто-нитрофенола (внутримолекулярная водородная связь) значительно меньше, чем время удерживания пара-нитрофенола. Удерживание некоторого соединения R – X, где R – органический радикал, X – функциональная группа, увеличивается в ряду: алкил < галоген (F < Cl < Br < I) < простой эфир < третичный амин < нитрил < нитросоединение < эфир карбоновой кислоты < кетон < альдегид < первичный амин < амид карбоновой кислоты < спирт < фенол < карбоновая кислота < сульфокислота. Сила удерживания зависит также от стерических факторов. Цис- изомеры всегда удерживаются сильнее, чем транс-изомеры. 2) от величины молекулы (молярного объема), особенно в неполярных системах. В классических адсорбционных системах влияние дисперсионной силы уменьшается с увеличением полярности элюента. |
