Лекция Амины. Лекция Амины (1). Лекция амины производные аммиака, в которых атомы водорода замещены углеводородными группами, называются аминами
 Скачать 0.56 Mb. Скачать 0.56 Mb.
|
|
ЛЕКЦИЯ АМИНЫ Производные аммиака, в которых атомы водорода замещены углеводородными группами, называются аминами. 2.1. КЛАССИФИКАЦИЯ, НОМЕНКЛАТУРА, ИЗОМЕРИЯ. Изомерия аминов определяется положением аминогруппы в углеродной цепи, количеством углеводородных групп и их строением. В зависимости от количества углеводородных групп, с которыми связана аминогруппы, различают первичные, вторичные и третичные амины. По числу аминогрупп в молекуле амина различают моно- ди- три- и полиамины. В зависимости от природы углеводородного радикала, с которым соединена аминогруппа различают амины алифатические, ароматические и алкилароматические. Действуют три номенклатуры. Тривиальные названия, например, анилин, толуидин, анизидин. Название по рациональной номенклатуре сроятся как производное аммика, добавкой суффикса «амин» к названию углеводородного радикала. По систематической номенклатуре, цифрой указывается положение аминогруппы и к названию углеводорода добавляется суффикс «амин». В иерархии заместителей аминогруппа следует за нитрогруппой перед алкильными радикалами обозначается префиксом «амино». В систематической номенклатуре сохраняется тривиальное название «анилин». Например: 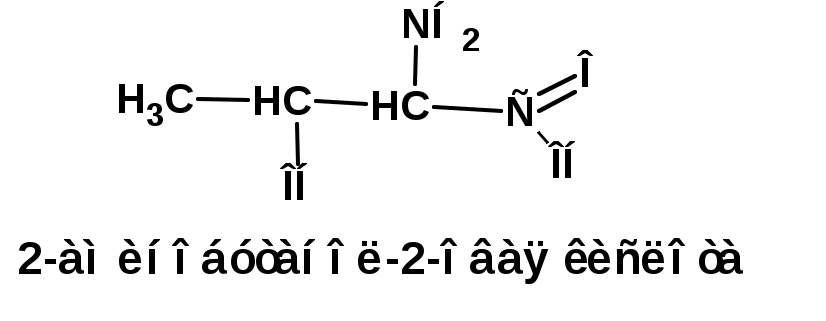 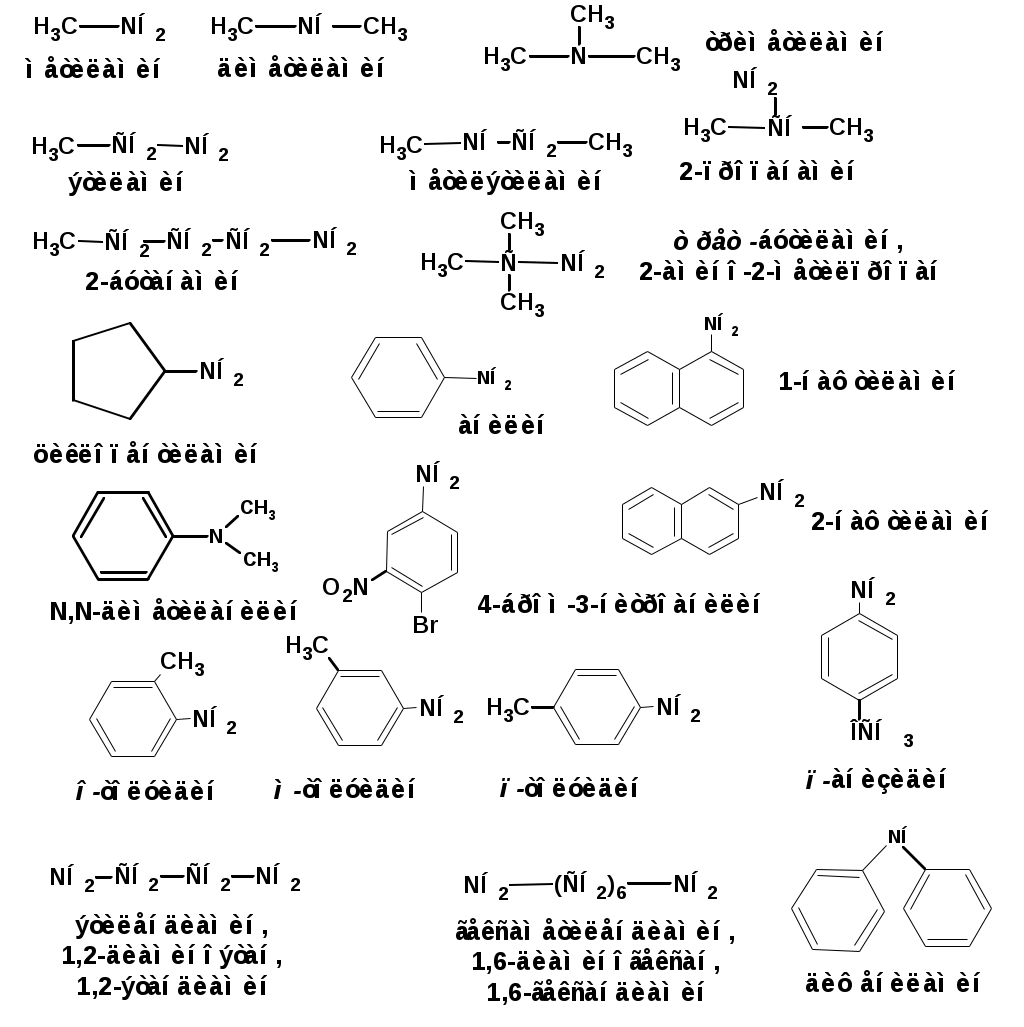 2.2. СПОСОБЫ ПОЛУЧЕНИЯ 2.2.1. Восстановление нитросоединений 2.2.2. N-алкилирование и N-арилирование 4. Аммонолиз спиртов Пропусканием паров спирта и аммиака при температуре 3000 над катализатором (оксид алюминия или двуокись тория) получают смесь первичных, вторичных и третичных аминов с преобладанием первичных: 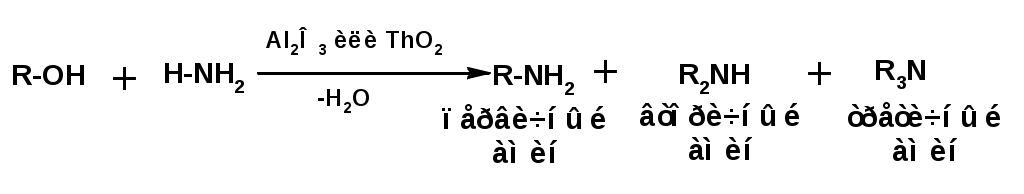 3. Реакция аммиака и аминов с галогенопроизводными. Действием аммиака на галогенопроизводные по реакции нуклеофильного замещения получают смесь солей первичных, вторичных и третичных аминов: 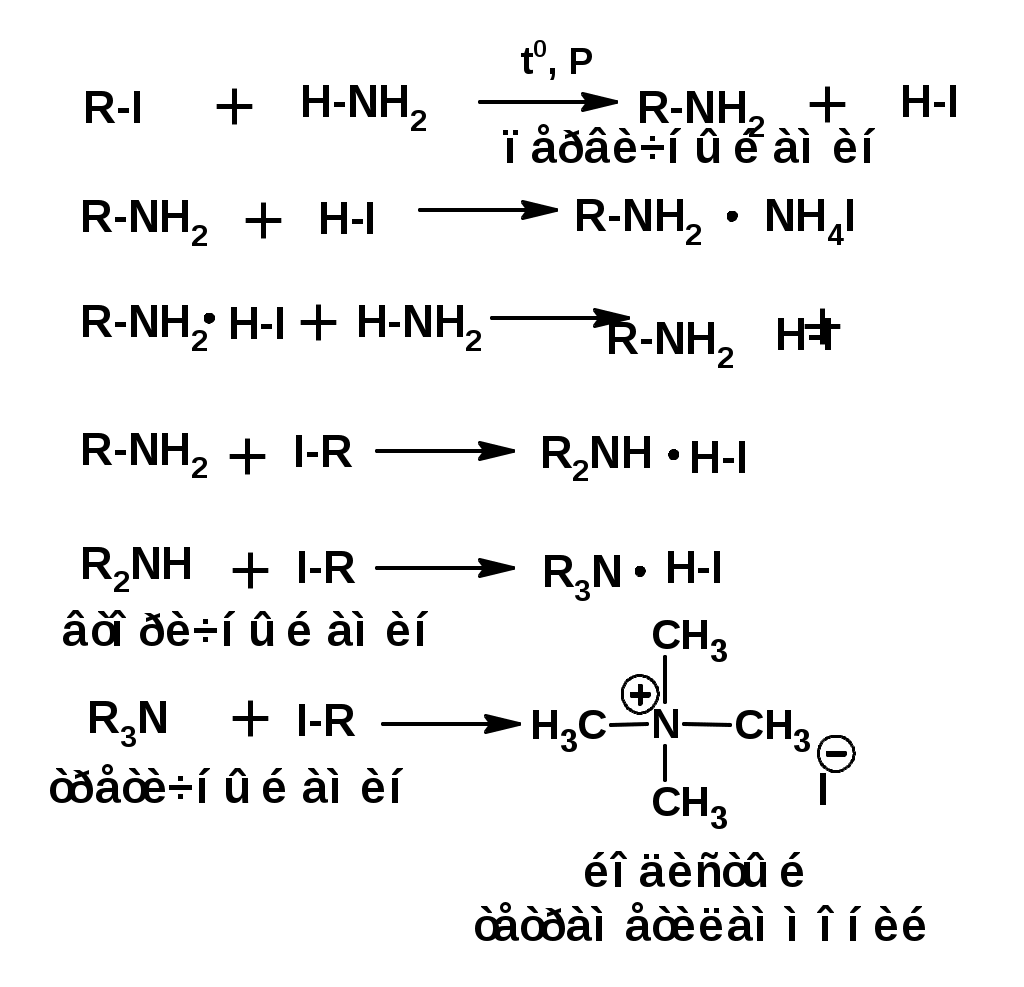 Подобным способом получают анилин: 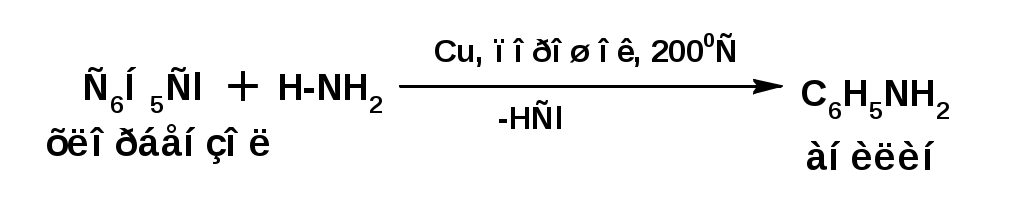 N-алкилируют анилин: 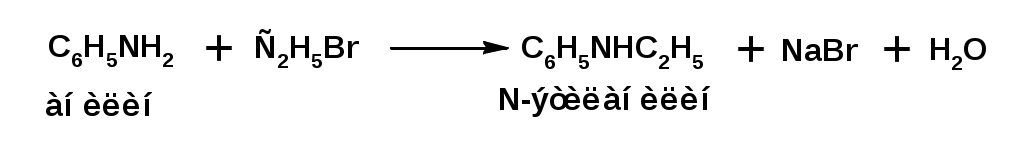 N-арилируют анилин: 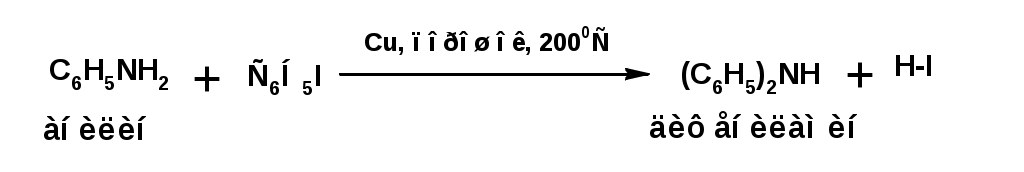 2.2.3. Гипогалогенитная реакция Гофмана 2. Амиды кислот при расщеплении гипобромитом или гипохлоритом дают первичные амины: 2.2.4. Восстановление оксимов и нитрилов 1. Для восстановления оксимов примняют каталитическое гидрирование или обработку литийалюминийгидридом: 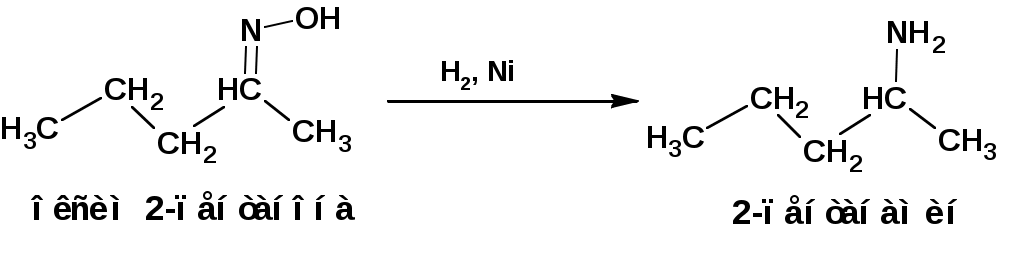 Нитрилы при каталитическом гидрировании также образуют первичные амины: 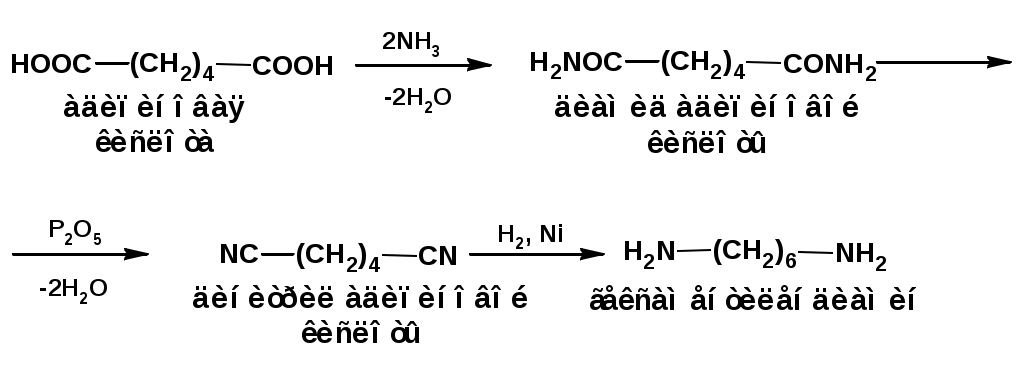 2.4. ФИЗИЧЕСКИЕ СВОЙСТВА Простейшие амины: метиламин, диметиламин, триметиламин являются газами хорошо растворимыми в воде. Остальные низшие амины являются при нормальных условиях жидкостями. Низшие амины обладают запахом аммиака. Более сложные являются жидкостями с неприятным запахом рыбы. Высшие амины твердые вещества, нерастворимые в воде, без запаха. Амины также являются ассициирующими жидкостями. Но в меньше степени, чем спирты. Соответственно температуры кипения аминов ниже, чем у спиртов с таким же числом углеродных атомов. При равном числе углеродных атомов первичные кипят выше, чем вторичные, а вторичные выше, чем третичные. Эта закономерность связана со способностью аминов к образованию водородных связей. С ростом числа алкильных заместителей снижается способность к образованию связей. Амины способны гореть. 2.4. ХИМИЧЕСКИЕ СВОЙСТВА 2.4.1. Кислотно-основные свойства. Первичные и вторичные амины являются слабыми N-H кислотами. Они слабее спиртов рК = 16-17. Однако под действием очень сильных оснований, например, металлоорганические соединения, амины образуют соли, причем анионы в этих солях также являются сильными основаниями (амид натрия NaNH2): Водные растворы аминов имеют основной характер, что обусловлено образованием полностью ионизированных алкилзамещенных гидроксида аммония: С минеральными кислотами амины образуют соли: Ароматические амины более слабые основания. Дифениламин значительно слабее анилина. Трифениламин практически не обладает основными свойствами. 2.4.2. Амины как нуклеофилы Вопросы N-алкилироввания аминов и N-ацилирования рассмотреть самостоятельно. Первичные ароматические амины взаимодействуют с альдегидами и кетонами с образованием иминов или Шиффовых оснований: 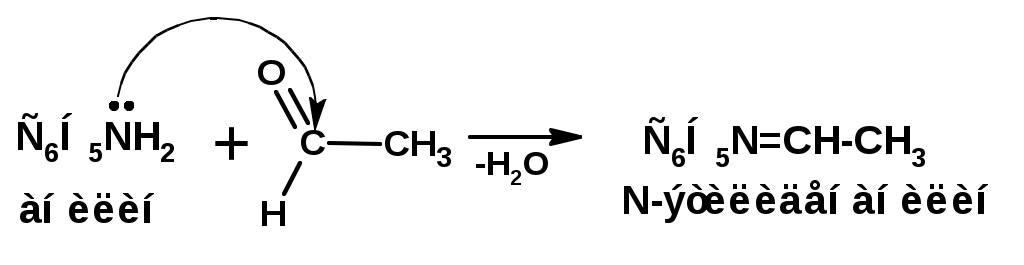 2.4.3. Электрофильное замещение в ароматических аминах. Аминогруппа, связанная с бензольным кольцом, выступает как ориентант первого рода в реакциях электрофильного замещения. Положительный эффект сопряжения аминогруппы в анилине и других ароматических аминах значитеольно преобладает над ее оорицательным индуктивным эффектом. Аминогруппа является, в целом, сильным электронодонорным активирующим заместителем. Галогенирование Галогенирование анилина протекает в воде в отсутствие катализатора. Бром количественно присоединяется в три положения: 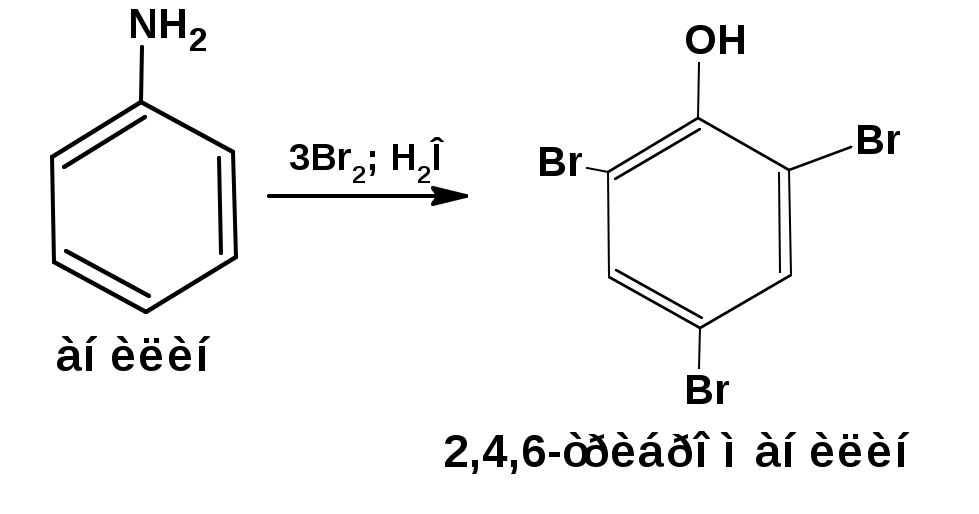 Чтобы задержать реакцию на стадии монозамещения , приходится снижать активирующее действие аминогруппы, что достигается ацилированием. Ациламиногруппа сохранят свойства ориентанта первого рода. Но в этом случае получаются продукты монозамещения: 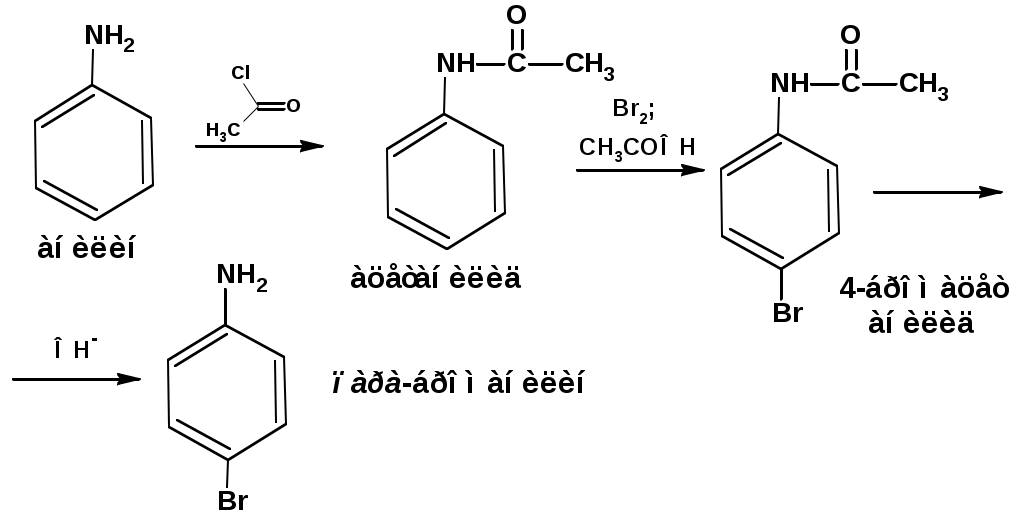 Нитрование орто- пара-ориентация наблюдается при электрофильном нитровании. Однако в присутствии минеральной кислоты образуется аммонийная группа, которая является мета-ориентантом, дезактивирующим электрофильную атаку. Поэтому при действии на анилин нитрующей смеси образуется смесь о-, п- и м-нитроанилинов: 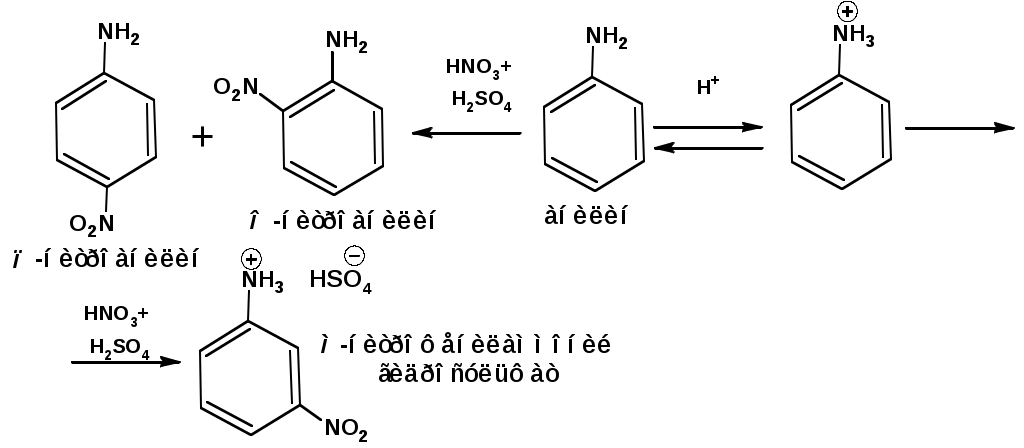 Для снижения активности анилина и предовращения окислительных процессов проводят предварительное ацилирование аминогруппы: Для снижения активности анилина и предовращения окислительных процессов проводят предварительное ацилирование аминогруппы: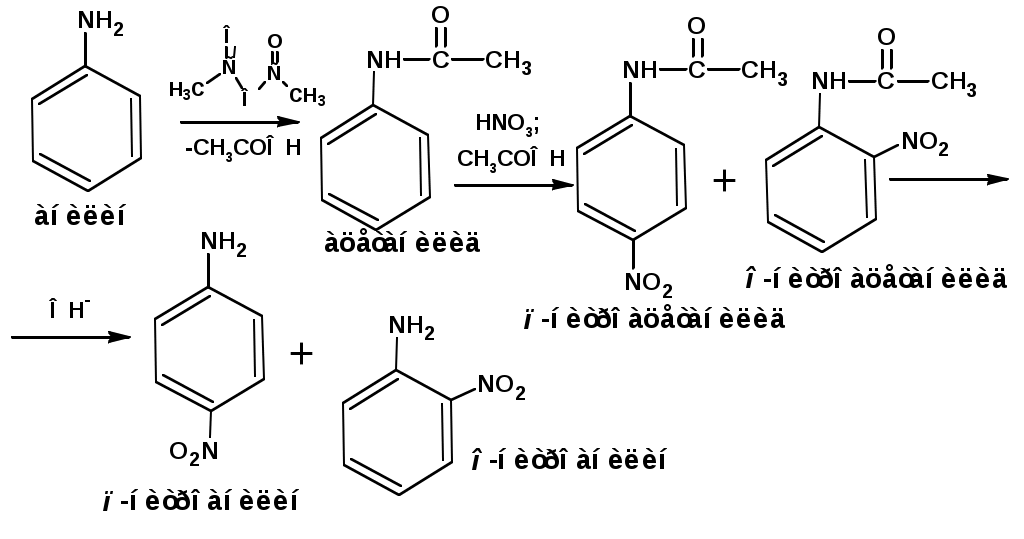 Сульфирование Сульфирование анилина проводят концентрированной серной кислотой при 180-2000С. Продуктом реакции является анилин-4-сульфокислота или сульфаниловая кислота : 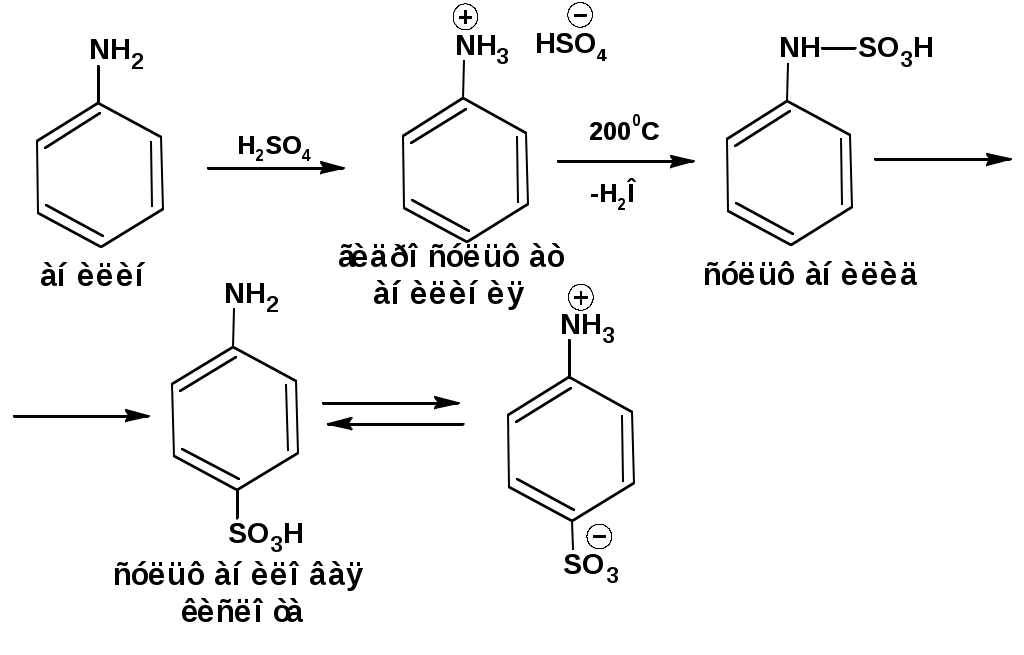 Сульфаниловая кислота имеет строение внутренней соли. Она нерастворима в кислотах, плохо растворима в холодной воде, хорошо растворима в горячей воде, также хорошо растворяется в щелочах. 2.4.4. Реакции аминов с азотистой кислотой. Особый круг составляют реакции аминов с азотистой кислотой. При этом различают реакции первичных аминов, вторичных и третичных. Реакции первичных алифитических аминов протекают в соответствии со следующим механизмом: 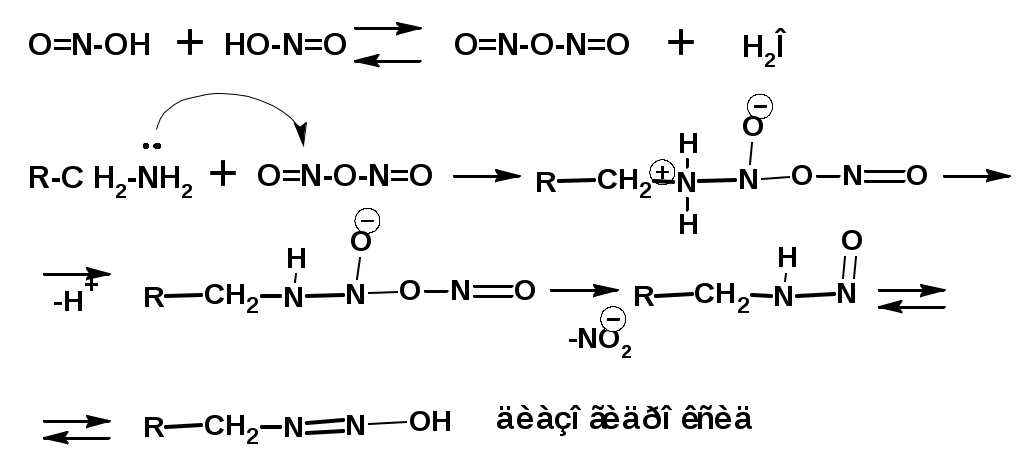 В кислой среде диазогидроксид подвергается дальнейшему превращению: 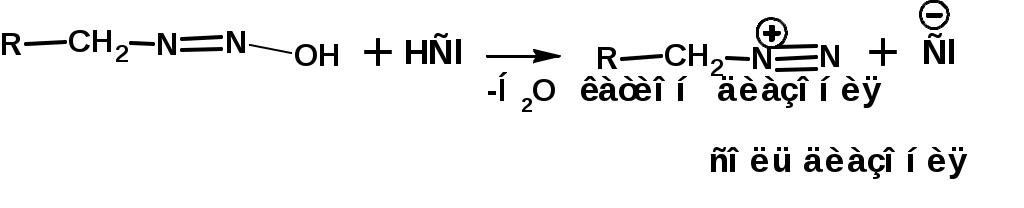 Диазокатион алифатических аминов является нестойким. Он легко отщепляет молекулу азота с образованием обычного карбкатиона: 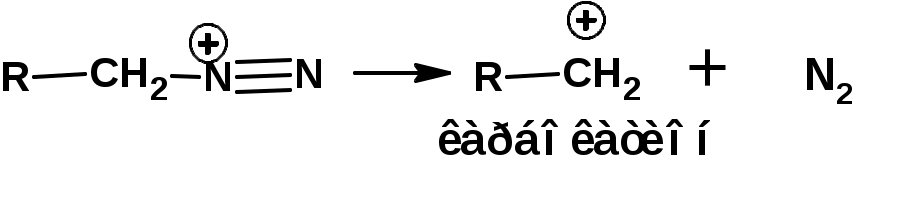 Карбокатион может быть стабилизирован либо присоединением нуклеофильной частицы, в частности гидроксила, либо отщеплением протона: 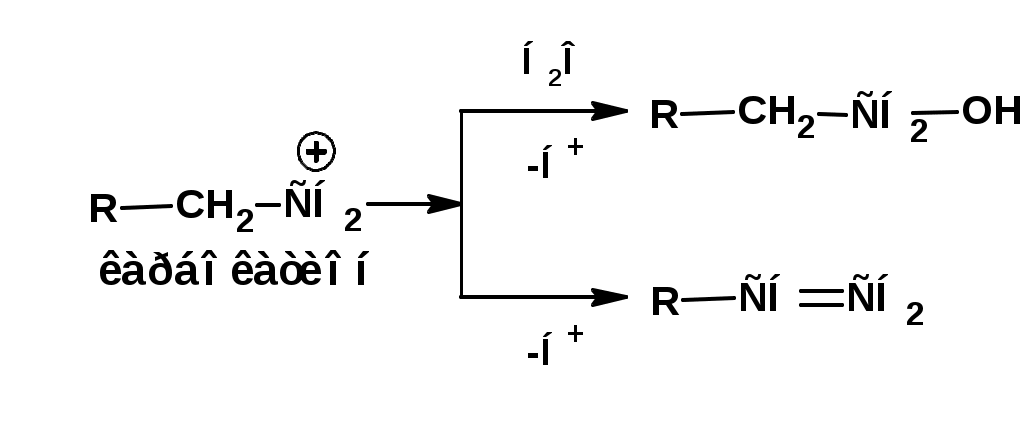 Реакция вторичных аминов с азотистой кислотой реакция оснавливается на стадии отщепления нитрит-аниона. При этом образуется нитрозоамин: 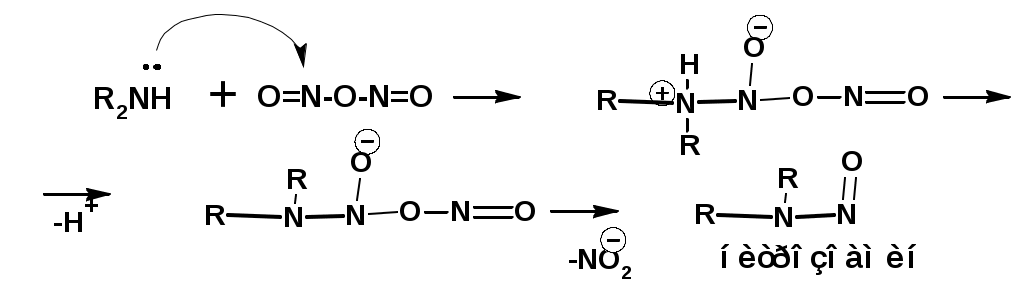 Третичные амины в слабокислой среде расщепляются с образованием карбонильного соединения и нитрозоамина: 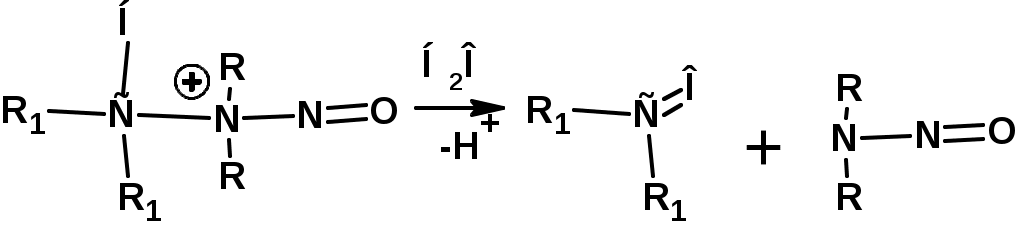 3. ДИАЗО- И АЗОСОЕДИНЕНИЯ Алифатические диазосоединения являются нестойкими. Однако если алифатический радикал заменить на ароматическое кольцо, то π-элетронная система кольца способна находиться в сопряжении с π-связью, соединяющей атомы азота. Сопряжение приводит к стабилизации диазокатиона. Соответственно диазосоединения, получаемые из ароматических аминов являются достаточно стабильными соединениями, обладающими важными химическими свойствами. Ароматическими диазосоединениями называют различные по строению, однако легко взаимопревращаемые соединения: соли диазония, диазогидроксиды и другие подоьбные им вещества, в которых группировка атомов азота связана с одним атомом углерода. Соединения, в которых атомы азота, соединенные кратной связью, связаны с двумя атомами углерода называются азосоединениями. Для диазосоединений, получаемых из ароматических аминов характерны два типа реакций: 1. реакции, протекающие с выделением азота; 2. реакции, протекающие без выделения азота. 3.1. Реакции, протекающие с выделением азота; При кипячении кислых растворов (серная кислота) солей диазония образуется фенол, принагревании солей диазония с йодистым калием диазогруппа замещается на йод: 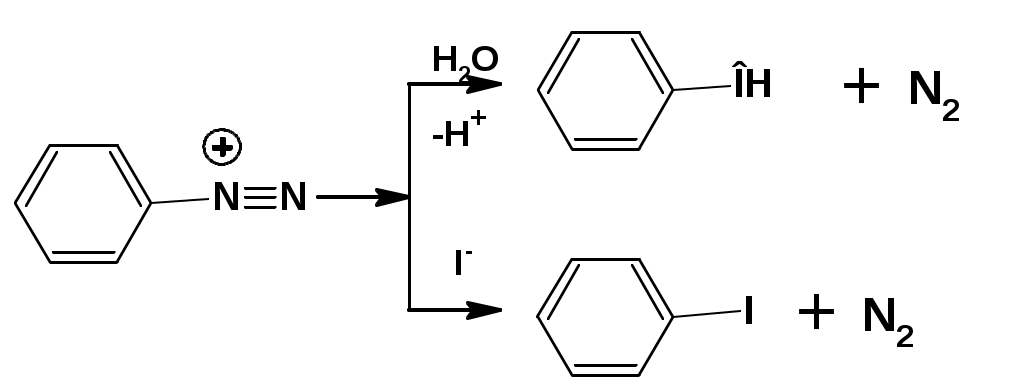 Очень часто замещение диазогруппы на другие атомы или группы требует применения в качестве катализатора медного порошка или соответствующих солей меди (так называемая реакция Зандмейера): 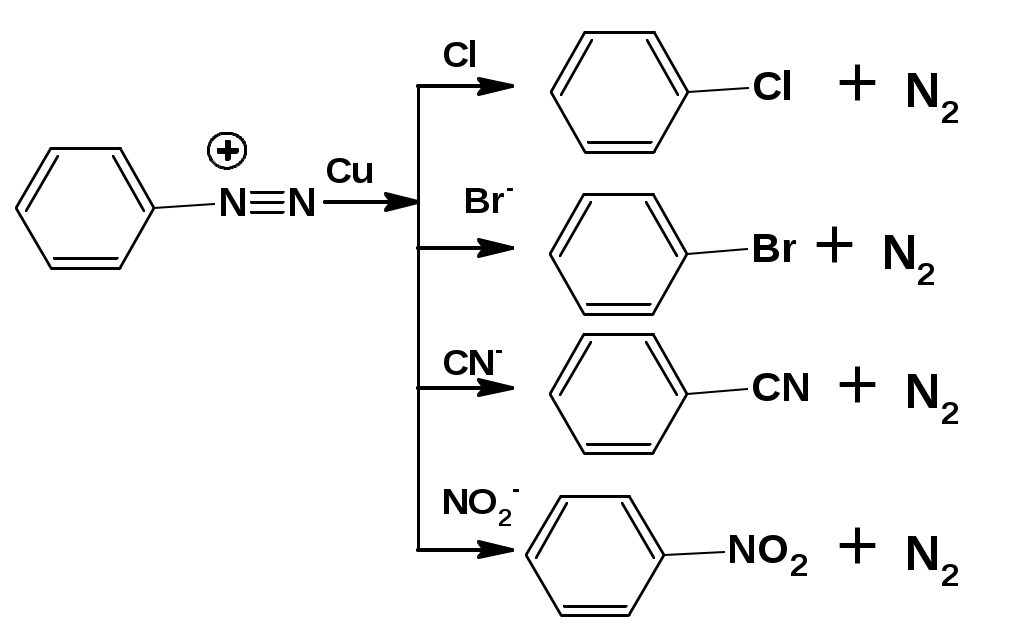 3.2. Реакции, протекающие без выделения азота Рассматриваются три реакции: Восстановления Азосочетания Восстановление В мягких условиях при действии двухлористого олова в соляной кислоте или цинковой пыли в уксусной кислоте диазосоли восстанавливаются с образованием арилгидразинов: 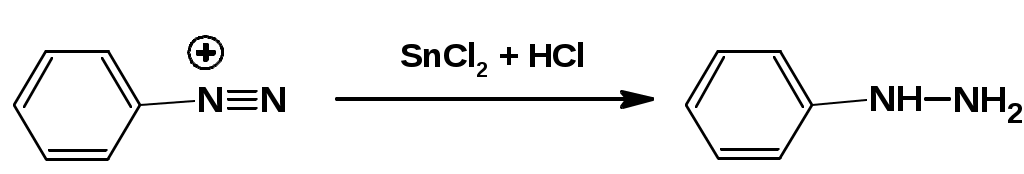 Важную в практическом применении группу реакций ароматических солей диазония составляют реакции электрофильного замещения, приводящие к образованию азосоединений. Такие реакции называются азосочетанием. Соль диазония, катион которой высявляется электрофильной частицей называется диазосоставляющей. Ароматическое соединение, являющееся субстратом называет азосоставляющей. В качестве азосоставляющей могут использоваться соединения, имеющие в качестве первого заместителя ориентанты перврого рода, являющиеся сильными электронодонорными активирующими заместителями. Это фенолы, эфиры фенолов, ароматические амины и их N-алкил или N,N-диалкил производные: Азосоединения вещества окрашенные. Т.К. содержат хромофорную группу –N=N-, способствующей поглащению света в видимой области. В частности красителем является следующее соединение называемое метилоранжем или гелиантином: 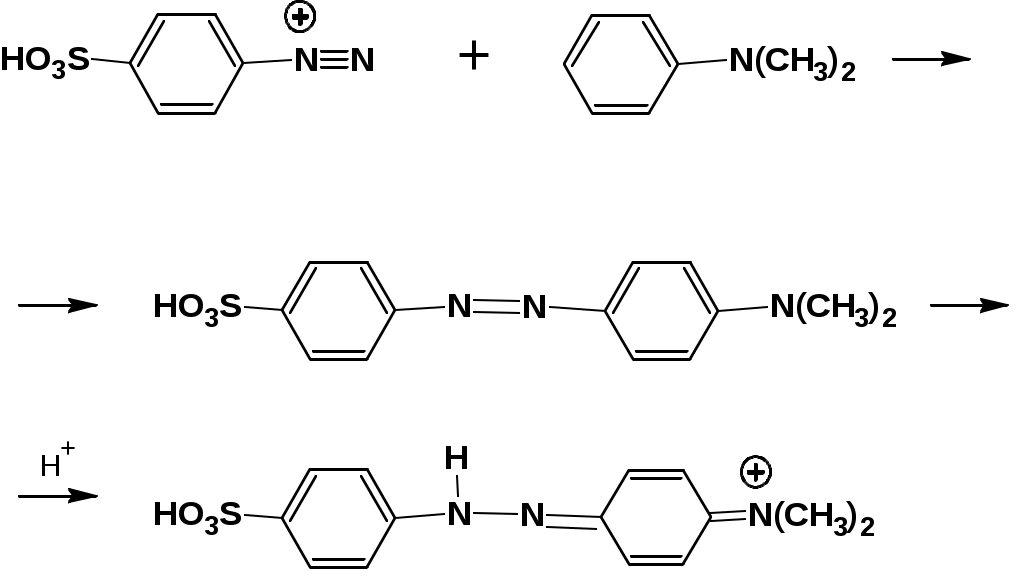 |
