відкрита лекція люмінесцентний аназіл. Лекція Люмінесцентний метод аналізу План
 Скачать 2.7 Mb. Скачать 2.7 Mb.
|
|
Відкрита лекція Люмінесцентний метод аналізу План
Всі речовини при сильному нагріванні починають світитися. Світіння нагрітих тіл називають тепловим рівноважним випромінюванням. Але деякі речовини світяться без нагрівання - при кімнатній температурі. Таке випромінювання називають люмінесценцією. На відміну від теплового випромінювання люмінесценція є нерівноважним випромінюванням. Найбільш вдалим визначенням люмінесценції, яке характеризує суть явища, є визначення В.Л. Левшина: Люмінесценція — це світіння атомів, молекул, іонів та інших більш складних комплексів, яке виникає в результаті електронного переходу в цих частинках, при їх повертанні зі збудженого стану в нормальний. Речовини, які здатні люмінесціювати, називають люмінофорами.
Датою народження люмінесцентного методу аналізу є 4 березня 1864 року, коли відомий англійський фізик Стокс зробив доповідь у Королівському товаристві і звернув увагу на можливість використання люмінесценції для аналізу органічних сполук. В розробку теорії люмінесценції великий внесок зробив радянський вчений С.І.Вавілов.  Бібліографічна довідка: Серге́й Ива́нович Вави́лов (12 (24) марта 1891, Москва — 25 января 1951, Москва) — советский физик, основатель научной школы физической оптики в СССР, академик (1932) и президент Академии наук СССР (с 1945), лауреат Сталинской премии. Младший брат Н. И. Вавилова, русского учёного-генетика. Основным направлением в науке для Сергея Вавилова было исследование оптики, в частности явления люминесценции. Великий внесок в розвиток хемілюмінесцентного аналізу зробив Анатолій Кирилович Бабко та співробітники його школи. Бібліографічна довідка: Закінчив Київський політехнічний інститут, вважається учнем академіка Н.А.Тананаєва, доктор хімічних наук, професор Київського університета, академік АН УРСР. Люмінесценція виникає в наслідок поглинання речовиною квантів hν0 електромагнітного випромінювання і збудження молекул або атомів. Молекула або атом речовини переходить в збуджений стан В і через деякий час (≈ 10-12 с) повертається в основний стан А, при цьому випромінює енергію у вигляді квантів. Частина енергії випромінюється спочатку у вигляді кванта теплової енергії. 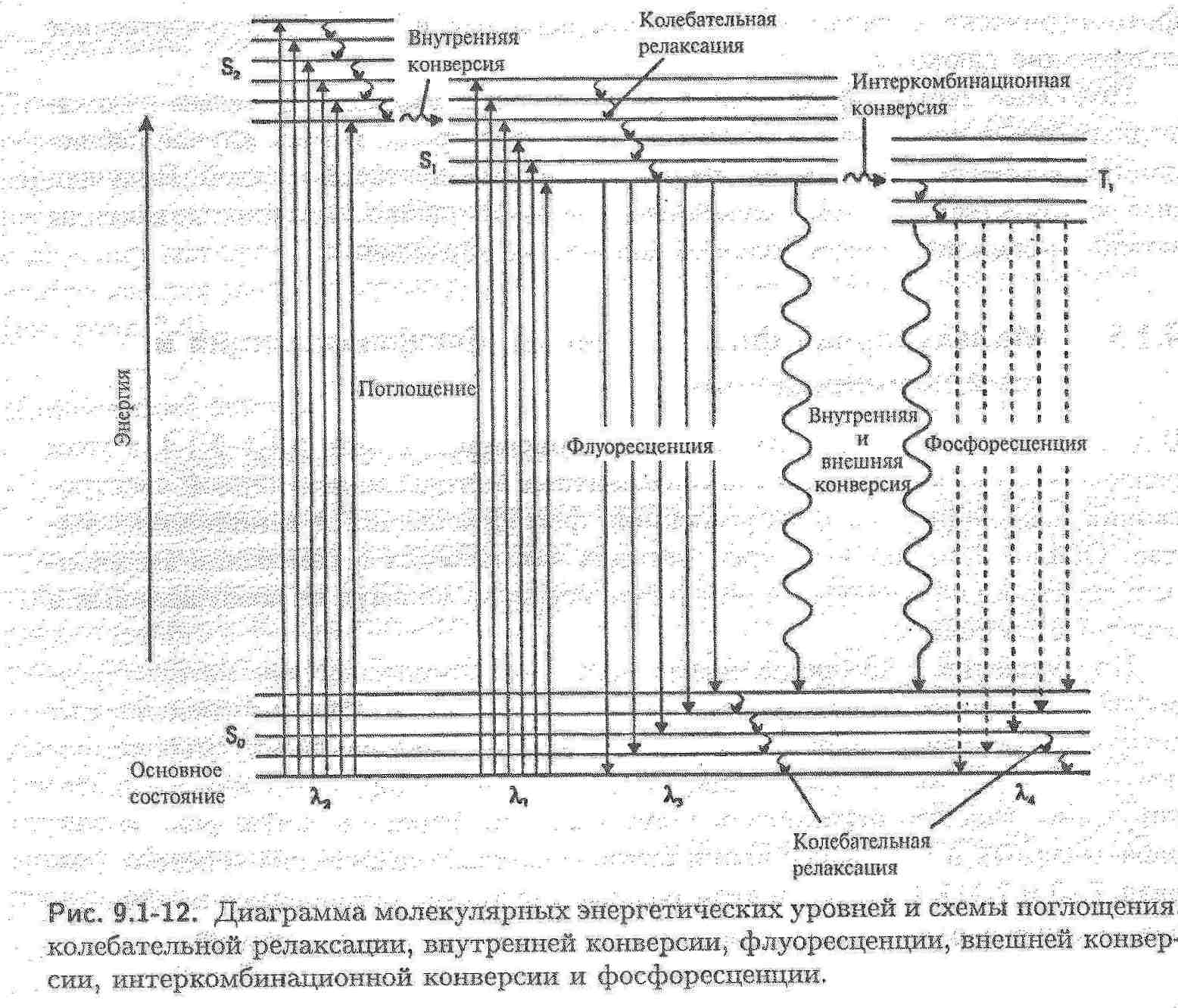 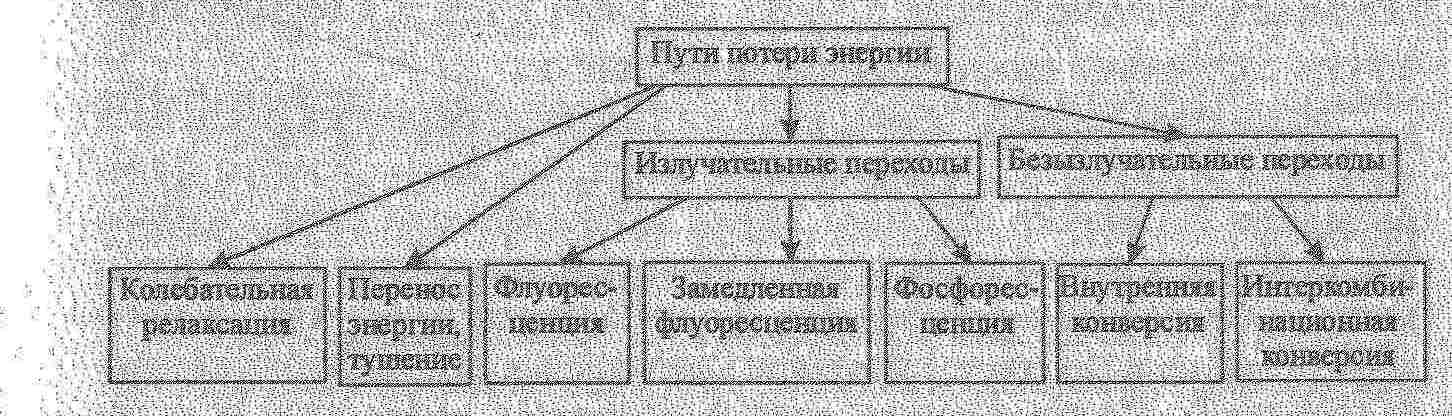 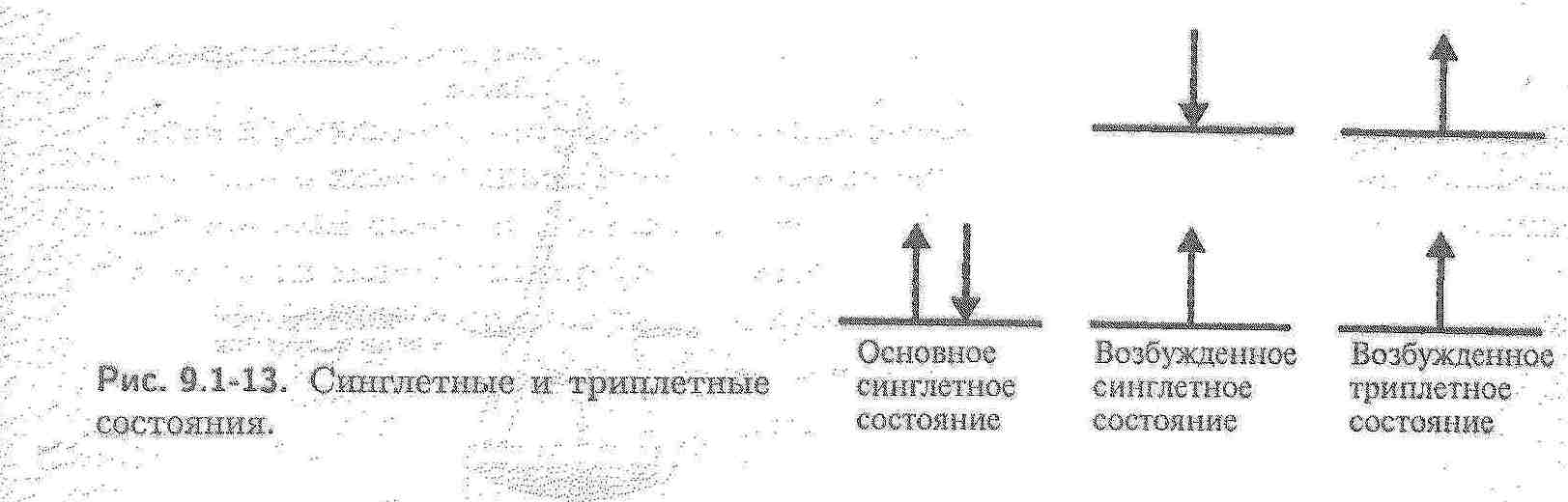 Розрізнюють основний синглетний (S0) та збуджені синглетний (Sn)та триплетний (Tn) електронні рівні молекули. На кожний електронний рівень накладаються коливальні підрівні з квантовими числами 0, 1, 2, 3 і т.д.. При поглинанні кванта світла електрон переходить з основного рівня на більш високий, який відповідає збудженим синглетному (антипаралельні спіни) і триплетному (паралельні спіни) станам. Прямий перехід з основного синглетного в збуджений триплетний стан заборонений за спіном і практично не спостерігається. Енергія триплетного стану дещо менше, ніж синглетного. Триплетні рівні можуть заповнюватися за рахунок інтеркомбінаційної конверсії S1 → T1 (хвиляста горизонтальна стрілка). Стадія1. При кімнатній температурі молекули звичайно знаходяться в основному стані і майже всі електронні переходи при поглинанні світла відбуваються з нижнього основного коливального підрівня на різні коливальні підрівні збудженого синглетного стану. Стадія2 Збуджена молекула за рахунок коливальної релаксації при стиканні з оточуючими молекулами дуже швидко втрачає надлишкову коливальну енергію і переходить на основний коливальний рівень збудженого синглетного електронного стану. Стадія3а. Далі відбувається випромінювальний перехід з основного коливального рівня збудженого синглетного стану на будь-який коливальний підрівень основного синглетного стану: S1 → S0. – флуоресценція. Тривалість флуоресценції – τ(тау) - 10-8 – 10-7 с. Стадія3б. випромінювальний перехід між двома електронними станами різної мультиплетності: Т1 → S0, де Т1 – перший збуджений триплетний стан. Тривалість фосфоресценції – τ(тау) - 10-3 – 10 с (фосфоресценцію спостерігають при низьких температурах, зменшується ймовірність безвипромінювального переходу.) Існують такі види класифікації люмінесценції:
Для збудження люмінесценції необхідно підводити енергію ззовні в зв'язку з тим, що вона втрачається при випромінюванні. Тому види люмінесценції класифікують за зовнішнім джерелом збудження енергії
За тривалістю світіння люмінесценцію розділяють на флуоресценцію (короткотривала,10-8 – 10-7 с) та фосфоресценцію (довготривала, 10-4 – 102 с), суть яких розглянемо пізніше. За механізмом світіння розрізнюють:
В першому випадку і поглинають, і випромінюють одні і ті ж частинки — атоми і молекули. Цей вид світіння характерний для речовин в газуватому стані, розчинам неорганічних і органічних речовин, чистим органічним розчинникам. Рекомбінаційне світіння спостерігають у тих випадках, коли процеси поглинання та випромінювання розділені як в часі, так і у просторі. Тут в процесі збудження відбувається розподіл частинки речовини на 2 частини — іони і радикали. Наступна їх рекомбінація супроводжується виділенням енергії. Ця енергія переводить частинку в збуджений стан. Повертаючись в основний стан, частинка випромінює квант світла. Рекомбінаційна люмінесценція характерна для кристалофосфорів та для деяких газів про рекомбінації іонів або радикалів.
Спектри поглинання молекул обумовлені переходами з основного стану на збуджений. Спектри люмінесценції молекул обумовлені електронними переходами зі збудженого стану на основний. Спектри поглинання виражають у вигляді залежності поглинання від частоти (довжини хвилі). Величина поглинання може бути виражена:
При цьому вказують товщину шару поглинання (l) і концентрацію речовини (С). Спектри люмінесценції представляють у вигляді залежності інтенсивності люмінесценції (І) (або І/ν) від частоти (або λ) випромінювання. 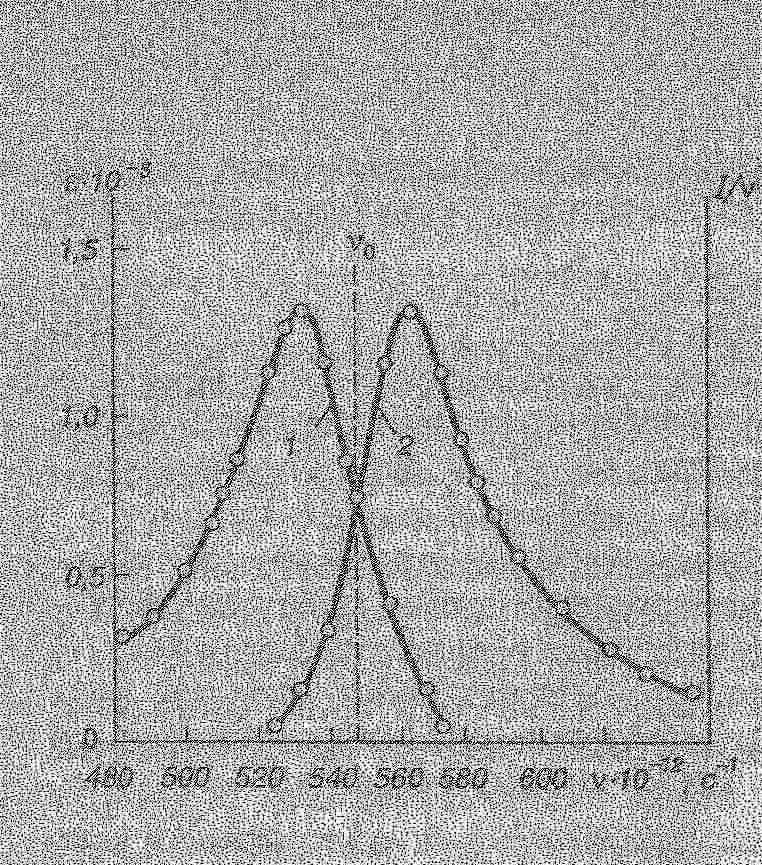 Спектр поглинання ε=f(ν) (крива 2) та спектр флуоресценції І/ν = f(ν) (крива 1) родаміну 6Ж в ацетоні
Тривалість світіння – середній проміжок часу, на протязі якого молекули люмінофора знаходяться в збудженому стані. Флуоресценція (затухає відразу після видалення джерела збудження) – випромінювальний перехід між двома електронними станами однакової мультиплетності: S1 → S0, де S1 – перший збуджений синглетний стан; S0 – основний синглетний стан. Тривалість флуоресценції – τ(тау) - 10-8 – 10-7 с. Фосфоресценція (довготривала люмінесценція)- випромінювальний перехід між двома електронними станами різної мультиплетності: Т1 → S0, де Т1 – перший збуджений триплетний стан. Тривалість фосфоресценції – τ(тау) - 10-4 – 102 с. Спектр фосфоресценції здвигнутий в низькочастотну (довгохвильову) область відносно спектру флуоресценції на величину, рівну різниці енергій станів S1 і Т1. Фосфоресценцію не спостерігають у сполук, які мають сильну флуоресценцію. Фосфоресценція характерна для пестицидів, аніонних кислот, ферментів, вуглеводнів нафти. 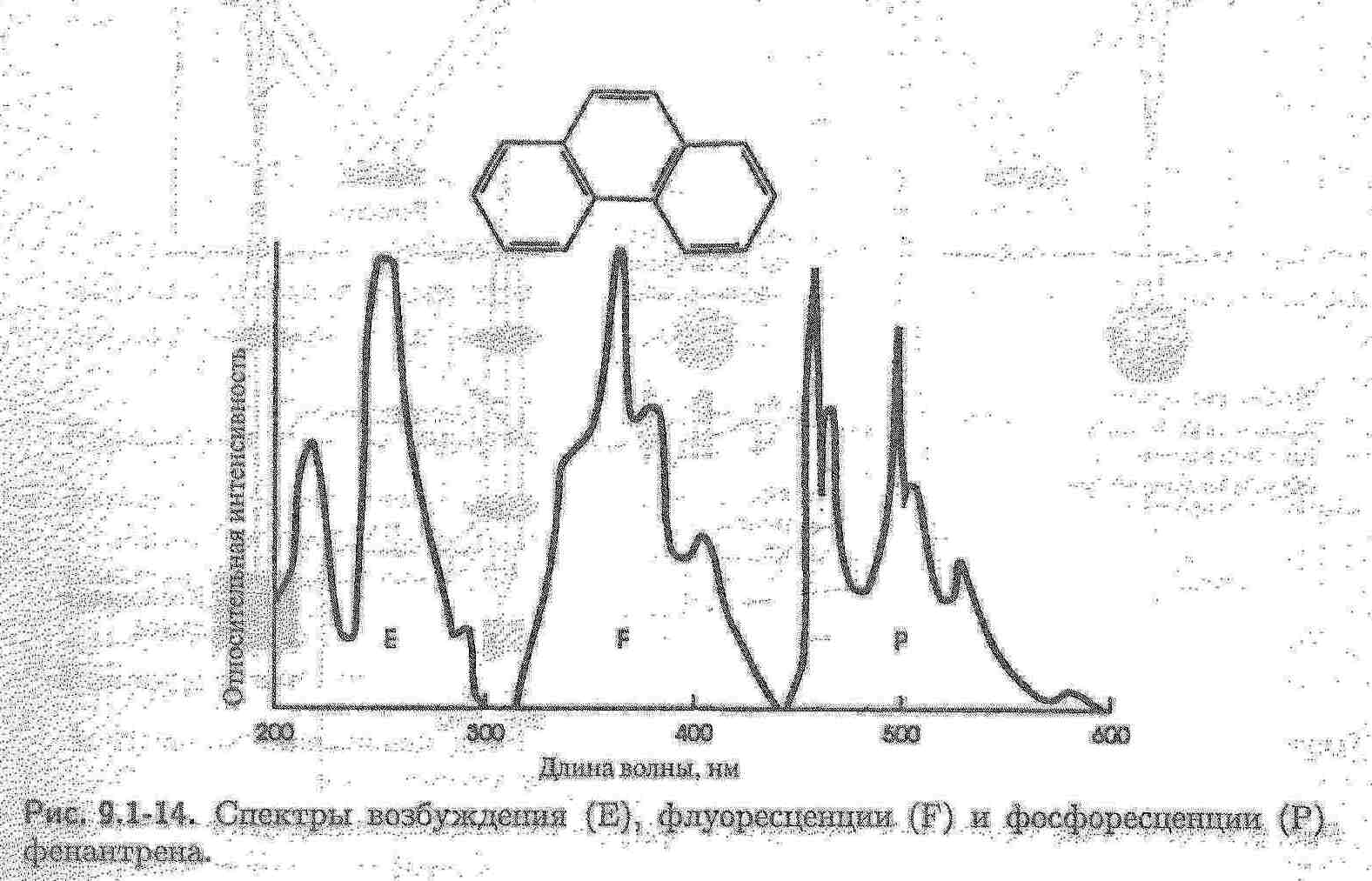
Величина виходу люмінесценції В характеризує ефективність трансформації світла збудження в світло люмінесценції. Енергетичним виходом люмінесценції Вен називають відношення енергії, яка випромінюється речовиною, Евипр до енергії збудження Епогл, за рахунок якої виникає люмінесценція. Вен=Евипр / Епогл Квантовий вихід люмінесценції Вкв — це відношення кількості квантів люмінесценції (Nвипр), які випущені речовиною, до числа поглинених квантів світла, що збуджує (Nпогл) Вкв = Nвипр / Nпогл Вен = hνвипрNвипр / h νпоглNпогл Вен = ( νвипр / νпогл )*(Nвипр / Nпогл) Вен = ( νвипр / νпогл )* Вкв або Вен = (λпогл / λвипр )* Вкв
Спектр люмінесценції не залежить від довжини хвилі світла збудження. Пояснення: випускання квантів люмінесценції завжди відбувається з нижчого електронно-збудженого рівня молекули, тому спектр люмінесценції завжди буде одним і тим же незалежно від того, на який енергетичний рівень потрапив електрон в результаті поглинання фотона.
Спектр люмінесценції в цілому і його максимум здвигнутий відносно спектра поглинання і його максимуму в довгохвильову область. Пояснення: Причина цього в тому, що частина енергії поглинених квантів переходить в теплову енергію: hνпогл = hνлюм + Q, де hνпогл – енергія поглиненого фотона світла, що збуджує; hνлюм – енергія фотона люмінесценції; Q – енергія теплового руху молекули. 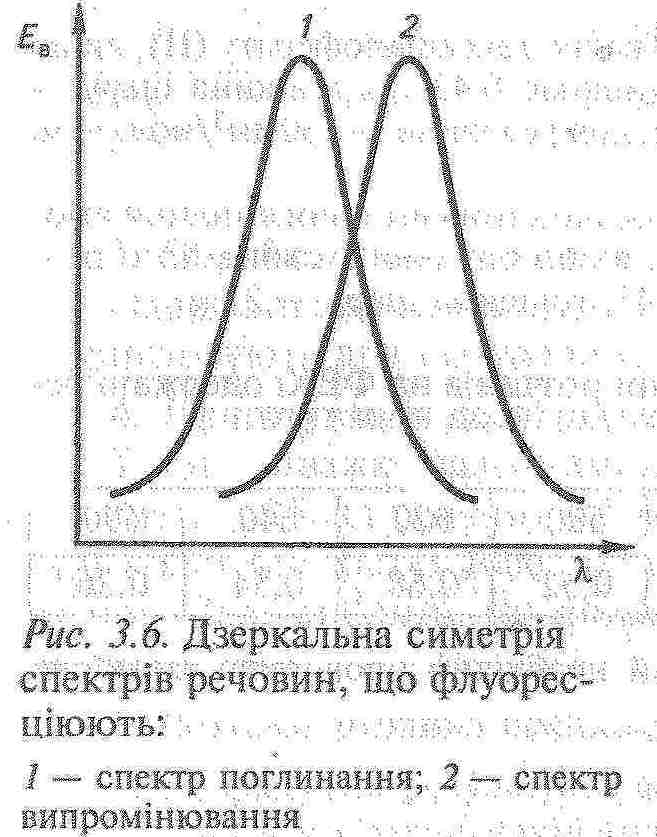  3) Правило Левшина – правило дзеркальної симетрії: Спектри поглинання і флуоресценції, які представлені відповідно у вигляді графіків ε = f(ν) і I / ν = f(ν), дзеркально симетричні відносно прямої, перпендикулярної до вісі частот ν, яка проходить через точку перетину спектрів ν0, при цьому ν погл + νлюм = 2 ν0, де ν погл і νлюм - симетричні частоти поглинання і флуоресценції. Дзеркальна симетрія характерна для складних молекул і не спостерігається у простих молекул.
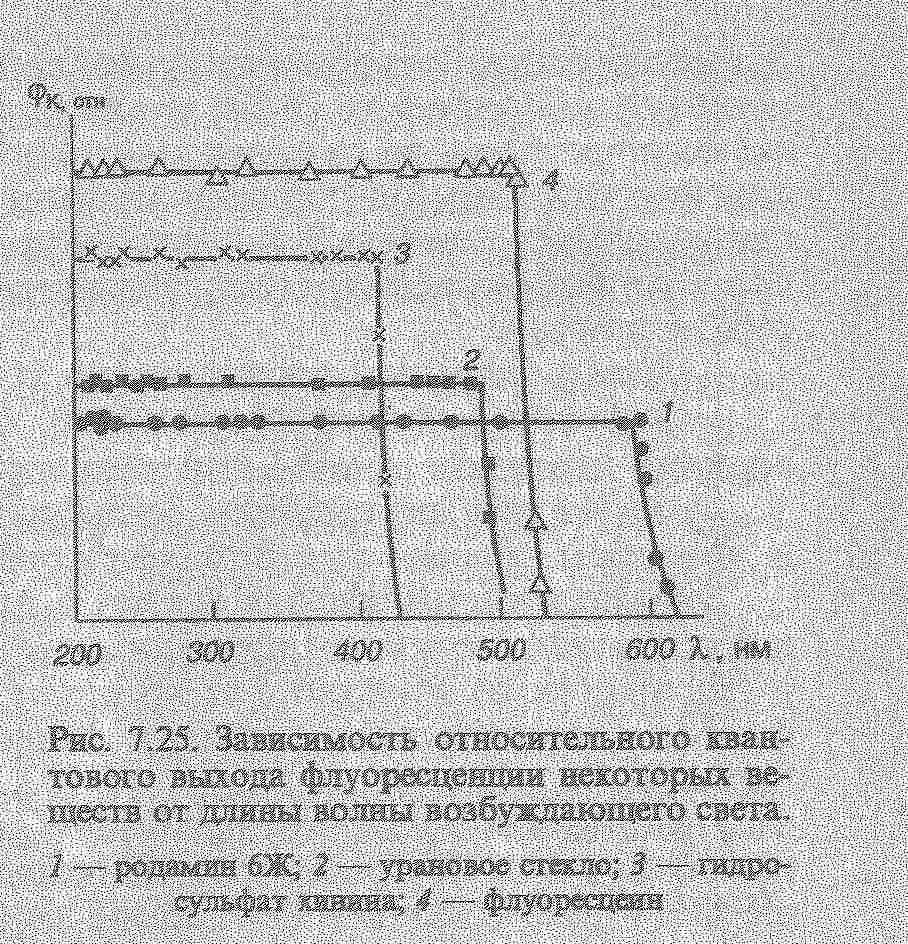
Це можливо тоді, коли молекули до поглинання квантів світла мають значний запас коливальної енергії, тоді після поглинання може виникнути випромінювання квантів з більшою енергією ніж енергія поглинених квантів: hνлюм=hνпогл+ Екол
Після припинення збудження інтенсивність флуоресценції спадає з часом за експоненціальним законом: It = I0e-t/τ, де І0 – інтенсивність світіння в момент припинення збудження люмінесценції; It – інтенсивність світіння в момент часу t; Τ(тау) – тривалість люмінесценції, або середній час життя, або середня тривалість збудженого стану.
від концентрації люмінофора Якщо інтенсивність люмінесценції характеризувати числом квантів, які випускаються люмінофором в одиниці об’єму в одиницю часу, то у відповідності з основним законом світлопоглинання та визначенням квантового виходу, залежність інтенсивності люмінесценції (І) від концентрації люмінофору (С) при малій частці поглиненого люмінофором випромінювання (klC < 0.05) має наступний вигляд: І = 2,303ВквІ0lС, де Вкв – квантовий вихід люмінесценції; І0 – інтенсивність випромінювання збудження; k – коефіцієнт поглинання люмінофора при довжині хвилі випромінювання збудження; l – товщина шару розчину, см C – концентрація розчину, моль/л. 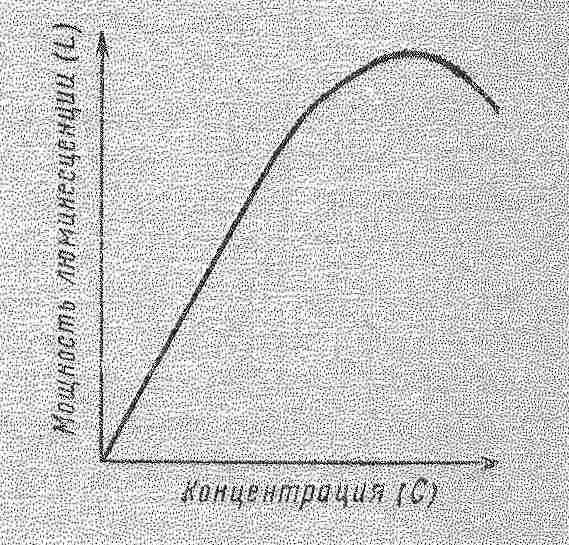
Розрізнюють такі види гасіння люмінесценції:
Концентраційне гасіння Енергетичний вихід при малих концентраціях речовини пропорційний його вмісту в розчині. Але при досягненні певної концентрації речовини спостерігається повне гасіння люмінесценції. Концентраційний бар’єр для більшості речовин, що люмінесцують, знаходиться в інтервалі концентрацій 10-4 – 10-3 моль/л. Зі збільшенням концентрації взаємодія між частинками зростає, що призводить до безвипромінювальних переходів. Концентраційне гасіння зворотне: при розбавленні концентрованих розчинів світіння відновлюється. Температурне гасіння Підвищення температури знижує вихід і інтенсивність люмінесценції органічних молекул і кристалофосфорів, в зв’язку зі збільшенням в’язкості розчинника збільшується коливальна енергія молекул, послабляються межмолекулярні зв’язки і перехід молекули в нормальний стан може здійснюватися без випромінювання. Деякі органічні речовини не люмінесцують при кімнатній температурі, але люмінесцують при заморожуванні. Гасіння люмінесценції домішками При додаванні до люмінесцуючих речовин деяких речовин відбувається гасіння люмінесценції. Ці речовини називаються гасниками. Гасіння спостерігається в зв’язку з утворенням нових продуктів і передачі енергії збудженої молекули молекулі гасника. Для люмінесцуючих речовин гасниками є йод, іони Fe3+, Cu2+, Ag+. Кисень гасить люмінесценцію ароматичних сполук.
Люмінесценцію можна вивчати як візуально, так і з використанням спектрофлуориметрів та флуориметрів. Для отримання спектрів збудження та флуоресценції, а також для кількісних визначень використовують спектрофлуориметр. Цей прилад схожий на спектрофотометр з тою різницею, що призми або решітки, які встановлені в ньому, дозволяють розділити довжини хвиль, які відповідають флуоресцентному та збуджуючому випромінюванню. 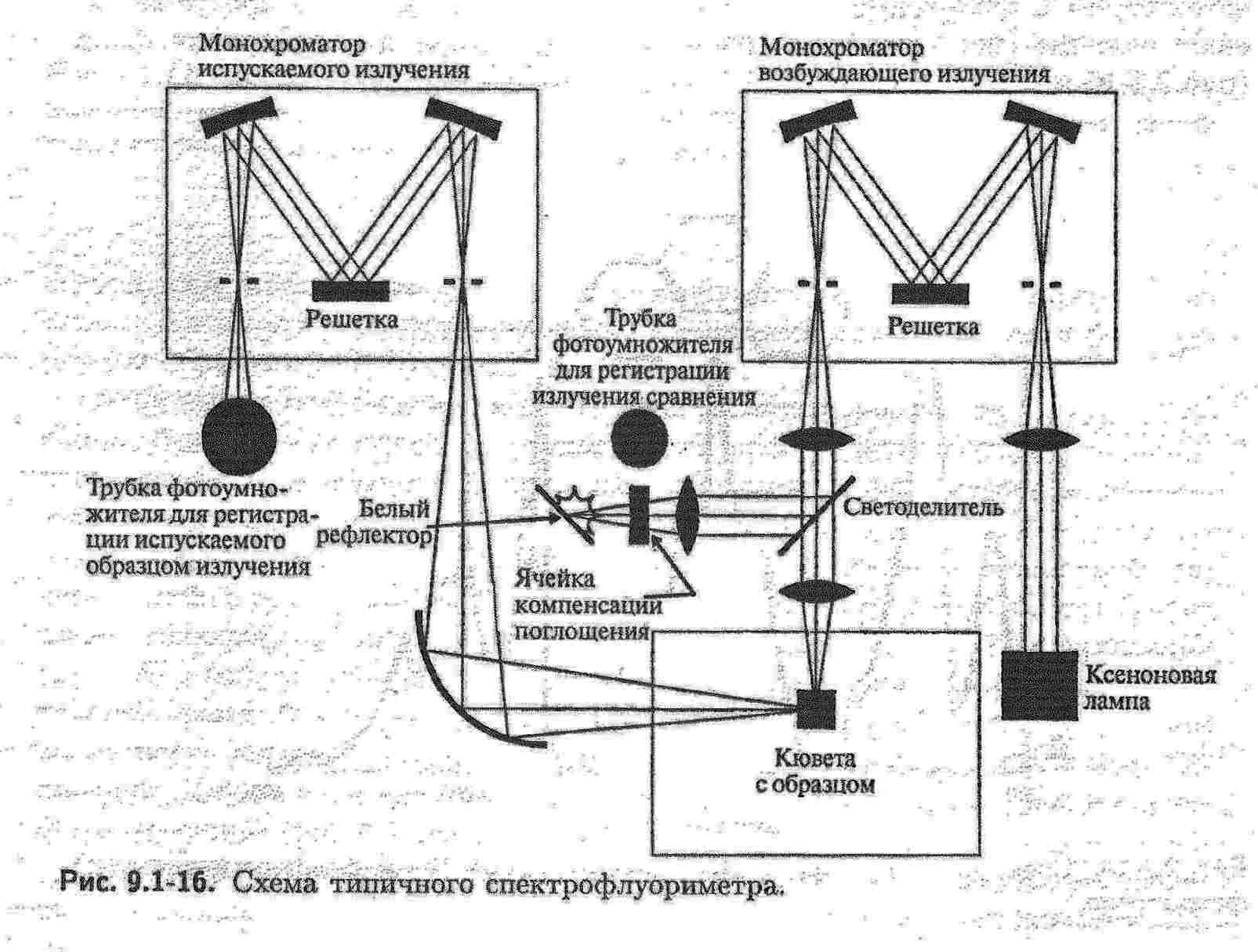 Для кількісних визначень дешевше використовувати флуориметр. 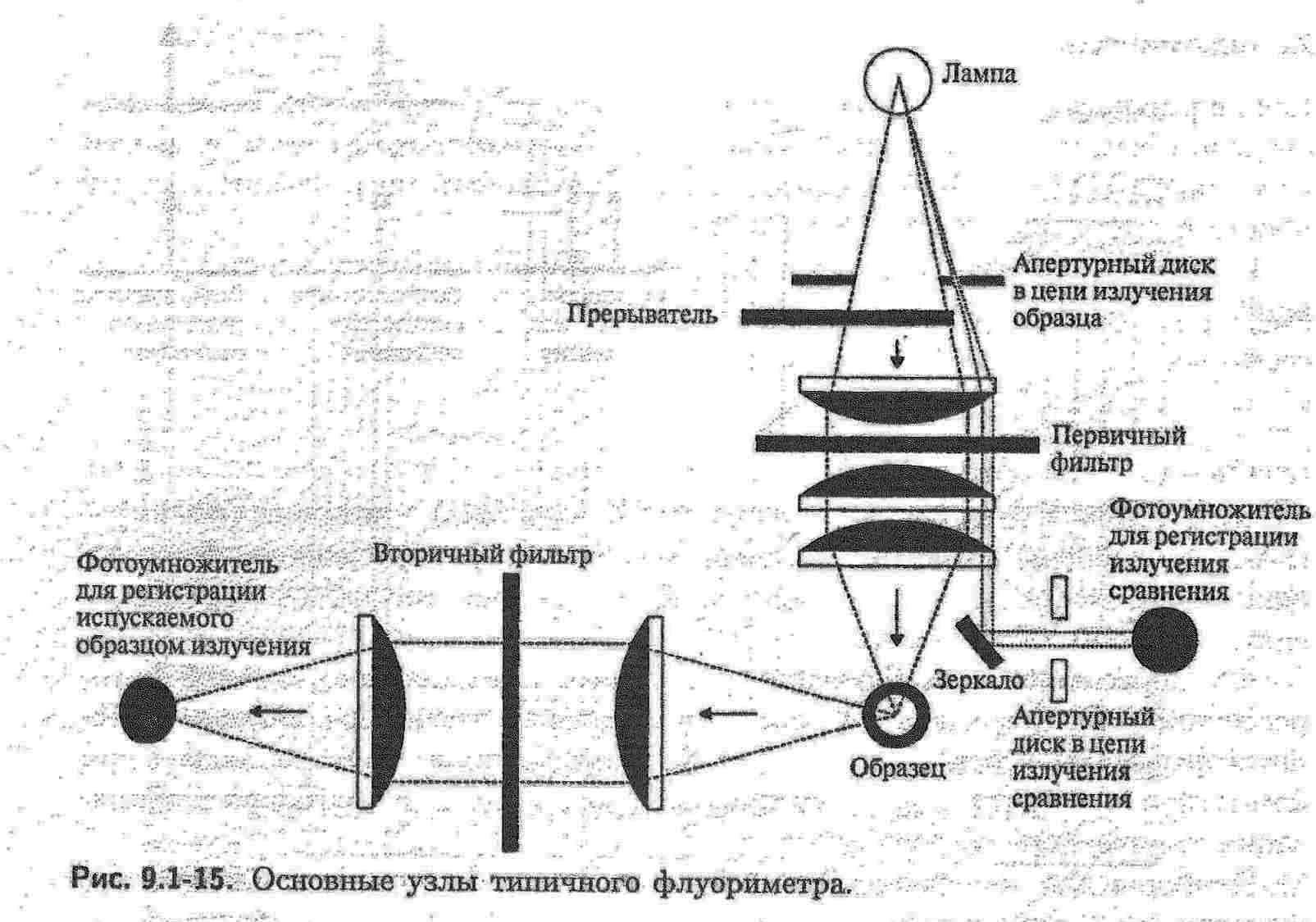 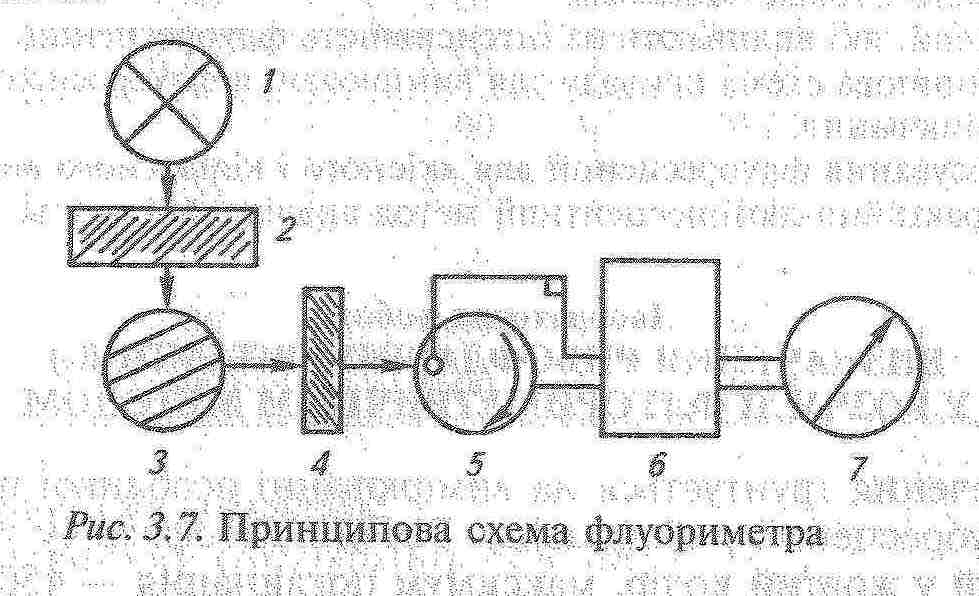 В якості джерела збудження 1 використовують ртутно-кварцеві та ксенонові лампи (УФ-промені). Світло від джерела випромінювання проходить через первинний світлофільтр 2 і падає на кювету з досліджуваним розчином 3. Вторинний світлофільтр 4 пропускає світло люмінесценції і поглинає розсіяне світло від джерела збудження. Приймач світла 5 вимірює люмінесцентне випромінювання під прямим кутом до напрямку збуджуючого світла. Як правило, детекторами слугують фотомножники або фотоелементи.
Таблиця. Власна люмінесценція органічних речовин
Так, готують кристалофосфори на основі CaO і визначають домішки: 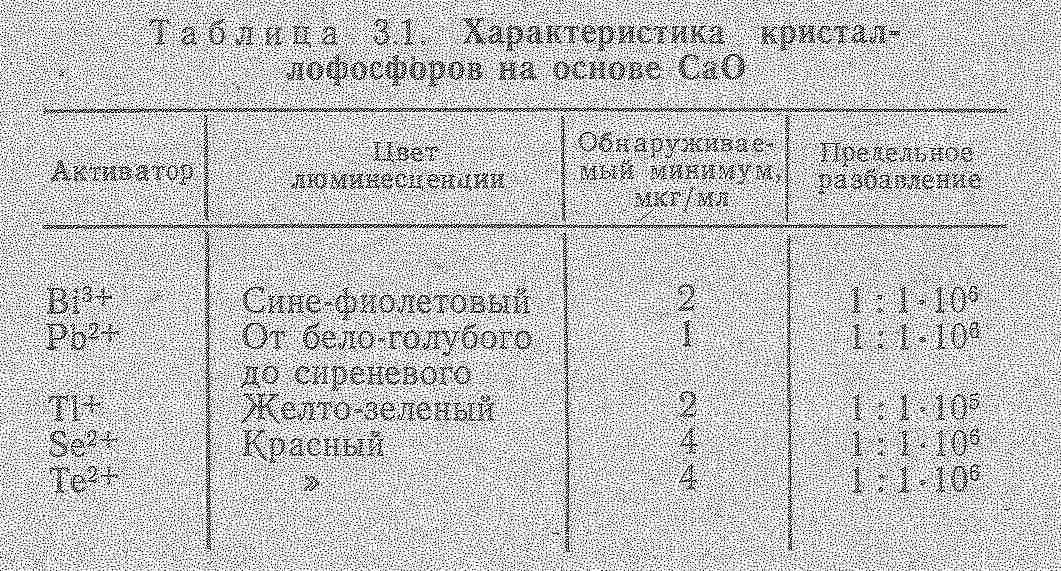
Кількісний аналіз базується на залежності: Ілюм = kC. В практиці використовують калібрувальний графік або метод добавок для визначення концентрацій речовин. Для аналітичної хімії найбільше значення має фотолюмінесценція та хемілюмінесценція. В титриметричних методах аналізу використовують люмінесцентні індикатори для аналізу мутних і забарвлених розчинів (вина, соки). Їх використовують в реакціях протолітичних, окисно-відновних, коплексоутворення. Так, Си2+ титрують флуорексоном в присутності Ni,Fe,Mn та інших в розчинах, які містять 0,01-0,1 мкг/мл Сu. Відомі такі люмінесцентні індикатори. 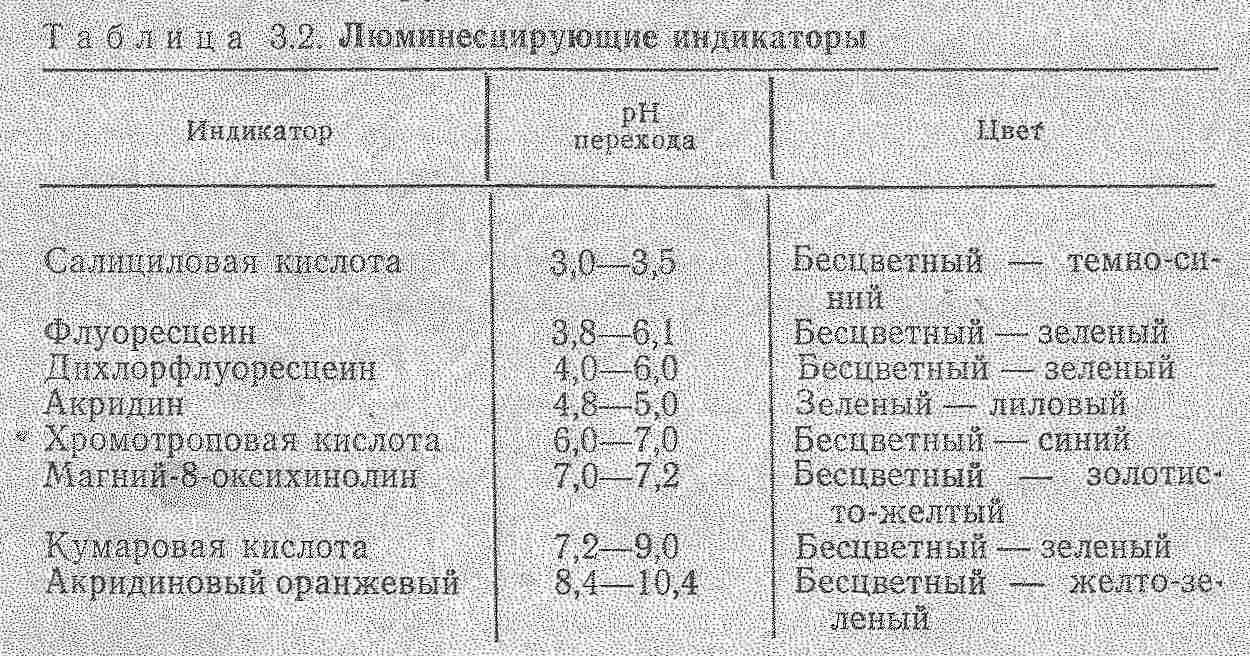 Суттєво збільшується люмінесценція речовин при заморожуванні, що використовують в люмінесцентному аналізі. Приклад: при охолодженні до -196°С розчин, який містить Pb в концентрованій НСl, дає фіолетове забарвлення. 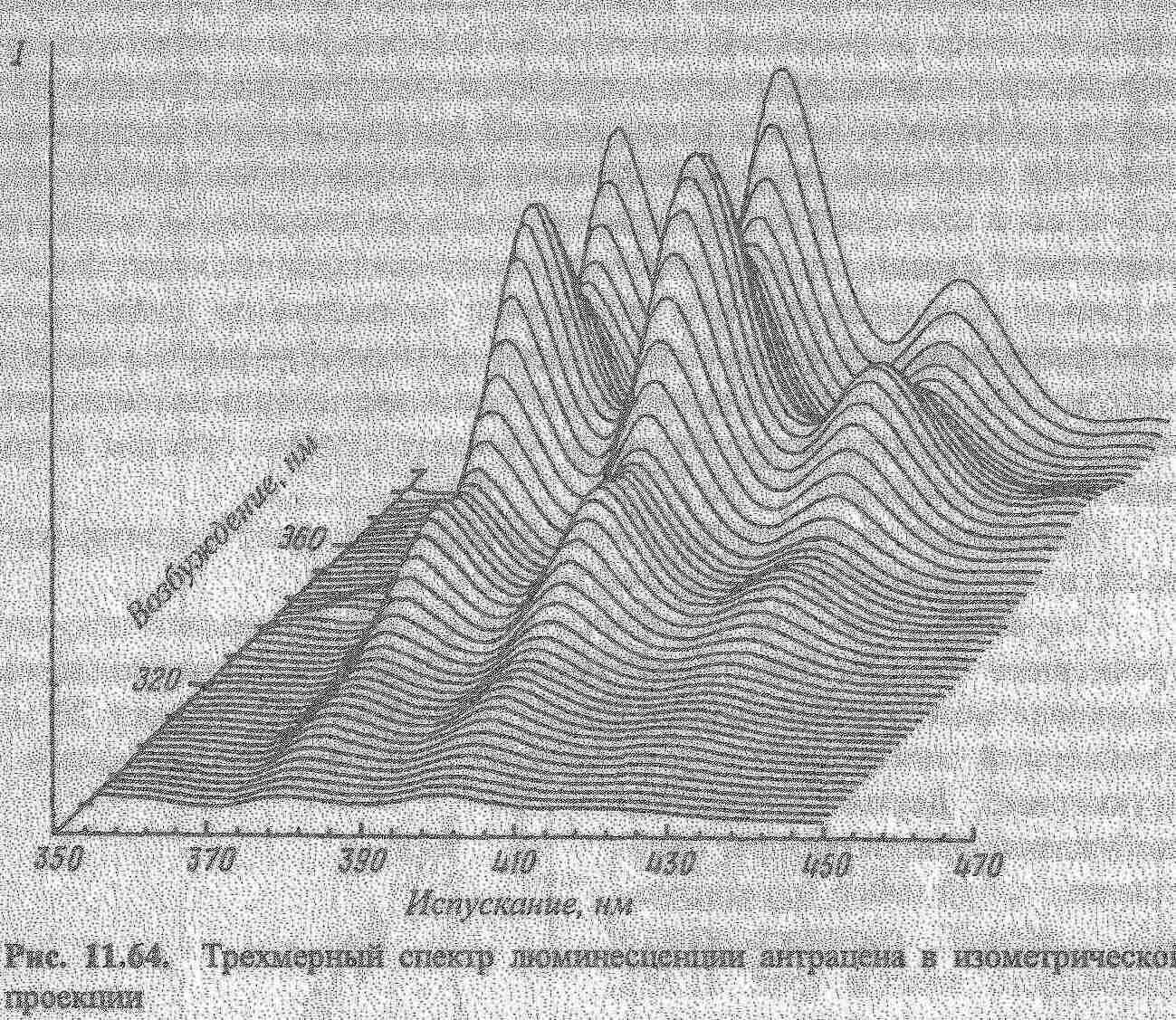 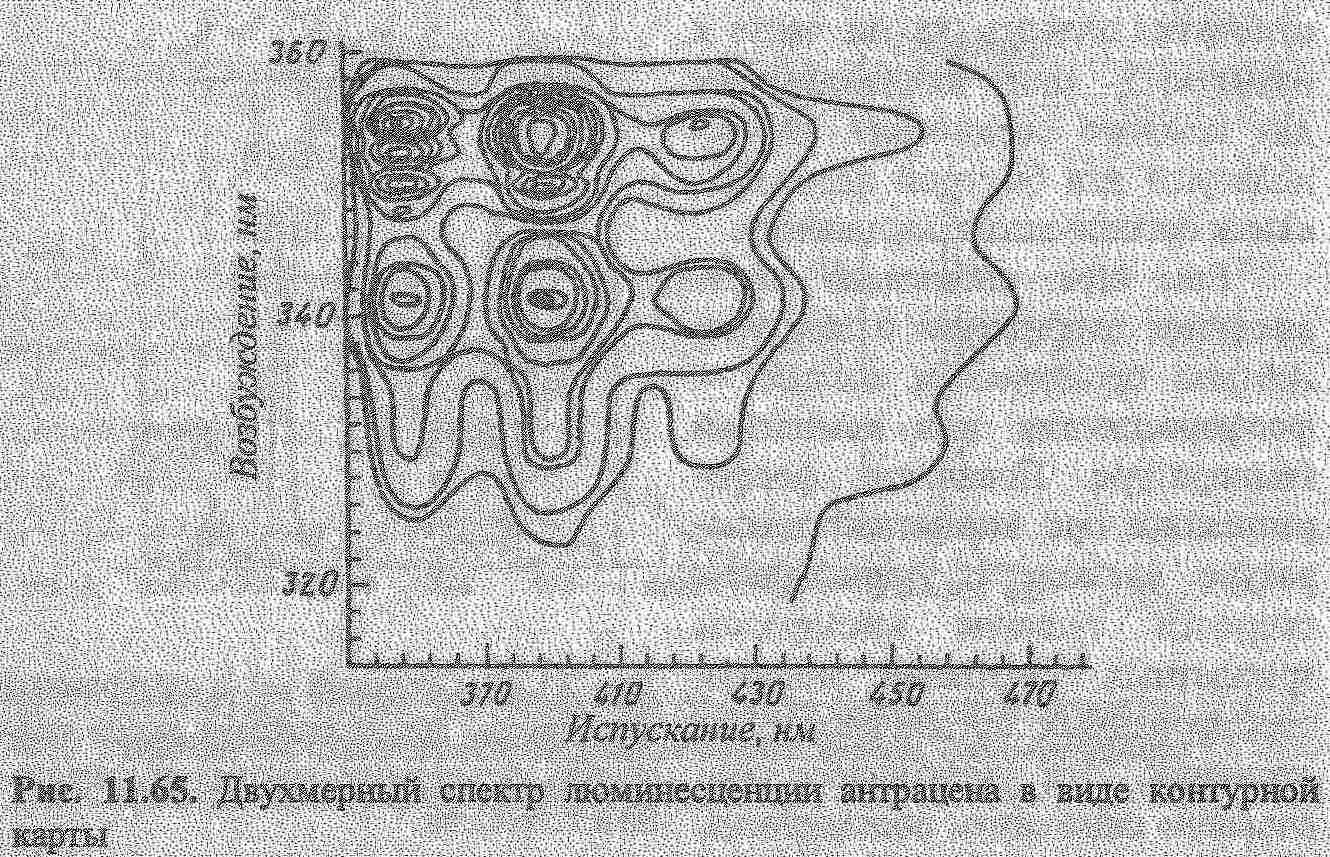 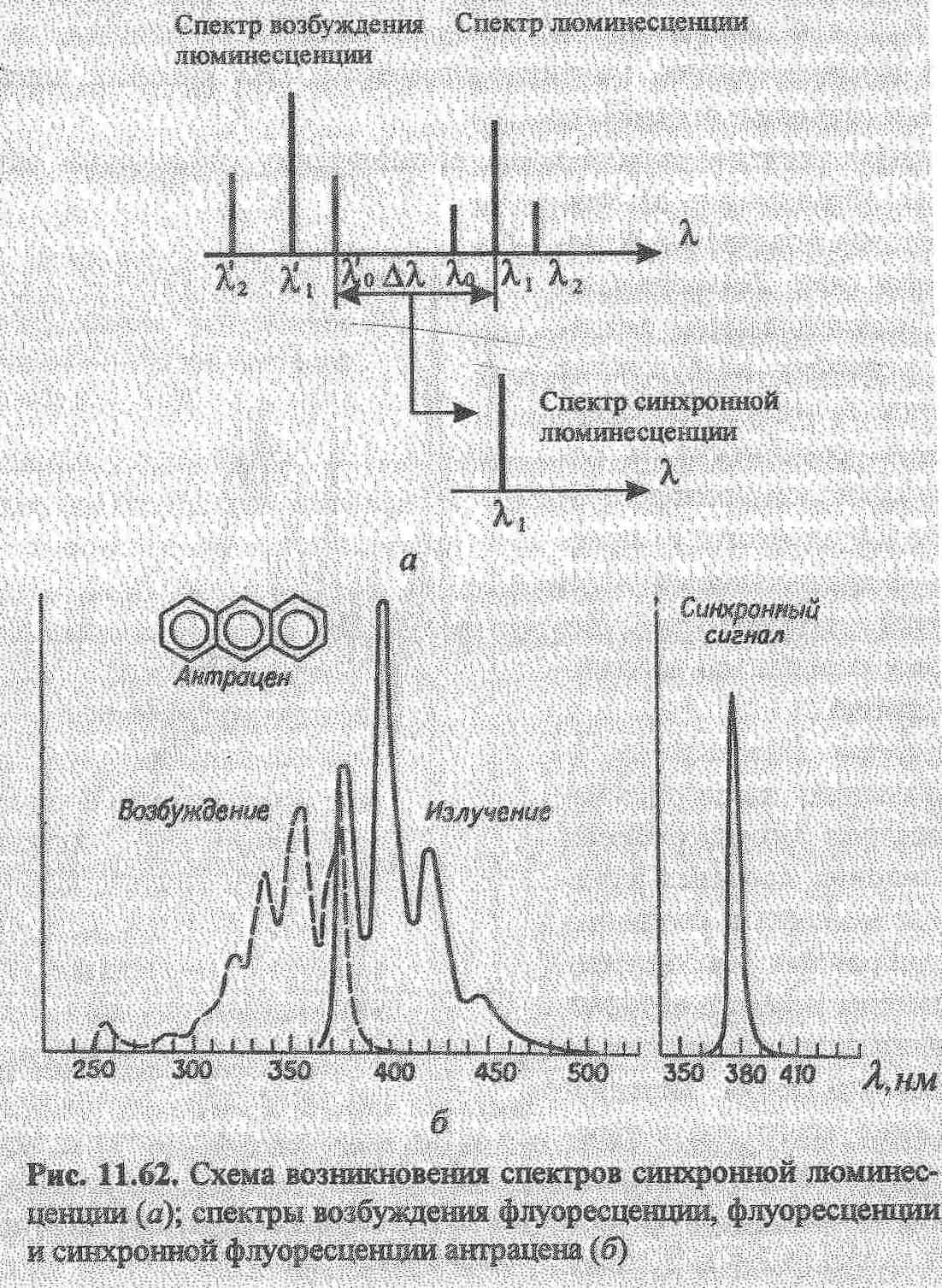 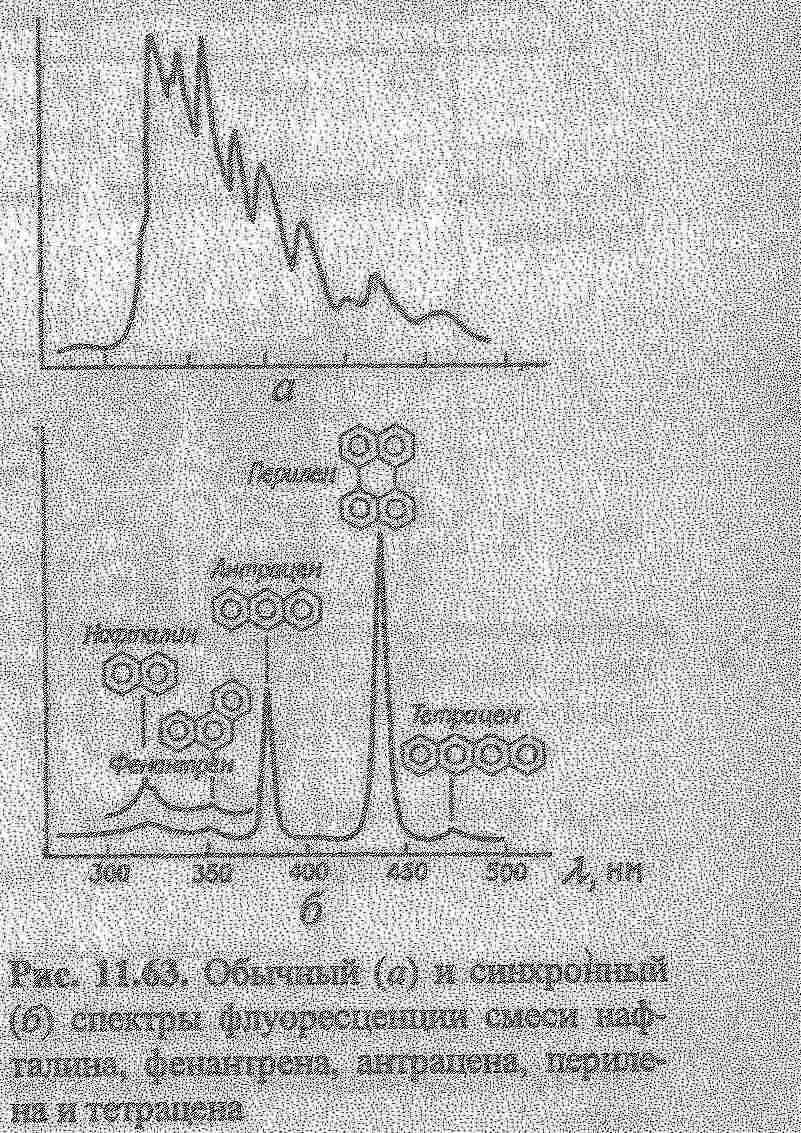
В біології та медицині:
В сільському господарстві та харчовій промисловості:
(життєздатне – жовте світіння ; нежиттєздатне - коричневе)
( чим більше висівок, тим інтенсивніше світіння)
Оптико-механічна промисловість
Гумова промисловість Паперова промисловість
Алмазо добувна промисловість
Охорона навколишнього середовища
Археологія ( вилинялі старинні рукописи) Криміналістика Судекспертиза Дефектоскопія
Географія
Це силовий метод, тобто, сигнал збільшується зі збільшенням інтенсивності джерела випромінювання.
(для порівняння в спектрофотометрії 10-5М або 1 мкг/мл); Метод використовують для визначення мікродомішок.
зараз розроблені методи для кількісного визначення майже всіх елементів при вмісті 10-5М, багатьох органічних, біологічно активних речовин та інших речовин.
Література:
|
