лекция по химии. лк 19. Лекция. Произведение растворимости
 Скачать 40.21 Kb. Скачать 40.21 Kb.
|
|
Лекция. Произведе́ние раствори́мости (ПР Ksp) Это произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянных температуре и давлении. Произведение растворимости — величина постоянная. Большинство веществ обладают малой растворимостью в воде и других растворителях. В насыщенном растворе малорастворимого электролита устанавливается гетерогенное равновесие между твердой фазой и ионами, образующимися при частичном растворении осадка. Большинство веществ обладают малой растворимостью в воде и других растворителях. В насыщенном растворе малорастворимого электролита устанавливается гетерогенное равновесие между твердой фазой и ионами, образующимися при частичном растворении осадка. Так, в насыщенном растворе электролита АnBm, находящегося в равновесии с его твердой фазой, будет протекать следующий обратимый процесс: Так, в насыщенном растворе электролита АnBm, находящегося в равновесии с его твердой фазой, будет протекать следующий обратимый процесс: 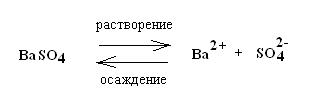 Этот процесс протекает на поверхности осадка. Состояние этого равновесия по закону действующих масс количественно характеризуется константой, называемой произведением растворимости (ПР): ПР зависит от природы растворителя и растворенного вещества, от температуры и не зависит от концентрации ионов в растворе. К такой системе применим закон действующих масс: 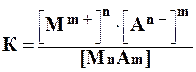 Константа равновесия не зависит от абсолютного количества твердой фазы и при данной температуре является величиной постоянной. ПР(MnAm) = [Mm+]n · [An-]m Произведение растворимости и растворимость вещества являются характеристиками малорастворимого вещества, между этими величинами существует тесная связь. По известной растворимости вещества можно найти значение произведения растворимости и наоборот. Растворимость (S) – это максимально возможная концентрация вещества в растворе, выражается в г/л, г/100 г Н2О. Молярная растворимость S совпадает с молярной концентрацией насыщенного раствора, выражается в моль/л и связана с ПР: ПР(AnBm)=[Am+]n[Bn–]m=(nS)n•(mS)m. Для двухионных электролитов, например AgCl(n=1,m=1): ПР(AgCl)=[Ag+][Cl–]=S2(AgCl) Для трехионных электролитов, например CaF2(n=1,m=2): ПР(CaF2)=[Ca2+][F]2=S(2S)2=4S3. Следовательно, произведение растворимости и растворимость – взаимосвязанные величины, поэтому Равновесные молярные концентрации ионов Mm+ и An- пропорциональны растворимости S (моль/л) вещества МnАm: [Mm+] = n * S [An-] = m * S, Под растворимостью обычно понимают концентрацию ионов металла в насыщенном растворе малорастворимой соли. тогда ПР = (n * S)n * (m * S)m . По значениям ПР можно сравнивать растворимость различных веществ. Например, из значений ПР для CaF2 (4,0*10-11) и BaF2 (1,7*10-6) можно заключить, что фторид кальция хуже растворим, чем фторид бария. Численные значения произведения растворимостей приведены в справочниках (cм. приложение). Пользуясь ими, можно вычислить растворимость малорастворимого электролита в системе: раствор - осадок. Напоминаем, что растворимость S малорастворимого соединения - это концентрация его ионов в растворе над осадком. ПРИМЕР 1 Произведения растворимости AgCl и Ag2CО3 равны соответственно 1,6*10-10 и 6,2*10-12 при 250С. Какая соль более растворима? Решение: Определим молярные концентрации ионов в насыщенных водных растворах. AgCl = Ag++Cl- Если с1 моль AgCl перешло в раствор, то [Ag+] = [С1-] = с1. ПР(АgС1) = [Ag+] [С1-] = c12 Для второй соли: Ag2CО3 = 2Ag+ + CO32- Если растворилось с2 моль Ag2CО3, то: [Ag+] = 2с2; [СO32-] = с2; ПР (Ag2CО3) = [Ag+]2 ? [СО32-] = (2c2)2 ? c2 = 4c23; При сравнении с1 и с2 видно, что растворимость карбоната серебра в 10 раз выше растворимости хлорида серебра, хотя ПРAgCl > ПРAg2C03 и, казалось бы, растворимость АgС1 должна быть выше. Расчет показывает, что качественное сравнение растворимостей по величине ПР возможно лишь для веществ, образующих в растворах одинаковое суммарное число ионов. Например: ПРAgCl = 1,6 * 10-10; ПРAgI = l,0 * 10-16; с(AgCl) > с(AgI); ПРAg2CO3 = 6,2 ? 10-12; ПРAg2CrO4 = 2,0 ? 10-12; с(Ag2CO3) > c(Ag2CrO4). Соотношения (3.2) и (3.3) позволяют рассчитывать значения ПР по известной растворимости веществ и, наоборот, растворимость веществ по известным ПР при Т= const. ПРИМЕР 3. Определите ПР фторида магния, если его растворимость (S) в воде равна 0,001 моль/л при некоторой температуре. Решение: Mg2+ + 2F- ↔ MgF2(T). ПP = [Mg2 + ][F-]2 = S · (2S)2 = 4 · S3 = 4 · (0,001)3 = 4 *10-9. ПРИМЕР 3Растворимость Ag2CО3 равна 3,17·10-2г/л (при 200С). Вычислить произведение растворимости. Решение: Пересчитаем концентрацию Ag2CO3, выраженную по условию задачи в граммах на литр, в моль на литр. Для этого разделим растворимость Ag2CO3 в единицах моль/л на молярную массу Ag2CO3: Составляем уравнение диссоциации соли: Ag2CО3 ↔ 2Ag+ + CO32-. 1 моль Ag2CO3 распадается на 2 моль Ag+ и 1 моль СО32-. Следовательно, 1,15 · 10-4 моль Ag2CO3 дают 2,3 · 10-4 моль Ag+ и 1,15 · 10-4 моль СО32-. Отсюда: [Аg+] = 2,3 · 10-4 и [СО32-]= 1,15 · 10-4. Вычисляем ПР: ПР = [Аg+]2 · [СО32-] = (2,3 · 10-4)2 · ( 1,15 · 10-4) = 6,08 · 10-12. Произведение растворимости и растворимость вещества являются характеристиками малорастворимого вещества, между этими величинами существует тесная связь. Растворимость (S) – это максимально возможная концентрация вещества в растворе, выражается в г/л, г/100 г Н2О. Молярная растворимость S совпадает с молярной концентрацией насыщенного раствора, выражается в моль/л и связана с ПР: ПР(AnBm)=[Am+]n[Bn–]m=(nS)n•(mS)m. Для двухионных электролитов, например AgCl(n=1,m=1): ПР(AgCl)=[Ag+][Cl–]=S2(AgCl) Для трехионных электролитов, например CaF2(n=1,m=2): ПР(CaF2)=[Ca2+][F]2=S(2S)2=4S3. Следовательно, произведение растворимости и растворимость – взаимосвязанные величины, поэтому по известной растворимости вещества можно найти значение произведения растворимости и наоборот. Вычисление произведения растворимости малорастворимого электролита При расчете произведения растворимости необходимо перевести в молярную растворимость (моль/л) растворимость, выраженную в г/л или г/100 г Н2О. Для перехода растворимости, выраженной в г/100 г Н2О, к молярной концентрации можно принять объем насыщенного раствора »100 мл, учитывая малую растворимость электролита в Н2О. Пример. Растворимость Mg(OH)2 при 18°С равна 0,012 г/л. Вычислите ПР(Mg(OH)2). Молярная масса Mg(OH)2: М(Mg(OH)2)=58 г/моль. Рассчитаем молярную растворимость Mg(OH)2 S(Mg(OH)2) = L : M(Mg(OH)2) = 0,012 : 58 = 2,07•10–4 моль/л Молярная растворимость совпадает с молярной концентрацией соли в растворе: С(Mg(OH)2) = S(Mg(OH)2) = 2,07•10–4 моль/л Найдем равновесные молярные концентрации ионов в растворе: Mg(OH)2 « Mg2+ + 2OH– [Mg2+] = S =2,07•10–4 моль/л [ОН–] = 2S = 2,07•10–4•2 = 4,14•10–4 моль/л Тогда ПР(Mg(OH)2) = [Mg2+][OH–]2; ПР(Mg(OH)2) = 2,07•10–4•(4,14•10–4)2 = 3,5•10–11 Вычисление концентрации ионов и растворимости малорастворимого электролита в его насыщенном растворе Пример. Произведение растворимости PbJ2 при 18°С равно 1,4•10–8. Рассчитайте концентрации ионов Pb2+ и J– и молярную растворимость PbJ2 « Pb2+ + 2J– ПР(PbJ2) = [Pb2+][J–]2 Обозначим молярную растворимость соли – S моль/л. Тогда концентрации ионов равны: [Pb2+] = S [J–] = 2S Следовательно ПР(PbJ2) = [Pb2+][J–]2 ПР(PbJ2) = S(2S)2 = 4S3 1,4•10–8 = 4S3 Молярная растворимость соли равна 1,5•10–3 моль/л. Концентрации ионов равны: [Pb2+] = 1,5•10–3 моль/л [J–] = 2•1,5•10–3 = 3,0•10–3 моль/л. Чтобы от молярной растворимости перейти к растворимости в г/л, необходимо молярную растворимость умножить на молярную массу вещества. L = S•M(PbJ2) = 1,5•10–3•461 = 0,692 г/л. Условия образования осадков При проведении реакций в растворе, в результате которых возможно образование осадка, необходимо соблюдать определенные требования к выбору концентраций реагентов. Условие образования осадка: произведение молярных концентраций ионов, возведенных в степень стехиометрических коэффициентов (ПК), должно быть больше величины произведения растворимости (ПР): AnBm « nAm+ + mBn– ПК(AnBm) = (CA+m)n•(CB–n)m > ПР(AnBm) Если ПК(AnBm) < ПР(AnBm), то осадок не образуется. Следовательно, зная концентрации ионов малорастворимого электролита в растворе, можно ориентировочно оценить, выпадет ли в данном случае осадок. Пример. Произведение растворимости Fe(OH)2 при 25°С равно 1,65•10–15. Выпадет ли осадок при смешивании 4 мл 0,04н. FeSO4 и 6 мл 0,01М NaOH? Решение. Молекулярное уравнение реакции FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4 Ионно-молекулярное уравнение реакции Fe2+ + 2OH– = Fe(OH)2 Для определения условия образования осадка необходимо рассчитать ПК ПК(Fe(OH)2) = [Fe2+][OH–]2 Для нахождения ПК нужно найти концентрации Fe2+ и ОН– после смешивания растворов заданной концентрации. Определяем исходные концентрации ионов до сливания растворов: NaOH « Na+ + OH– [ОН–]=0,01 моль/л 0,01 моль/л 0,01 моль/л Для определения концентрации ионов Fe2+ нужно перевести нормальную концентрацию FeSO4 в молярную. fэк(FeSO4) = 1/2 0,04н FeSO4 = 0,02M FeSO4 FeSO4 « Fe2+ + SO42– 0,02 моль/л 0,02 моль/л Определяем концентрацию ионов после смешивания растворов. Объем раствора после смешивания 4 мл FeSO4 и 6 мл NaOH стал 10 мл. Концентрация ионов после смешивания растворов 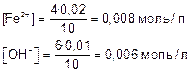 Находим произведение концентраций ПК(Fe(OH)2) = [Fe2+][OH–]2 ПК(Fe(OH)2) = 0,008 • 0,0062 = 2,88•10–7 Сравниваем ПК с ПР (приложение, табл.3) 2,88•10–7 > 1,65•10–15 Следовательно при сливании 4 мл 0,004н. раствора FeSO4 и 6 мл 0,01М раствора NaOH образуется осадок Fe(OH)2. Исходные данные и результаты расчета заносим в таблицу.
| |||||||||||||
