электрохимия 2. Отчет по лабораторной работе Определение произведения растворимости малорастворимой соли по электрической проводимости раствора
 Скачать 23.86 Kb. Скачать 23.86 Kb.
|
|
Министерство образования и науки Российской Федерации «Иркутский национальный исследовательский технический университет» Институт высоких технологий Кафедра химии и пищевой технологии им. проф. В.В. Тутуриной Отчет по лабораторной работе Определение произведения растворимости малорастворимой соли по электрической проводимости раствора Выполнил студент группы: ХТТб-20-1 Ваткина М.А. Проверил преподаватель: Филатова Е.Г. Иркутск 2021 Цель работы: Ознакомление с кондуктометрическим методом определения растворимости малорастворимых солей с использованием кондуктометра. Задание: измерить удельные электрические проводимости растворов малорастворимых солей, рассчитать их эквивалентные электрические проводимости, рассчитать насыщенную концентрацию каждого раствора и произведение растворимости каждой соли. Приборы и материалы: кондуктометр в комплекте с электролитической ячейкой, термометр, стаканчики на 100–200 см3. Реактивы: насыщенные растворы PbCl2; PbCO3; BaF2; NiCO3 и дистиллированная вода. Теоретическое введение Электрохимия – отдел физической химии, изучающий связь электрических и химических процессов. 1) Малорастворимые соли над своим осадком находятся в состоянии насыщения и в то же время — это состояние раствора соответствует предельно разбавленным условиям, что делает их удобными объектами для кондуктометрических измерений и нахождения аналитических характеристик. 2) Произведение растворимости – постоянная величина, равная произведению концентраций (активностей) ионов малорастворимого электролита в его насыщенном растворе. В более широком смысле произведение растворимости – это произведение активностей, а не концентраций ионов в насыщенном растворе электролита. Произведение растворимости характеризует способность электролита растворяться, величину ПР необходимо знать для реакций с образованием осадков. ПР зависит от температуры и природы растворителя. 3) Метод определения растворимости соли по удельной электрической проводимости раствора основан на измерении электрической проводимости растворов электролитов 4) Методика экспериментального измерения электролитической проводимости растворов электролитов заключается в том, что исследуемый раствор заливается в электролитическую ячейку, которая представляет собой два плоскопараллельных электрода, погружаемые в раствор. Кондуктометрический метод предполагает, что электролитическая ячейка включена в одно из плечей моста Уитстона. Для повышения точности делают несколько измерений с растворами разных концентраций. 5) Уравнение закона Кольрауша для предельно разбавленных растворов имеет вид: 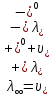 6) Электрическая проводимость растворов электролитов зависит от температуры, но обобщающих закономерностей на этот счет в настоящее время немного. В лабораторной работе «Определение растворимости малорастворимой соли» для определения растворимости малорастворимой соли используется кондуктометрический метод, основанный на использовании зависимости электрической проводимости растворов электролитов от их концентрации. Определение проводят с помощью кондуктометра. Работа состоит из измерения удельной электрической проводимости насыщенных растворов и дистиллированной воды с помощью кондуктометра. Порядок выполнения работы С помощью стаканчика в тщательно промытую дистиллированной водой электролитическую ячейку налить такое количество раствора хлористого свинца, чтобы электроды были погружены в раствор. Измерить электрическую проводимость налитого в ячейку раствора. При проведении замеров пользоваться инструкцией к прибору. Аналогичные замеры электрической проводимости проделать с растворами углекислого свинца, углекислого никеля и фтористого бария. Записать полученные результаты в таблицу. Предельные подвижности ионов в водных растворах
Растворы хранятся над осадком собственной соли в бутылях, поэтому наливать их в рабочие стаканчики нужно осторожно, не взмучивая осадка. В электролитическую ячейку переливать только прозрачные растворы. При переходе к следующему растворы ячейку промывать дистиллированной водой самым тщательным образом. Аналогично измерить удельную электрическую проводимость дистиллированной воды. Выписать из следующей таблицы справочные значения предельных подвижностей ионов. Рассчитать величины 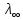 по закону Кольрауша по закону Кольрауша 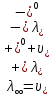 , где , где 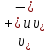 - число катионов и анионов, образующихся при диссоциации, по сути это стехиометрические коэффициенты уравнения диссоциации, например, для хлористого свинца, который диссоциирует по схеме - число катионов и анионов, образующихся при диссоциации, по сути это стехиометрические коэффициенты уравнения диссоциации, например, для хлористого свинца, который диссоциирует по схеме PbCl2 = Pb2+ + 2Cl-, стехиометрические коэффициенты составляют 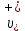 = 1 и = 1 и 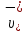 = 2. = 2.Рассчитать молярные концентрации эквивалентов вещества по формуле C 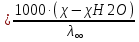 , ,где 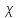 Н2О – удельная электрическая проводимость воды, справочное значение которой составляет 4,85 Н2О – удельная электрическая проводимость воды, справочное значение которой составляет 4,85  10-8 см/см при 293 К. Если экспериментально определенное значение оказалось выше, рекомендуется использовать справочное значение. 10-8 см/см при 293 К. Если экспериментально определенное значение оказалось выше, рекомендуется использовать справочное значение.Результаты опытов и расчетные данные
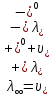 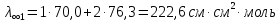 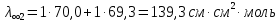 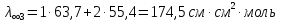 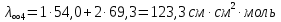 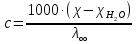 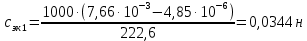 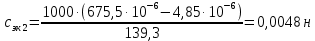 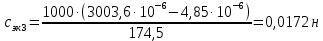 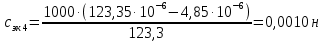 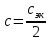 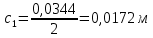 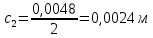 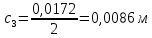 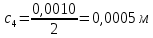 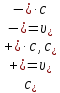 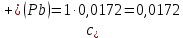 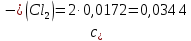 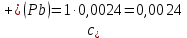 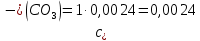 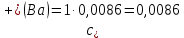 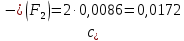 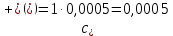 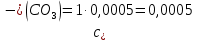 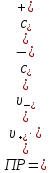 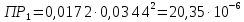 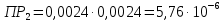 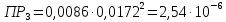 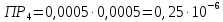 Справочные значения произведения растворимости, используемых солей:
Вывод: В ходе лабораторной работы был изучен кондуктометрический метод, измерена электрическая проводимость на кондуктометре, рассчитаны величины предельных подвижностей ионов в водных растворах, ионные концентрации, молярные концентрации и молярные концентрации эквивалентов веществ. После вычисления ионных концентраций были рассчитаны произведения растворимости солей, сравнены расчетные и справочные значения. Расчетные значения не значительно отличаются от справочных, кондуктометрический метод обладает достаточно высокой точность (относительная погрешность определения 0,1-2 %). Контрольные вопросы Почему насыщенные растворы малорастворимых солей относятся к предельно разбавленным растворам? Малорастворимые соли над своим осадком находятся в состоянии насыщения и в то же время — это состояние раствора соответствует предельно разбавленным условиям, что делает их удобными объектами для кондуктометрических измерений и нахождения аналитических характеристик. При растворении соли в насыщенном растворе устанавливается равновесие между твердой солью и перешедшими в раствор ионами, представленное уравнением ионизации. Что такое произведение растворимости и какую информацию несет эта величина? От каких факторов зависит произведение растворимости? В более широком смысле произведение растворимости – это произведение активностей, а не концентраций ионов в насыщенном растворе электролита. Произведение растворимости – постоянная величина, равная произведению концентраций (активностей) ионов малорастворимого электролита в его насыщенном растворе. При отсутствии в растворе посторонних ионов произведение активностей можно заменить произведением концентраций. Произведение растворимости характеризует способность электролита растворяться и является важной аналитической характеристикой, например, величину ПР необходимо знать для реакций с образованием осадков. При данной температуре произведение растворимости является постоянной величиной, которую можно найти в справочнике физико– химических величин. ПР зависит от температуры и природы растворителя. На чем основан метод определения растворимости соли по удельной электрической проводимости раствора? Метод основан на измерении электрической проводимости растворов электролитов. Электрическая проводимость (или электропроводность), как явление, заключается в направленном перемещении ионов к электродам в электрическом поле, она обеспечивается потоком мигрирующих ионов, когда градиент химического потенциала исключен. Растворимость труднорастворимых солей определяется измерением удельной электрической проводимости насыщенного раствора данной соли при постоянной температуре. В чем заключается методика экспериментального измерения электролитической проводимости растворов электролитов? Исследуемый раствор заливается в электролитическую ячейку, которая представляет собой два плоскопараллельных электрода, погружаемые в раствор. Кондуктометрический метод предполагает, что электролитическая ячейка включена в одно из плечей моста Уитстона. Для повышения точности делают несколько измерений с растворами разных концентраций.В бутылях растворы хранятся над осадком собственной соли, наливать их в рабочие стаканчики нужно осторожно, не взмучивая осадка. В электролитическую ячейку переливать только прозрачные растворы Какой вид имеет уравнение закона Кольрауша для предельно разбавленных растворов 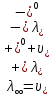 Каковы причины влияния температуры на электрическую проводимость растворов электролитов? Электрическая проводимость растворов электролитов зависит от температуры, но обобщающих закономерностей на этот счет в настоящее время немного. Раствор, находящийся в фазовом равновесии с растворяемым веществом, называется насыщенным. Растворимость вещества − это его способность растворяться в данном растворителе при определенных условиях. Количественно растворимость выражают концентрацией насыщенного раствора данного вещества при заданных температуре и давлении. Кондуктометр – это высокоточный измерительный прибор, который предназначается для определения электропроводности различных электролитов. |

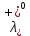 см2∙См/моль
см2∙См/моль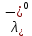 см2∙См/моль
см2∙См/моль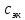 (В),н
(В),н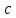 (В), М
(В), М